基于线粒体途径探索马兰草脐灸促肝纤维化模型大鼠活化肝星状细胞凋亡机制研究*
李 嘉,高 玲,施杨婉玲,田源红,杨孝芳,陈迎龙
(贵州中医药大学,贵阳 550025)
肝纤维化(hepatic fibrosis,HF)以肝组织细胞外基质(extracellular matrix,ECM)的过度增生和异常沉积为病理基础,是各种慢性肝病导致的共同结果,其病因包括病毒感染、胆汁瘀积以及酒精和药物损伤等,若不能进行有效治疗,最终会导致肝衰竭、门脉高压甚至危及生命[1]。研究表明,早期的HF是可逆的[2-3],其中肝星状细胞(hepatic stellate cells,HSCs)的活化是HF发生的细胞学基础,目前许多药物主要以诱导活化的HSCs凋亡作为防治HF的有效靶点[4]。马兰草作为贵州特色道地苗药材,在民间常煎服用于治疗传染性肝炎、水肿、黄疸等,其性味辛、苦、寒,归肺经、肝经、胃经、大肠经,有清热解毒、散瘀止血消积之功。课题组前期研究初步发现,中药口服辨证组方可改善肝硬化腹水大鼠线粒体能量代谢,马兰草脐灸对肝硬化腹水大鼠肝功能、线粒体有影响作用[5]。故本研究拟将马兰草绒制作为灸材,通过灸脐干预来观察HF大鼠肝组织结构的病理改变与相关因子的表达变化。本实验已通过贵州中医药大学实验动物伦理委员会审查。
1 材料
1.1 动物
SPF级雄性Wistar大鼠40只,体质量(180±220) g,由广州中医药大学实验动物中心实验室提供,实验动物许可证号SCXK(粤)2016-0020。
1.2 药物及制备
苯巴比妥片(国药准字H31022038),上海信宜药厂有限公司;秋水仙碱片(国药准字H53021369),西双版纳药业有限公司。课题组前期选取贵阳市花溪区干燥的马兰草药材,剪碎并精密称取100 g加蒸馏水1000 mL,精密吸取马兰草挥发油0.025 mL制备供试品溶液,并进行色谱条件与方法学考察对药材粉碎粒度的燃烧时间、速率进行考察及燃烧及烟雾量的测定,最终确定马兰草绒的制备工艺:将马兰全草粉碎过40目药筛即得。本研究将适量马兰全草灸绒制作为灸柱置于大鼠脐处施灸。
1.3 试剂及仪器
CCl4(分析纯,批号2008121),江苏强盛化工有限公司;橄榄油(批号LB-10-100627005344),陇南市祥宇油橄榄开发有限责任公司;多聚甲醛(P0099)、山羊血清(批号C0265)、DAPI(批号C1005)、TritonX-100(批号ST795)、抗荧光淬灭剂(批号P0126),上海碧云天生物技术有限公司;Bax一抗(批号Ab32503),英国Abcam公司;Bcl-2一抗(批号Ab32124),英国Abcam公司;COX活性检测试剂盒(批号HL10014.3.1),上海哈灵生物科技有限公司;TUNEL细胞凋亡检测试剂盒(批号KGA1045),南京凯基生物科技发展有限公司;BCA试剂盒(批号20181015),中日合资Solarbio公司。
Precisa12 A型电子分析天平(瑞士公司,BSA224S,万分之一);DHG-9240 A型电热恒温鼓风干燥箱(上海跃进医疗器械厂);Mini PROTEAN Tetra Cell型垂直电泳仪(美国Bio-Rad);CFX96型荧光定量仪(美国Bio-Rad公司);CKK53型倒置显微镜(日本OLYMPUS公司);TCS-SP8型激光共聚焦成像系统(德国Leica公司);HB-RO/60型超纯水仪(美国Millipore公司);RM2235、HI1210和HI1220型切片机、展片机和烤片机(德国Leica公司)。
2 方法
2.1 动物分组及建模
所有大鼠实验室适应性喂养1周后,按随机数字表法分成空白组、模型组、马兰草脐灸组、秋水仙碱组4组各10只。各组同期造模,实验第1天除空白组大鼠外,其余各组大鼠均皮下注射40% CCl4橄榄油,注射剂量5.0 mL/kg(注射剂量/大鼠体质量),以后每周3次皮下注射40% CCl4橄榄油,注射剂量3.0 mL/kg (注射剂量/大鼠体质量),连续8周直至动物处死前1 d。
2.2 干预方法
空白组正常喂食喂水,抓取大鼠放入自制大鼠固定器仰卧位固定,固定时间同马兰草灸组大鼠施灸时间,连续干预8周直至动物处死前1 d。模型组抓取大鼠放入自制大鼠固定器仰卧位固定,固定时间同马兰草灸组大鼠施灸时间,连续干预8周直至动物处死前1 d。马兰草脐灸组:马兰草灸神阙穴,每次每穴3壮。大鼠神阙取穴按照《实验针灸学》[6]并结合人体穴位的模拟位置取穴。穴位位于大鼠胸腹正中线,胸骨柄上缘至外生殖器连线的上3/4及下1/4交界处。穴位选定后剪毛,施灸时涂凡士林以保护小鼠皮肤且便于固定艾炷。马兰草灸炷做得紧而结实(底座直径2 mm,高度5 mm,质量3~15 mg),用线香点燃,每壮时间为18~20 s,当小鼠挣扎时更换,每次3壮,连续干预8周直至动物处死前1 d。秋水仙碱组(将秋水仙碱药片磨碎,制成水溶液,每1 mL水中含0.1 mg秋水仙碱)5.0 mL/kg(秋水仙碱含量/大鼠体质量)灌胃,每日1次,首次造模次日开始给药,药物浓度及等效剂量按体质量折算,连续干预8周直至动物处死前1 d。
2.3 取血及取材
自首次造模开始计算日期,于第8周末当晚大鼠禁食不禁水12 h,次日上午最后1次称取体质量后,用10%水合氯酸3.0 mL/kg大鼠体质量腹腔注射麻醉,手术台固定大鼠,用手术剪刀打开腹腔,真空采血管腹主动脉取血保存,做离心取血清准备工作。提取肝脏(全部6片肝叶)4 ℃生理盐水冲洗,去除薄膜和残留组织,称肝脏质量,每组各取3只大鼠肝脏全部浸泡于10%中性福尔马林做肝脏外观观察使用,剩余全部肝脏用锡纸包裹标记后装入布袋中,放入液氮保存备检其他指标。每组大鼠随即挑选3只,于肝右叶离边缘1 cm处切取1块肝组织(0.5 cm×0.5 cm×0.5 cm),10%中性福尔马林固定,做石蜡切片准备。所釆血样4 ℃静置2 h后,3000 rpm离心10 min分离血清,舍弃出现溶血现象的血清,其余分装EP管,放入液氮保存备检其他指标。
2.4 指标检测
2.4.1 观察大鼠外观情况及肝脏大体形态 每日观察大鼠生长、进食、进水、毛色、粪便、活动、死亡情况,观察肝脏大体形态如体积、色泽、切口等。
2.4.2 血清肝功能指标测定 采集门静脉采血2 ml,将血样进行低温离心分离,取上清液,用全自动生化仪检测谷丙转氨酶(ALT)、谷草转氨酶(AST)、白蛋白(ALB)。
2.4.3 肝组织苏木精-伊红染色(hematoxylin-eosin staining,HE) 石蜡切片行HE染色,按照常规方法脱离、染色、透明和封固,镜下观察组织形态。
2.4.4 肝组织羟脯氨酸(hydroxyproline, Hyp)含量和细胞色素c氧化酶(cytochrome c oxidase, COX)活性测定 冰冻肝组织用于检测Hyp含量,根据Hyp测试盒的说明书操作。另取新鲜肝组织用电动匀浆器制备匀浆液,匀浆液缓冲成分(mmol/l)蔗糖250,Tris-Hcl5、EDTA1、PH值7.4。将匀浆液离心2000 g/10 min弃沉淀收集上清,重复离心收集上清,再离心12000 g/15 min,收集沉淀即得线粒体。取10ul制备好的线粒体悬浮液,将含亚铁细胞色素C的反应底物加入,使亚铁细胞色素C氧化成高铁细胞色素C,按试剂盒介绍步骤使用分光光度法进行测定。
2.4.5 免疫印迹法(western blotting,WB)检测肝组织中B细胞淋巴瘤-2 (b-cell lymphoma-2, Bcl-2)、相关X蛋白(bcl-2 associated x protein, Bax)蛋白表达 蛋白裂解测定浓度,加样60μg蛋白缓冲,沸水浴5 min,配置10%分离胶和5%的浓缩胶,上样电泳分离,转移至PVDF膜。封闭1 h,加入稀释一抗(TBST溶解的5%BSA)(兔抗Bax单克隆一抗1∶2000,兔抗Bcl-2单克隆一抗1∶1000),4 ℃过夜;TBST洗3次,每次5 min;加入稀释二抗(TBST溶解5%脱脂牛奶)(HRP山羊抗兔IgG二抗1∶10000),室温下孵育30 min,TBST洗3次,每次5 min,采用ECL法显影曝光。
2.4.6 免疫荧光检测肝组织中Bcl-2、Bax蛋白表达 蒸馏水清洗后浸泡PBS 5 min,组织切片滴加0.5% TritonX-100室温打孔60 min,PBS漂洗3 min×3次,加入5%正常山羊血清封闭1 h,加入一抗(1∶200)湿盒4 ℃孵育过夜,室温孵育1 h,PBS漂洗3 min×3次,加入荧光二抗(1∶300)湿盒37 ℃孵育1 h。于暗处湿盒37 ℃孵育1 h,PBS漂洗3 min×3次,加入一抗(1∶200)湿盒37 ℃孵育1 h,PBS漂洗3 min×3次,加入荧光二抗488(1∶300)湿盒37 ℃孵育1 h,PBS漂洗3 min×3次,滴加DAPI避光孵育15 min,PBS 5 min×4次,洗去多余的DAPI,于激光扫描聚焦显微镜下(200X)观察采集图像。
2.4.7 dUTP缺口末端标记方法(TdT-mediated dUTP Nick-End Labeling,Tunel)-α-平滑肌动蛋白(smooth muscle actin, α-SMA)荧光双染检测活化HSCs凋亡情况 爬片PBS漂洗3 min×3次后吸干,6%山羊血清封闭30 min,分别滴加1∶100稀释的Anti α-SMA于湿盒4 ℃孵育过夜。37 ℃复温45 min,滴加1∶300的荧光二抗Anti488,湿盒室温孵育1 h,加0.01 M TBS 1∶200 新鲜稀释Proteinase K 37 ℃消化15 min。按每张切片取TdT和DIG-d-UTP各1 μL,加入18 μL标记缓冲液中混匀,甩去切片上多余液体后加20 μL/片标记液,置样品于湿盒中,37 ℃标记2 h,0.01 M TBS 洗2 min×3 次。封闭液50 μL/片,室温30 min后甩掉封闭液,用抗体稀释液1∶100稀释生物素化抗地高辛抗体:(取1 ml抗体稀释液加生物素化抗地高辛抗体10 μL),混匀后50 μL/片加至标本片上。置样品于湿盒中,37 ℃反应30 min,抗体稀释液1∶100稀释SABC-CY3,37 ℃反应30 min,滴加DAPI避光孵育3 min,核染,浸洗3 min×3次后封片,于激光扫描聚焦显微镜下(200X)观察采集图像。
2.5 统计学方法

3 结果
3.1 大鼠一般情况及肝脏大体形态
空白组大鼠活跃,进食饮水正常,毛色光亮润泽,反应灵敏,体质量正常均匀,无动物死亡,大便成颗粒状。模型组反应迟钝,造模后进食量和饮水减少,毛色晦暗、蓬松,体质量降低,活动受阻,粪便常见拉稀,无动物死亡;马兰草脐灸组和秋水仙碱组各指标均有明显好转。
图1示,空白组大鼠肝脏呈紫红色,质地柔软润泽;模型组肝脏呈鲜红色,质地干硬;马兰草脐灸组肝脏呈深褐色较润泽;秋水仙碱组呈半紫红半深褐色较润泽。

图1 大鼠肝脏大体形态比较
3.2 血清肝功能指标检测
表1示,与空白组大鼠比较,模型组大鼠血清ALT、AST水平均显著升高(P<0.05);与模型组比较,马兰草脐灸组和秋水仙碱组ALT、AST水平均明显降低(P<0.05),各组ALB水平变化均不明显(P<0.05)。

表1 血清肝功能指标检测比较
3.3 HF大鼠肝组织病理形态学观察
图2示,空白组肝脏HE染色结构完整清晰,细胞大小均匀,无变形坏死,细胞核明显;模型组可见大量炎症细胞浸润,肝细胞向脂肪变性;马兰草脐灸组可见炎性细胞减少,变性的脂肪细胞逐渐恢复;秋水仙碱组与马兰草脐灸组相似,可见脂肪细胞变性减少,有少量炎症细胞。
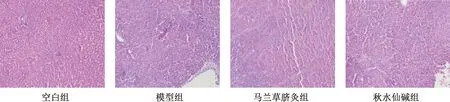
注:空白组;模型组;马兰草脐灸组;秋水仙碱组图2 HF大鼠肝组织HE染色(DAB×200)
3.4 肝组织中Hpy含量、线粒体COX活性测定
表2示,与空白组比较,模型组大鼠肝组织Hyp含量和COX水平均显著增加(P<0.05);与模型组比较,马兰草脐灸组和秋水仙碱组大鼠肝组织Hyp含量和COX水平均有显著下降(P<0.05)。

表2 Hpy含量、线粒体COX活性比较
3.5 Western Blotting检测大鼠肝组织Bcl-2、Bax蛋白表达
图3图4示,与空白组比较,模型组的Bcl-2有显著上升(P<0.05),Bax表达显著下降(P<0.05);与模型组比较,马兰草脐灸组的Bcl-2表达有显著下降(P<0.05),Bax表达显著上升(P<0.05),秋水仙碱组的Bcl-2、Bax蛋白表达均有所上升(P<0.05)。

图3 Western Blotting检测大鼠肝组织Bcl-2、Bax蛋白表达比较

注:与空白组比较:*P<0.05;与模型组比较:△P<0.05。图4 Western Blotting检测大鼠肝组织Bcl-2、Bax蛋白表达量
3.6 免疫荧光检测大鼠肝组织Bcl-2、Bax蛋白表达
图5示,绿色荧光为Bcl-2、Bax阳性细胞,广泛表达于胞浆。结果显示,与空白组比较,模型组Bcl-2表达显著增多,Bax表达量减少且荧光不显著;与模型组比较,马兰草脐灸组Bcl-2表达显著减少且荧光显著减弱,Bax表达显著增多,秋水仙碱组的Bcl-2、Bax表达量均显著增多且荧光显著增强。

图5 免疫荧光检测大鼠肝组织BCL-2、BAX蛋白表达比较(DAB×200)
3.7 Tunel-α-SMA荧光双染检测肝组织中活化的HSCs
图6示,绿色荧光为α-SMA阳性细胞,红色荧光为tunel阳性细胞,玫红色荧光为Tunel-α-SMA荧光双染阳性细胞并代表已凋亡的活化HSCs。结果显示,空白组无Tunel阳性细胞,有少量且不显著α-SMA阳性细胞;模型组有少量且不显著的Tunel阳性细胞,有大量且显著的α-SMA阳性细胞;与模型组比较,马兰草脐灸和秋水仙碱干预后的大鼠肝组织中α-SMA阳性细胞明显减少,荧光明显减弱,Tunel阳性细胞明显增多。

图6 Tunel-α-SMA荧光双染检测肝组织中活化的HSCs(DAB×200)
4 讨论
HF是由不同病因(乙肝、丙肝、酒精、药物等)所致的慢性创伤愈合反应,并由多种细胞因子、ECM等相互作用形成。其中静止的HSCs活化转变为肌成纤维细胞(myofibroblasts, MFB)的过程是关键步骤[7]。目前主要抗HF的药物是以抑制HSCs活化、诱导活化的HSCs凋亡,从而促进基质降解为治疗靶向。中医药抗HF的研究备受关注,根据中药多层次、多途径、多靶点、多环节的作用特点,其分子机制的现代研究主要从抑制HSCs活化、诱导活化的HSCs凋亡、调节胶原代谢等几个方面着手[8]。有数据证实,槲皮素通过线粒体途径和内质网应激(endoplasmic reticulum stress,ERS)直接激活人类前列腺癌细胞中半胱氨酸天冬氨酸蛋白酶级联反应(cysteinyl aspartate specific proteinase, Caspase)诱导凋亡[9]。本实验研究马兰草绒灸脐通过线粒体细胞凋亡途径促使活化的HSCs凋亡,减少ECM沉积,使HF逆转。
线粒体细胞凋亡途径是以细胞色素C(cytochrome C,Cyt-C)的释放为起始信号,通过Bcl-2家族蛋白的内源性线粒体通路触发Csapase级联反应的不可逆凋亡为特点[9]。Cyt-C是呼吸链的电子载体,与细胞色素c氧化酶(cytochrome c oxidase,COX)共价结合定位于线粒体内膜,Cyt-C在呼吸链电子传递过程中作为COX的电子供体,促成COX还原氧分子为水,线粒体COX活性与线粒体功能成正相关[10-12]。本研究结果提示,马兰草灸脐可以抑制CCl4诱导的HF大鼠肝线粒体COX活性,减少ATP合成,促进活化的HSCs凋亡。另外,Bcl-2家族蛋白包括抗凋亡蛋白Bcl-2与促凋亡蛋白Bax[13-14],细胞存活与否二者表达量比例有关,Bcl-2通过稳定线粒体膜功能,阻止线粒体释放Caspase、Cyt-C以及凋亡因子等[15];Bax拮抗Bcl-2,两者表达呈反比,当Bax大量表达时与Bcl-2蛋白形成异源二聚体加速细胞凋亡[16]。有研究显示[17],双氢青蒿素可以增强促凋亡蛋白Bax的表达,同时削弱抗凋亡蛋白Bcl-2的表达,导致Bax/Bcl-2比值升高,进而触发线粒体凋亡通路。本研究显示,马兰草脐灸组的促凋亡Bax蛋白有显著上升,抗凋亡Bcl-2蛋白表达下降,提示马兰草脐灸组能更好地促进活化的HSCs凋亡,有效逆转大鼠HF;同时免疫荧光结果与WB结果趋势一致,马兰草脐灸可造成细胞形态改变、细胞融合、核碎裂等细胞凋亡趋势。
正常肝脏的HSCs位于窦周间隙,形态不规则,其立体分布与延伸的胞突足以覆盖整个肝窦微循环。α-SMA具有收缩性、原始炎症性和高增殖性特点,静止的HSCs合成胶原能力低,不表达α-SMA,而活化的HSCs则高表达α-SMA,因此,α-SMA表达已被用于识别肝组织是否含有MFB及HSCs是否处于活化状态[18]。在HF病程高级阶段,肝脏内ECM约为正常量的6倍,其中胶原是ECM的主要成分。有研究证实[19],在CCl4诱导的HF小鼠中,芬锐替尼可呈剂量依赖性地减少肝中胶原沉积,对HF有一定的逆转作用。本研究结果显示,模型组α-SMA阳性细胞表达显著,提示动物造模成功,马兰草脐灸组的Tunel-α-SMA阳性细胞表达显著增加,提示马兰草脐灸干预可有效促进活化的HSCs凋亡,显著逆转HF。另外,以胶原为代表的肝脏ECM代谢失衡、生成大于降解是其生化学基础[20]。Hyp是一种只存在于胶原中的氨基酸,是HF纤维胶原产生的主要来源,一定程度上反映纤维化肝组织中的胶原含量。活化的HSCs高表达Hyp。有研究显示,CCAAT/增强子结合蛋白(CCAAT enhancer binding protein-α, C/EBP-α),可降低CCl4诱导的HF小鼠的胶原蛋白和Hyp含量[21]。本研究结果显示,马兰草脐灸可以更好地抑制HF进程,有效阻止肝细胞的结缔组织形成。
HF根据其症状和体征属于中医学“黄疸”“胁痛”“积聚”“鼓胀”等范畴。据《临证指南医案》载:“病初始在气,久必入血”和《张氏医通·积聚》载:“正气不足,而后邪气踞之”,均认为正虚湿毒瘀阻是HF的主要病机。中医治疗HF遵循扶正祛邪的原则,常用攻、消、散、补四大法则来治疗[22]。中医脐灸疗法又称“神阙灸”,神阙穴联系全身经脉,通过经气的运行输布,内至脏腑经络,外达四肢百骸,五官九窍乃至皮毛。西医认为脐在胚胎发育过程中为腹壁最后闭合处,无真皮层,渗透吸收力最强,诸多药物均可通过脐快速进入体内而达全身[23]。前期研究中初步发现,马兰草脐灸能改善肝硬化腹水大鼠一般情况,引起腹水消退,并对肝线粒体具有一定影响。马兰草为菊科马兰的全草,其主要化学成分包括萜类、甾体、脂肪族、醌类、黄酮类等化合物,含有Cu、Se、Hg、Pb、Cd、As、Cr 等多种微量元素[24-25]。有研究显示[26-27],马兰草水煎液具有一定的预防和治疗胃溃疡的作用;另研究发现,乙酸乙酯部位(B)及水部位(D)可能为马兰抗实验性胃溃疡作用的主要药效部位。本研究结果显示,马兰草脐灸组大鼠肝脏表面呈深褐色较润泽,ALT、AST水平明显降低,同时可见脂肪细胞变性减少,提示马兰草脐灸可有效改善肝脏硬度,增加肝脏供血量,减缓肝细胞损伤程度。
综上所述,马兰草脐灸以线粒体细胞凋亡通路为靶向诱导活化的HSCs凋亡,可能是其治疗HF的机制之一。本文通过对其作用机制的研究,为马兰草脐灸治疗HF提供了新的理论依据,并且为民族中医药的开发及临床运用提供了实验依据。

