Ⅰ型及Ⅲ型食管闭锁的产前超声表现及病理分析*
段仰灿 孟艳红 王 聪 张忠路 任淑君
(济宁医学院附属医院,济宁 272029)
先天性食管闭锁(esophageal atresia,EA)是一种复杂而少见的先天性畸形,在活产儿中发生率为1/3000~1/4000[1]。EA患儿如不及时治疗,死亡风险极高。因此,对于EA患儿及时明确诊断、尽早手术治疗,是提高患儿生存率的重要措施[2]。Gross[3]按解剖结构将EA分为5型,其中I型和Ⅲ型占93%。本文拟分析I型和Ⅲ型EA胎儿的产前超声表现,以提高EA的产前超声诊断能力。同时我们进一步观察并分析EA患儿病变处的病理改变。
1 资料与方法
1.1 一般资料
回顾性分析2014年3月-2020年5月在我院超声科行产前常规超声检查并经尸检、手术或造影确诊的I型及Ⅲ型EA患儿30例,其中尸检证实23例,手术证实2例,引产后插管造影证实5例;Gross Ⅰ型EA 7例,Gross Ⅲ型EA 23例;伴发其他畸形16例(53.3%),包括单脐动脉、永存左上腔、先心病、食管囊肿、淋巴水囊瘤等多发畸形。孕妇年龄18~42岁,平均(33.78±3.22)岁,无遗传病史或近亲结婚史。孕龄16~40周,平均(26.66±3.57)周,首次发现异常的胎儿最小孕周为18周+6天,最大孕周为39周+2天。
1.2 方法
1.2.1仪器 使用GE Voluson E8、GE Voluson E10超声诊断仪,探头频率2.5~5.0MHz。德国徕卡生物切片机,奥林帕斯BX-51显微镜。
1.2.2产前超声检查 常规胎儿生物学检查后,对于羊水过多胎儿(羊水指数>25cm),利用超声详细检查其食管、气管、及胃泡情况。采取纵切和横切连续扫查食管、气管,评价食管软组织厚度及气管管径的变化,以食管厚度大于主动脉弓长轴切面上收缩期左锁骨下动脉起始处的直径作为食管软组织增厚的标准[4],气管、支气管管径异常参照文献报道[5],小胃泡依据胃泡长径、前后径、横径正常参考值[6]对胎儿胃泡测量结果进行判断:所测胃泡长径、前后径、横径低于正常值3个标准差者为“小胃泡”,无法探测到胃泡者为“胃泡不显示”,怀疑异常者于60~80min后复查。
1.2.3病理检查及HE染色 引产后死胎标本进行尸体解剖,切取闭锁食管的上、下盲端及瘘口周围组织,中性福尔马林固定24h,常规包埋,切片,厚度4μm,HE染色。
1.2.4EA分型 本文EA分型参照Gross 5型分类方法[3],Gross Ⅰ型为食道上下段均闭锁,两盲端距离较远,无气管食管瘘;Gross Ⅲ型为食道上段闭锁呈盲端,下段食道与气管有瘘管相通。
2 结果
2.1 EA患儿超声表现分析
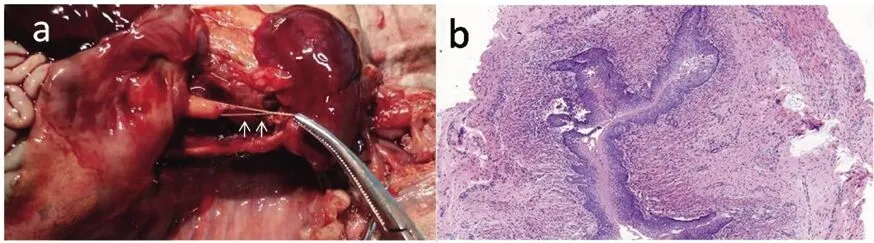
患儿上段食管软组织增厚30例(图1a);上段食管囊袋状扩张18例(Gross Ⅰ型4例,Gross Ⅲ型14例)(图2a);气管、支气管管径扩张7例(Gross Ⅲ型7例)(图2a);羊水过多合并无或小胃泡13例(Gross Ⅰ型6例,Gross Ⅲ型7例);15例胎儿可于产前评估闭锁段距离(Gross Ⅰ型1例,Gross Ⅲ型14例)(图2a)。
2.2 EA病理分析
Ⅰ型及Ⅲ型EA患儿上段食管末段膨大,Ⅰ型EA食管上、下段盲端间可见条索状组织相连(图3a),Ⅲ型EA食管下段可见与气管相连(图2b)。闭锁上段食管盲端组织病理改变为管腔扩张,黏膜层、黏膜下层肌层及外膜层四层结构层次清晰,结构基本正常,肌层细胞轻度增生肥大(图1b)。Ⅰ型食管闭锁下段食管管壁结构不全,层次不清,管壁厚薄不均(图3b)。扩张的气管与上方气管均保留气管的三层结构(黏膜层、黏膜下层和外膜),但扩张的气管管腔扩张,管壁变薄,黏膜层及黏膜下层萎缩显著,层次分界不清,外膜结构尚清晰,但软骨及肌肉成分减少(图4a)。Ⅲ型食管闭锁下段食管外膜层组织内可见局灶性软骨成分(图4b)。
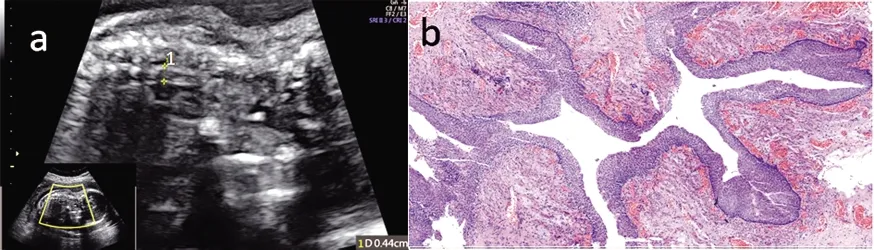
注:a.“+”间为测量的闭锁上段食管软组织厚度;b.病理图片(HE×20)。

注:a.“+1”间为测量的闭锁段长度,“+2”间为测量的扩张的气管,“+3”间为测量的上段未扩张的气管;b.该例尸解图片。T:气管,POUCH/白色箭头:食管上段囊袋;AOA:胸主动脉;STO:胃。
注:a.及该例食管闭锁下段食管病理图片;b.(HE×20)。白色箭头:食管上、下段盲端间条索状组织。
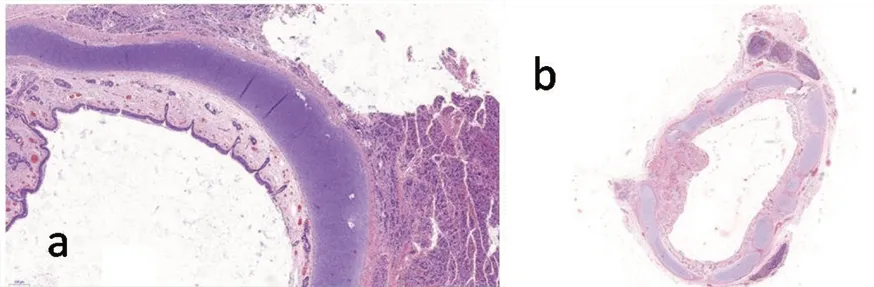
注:a、b.Ⅲ型食管闭锁下段食管病理图片。
3 讨论
EA最常应用的分型方法为Gross法,Gross[3]根据闭锁情况和是否伴有气管食管瘘将EA分为5型:其中Gross Ⅰ型约占7%;Gross Ⅱ型约占2%;Gross Ⅲ型约占86%,此型依据食管上、下两端间的距离又可分为2种亚型,距离≥2cm称为Ⅲa型,产后常常无法经一期近远端食管吻合,距离<2cm称为Ⅲb型,产后手术较容易;Gross Ⅳ约占1%;Gross Ⅴ型约占4%。其中Ⅰ型和Ⅲ型占绝大多数,约93%。约30%的EA可伴其他先天性异常,3%~4%可伴发染色体异常,以18-三体居多[7]。未经治疗的患儿出生后死亡风险极高,因此加强产前对孕产妇的检查非常重要,明确诊断后即应尽早施行手术,可以提高先天性EA的手术成活率[8]。
以往文献报道[9-10],产前诊断EA,主要依靠近端食管囊状扩张—口袋征以及胃泡小或不显示合并羊水过多,尤其是近端食管的囊袋状扩张被认为是产前超声诊断EA的特征性直接征象。尽管Ⅰ型及Ⅲb型食管闭锁胎儿出现羊水过多[11],但同时出现羊水过多和小或无胃泡的EA胎儿仅不足50%[12],而近端食管的囊袋状结构由于出现的不规律性,以及受胎位、胎动、周边组织器官及孕妇腹壁厚等因素的干扰,超声检出率仅为32%[12-13],因此依靠近端食管囊状扩张以及胃泡小或不显示合并羊水过多诊断胎儿EA的实际应用受到限制。我们以往研究[5]发现EA上方食管软组织增厚,这一征象易检出,且不受胎儿吞咽时相的影响,本文30例产后确诊的Ⅰ型及Ⅲ型EA胎儿均可探及闭锁上方食管软组织增厚,其检出率最高,因此我们认为闭锁上方食管软组织增厚可作为筛查Ⅰ型及Ⅲ型EA的首要超声征象。我们推测闭锁上方食管受吞咽高压羊水的反复刺激,管壁出现代偿性肥厚,因此表现为食管软组织增厚。为了验证这一观点,本文对闭锁上方的食管软组织进行病理分析,发现闭锁上段食管盲端组织病理改变为管腔扩张,肌层细胞轻度增生肥大。肌层细胞的增生肥大很好地解释闭锁上段食管软组织增厚的超声表现。
Ⅰ型及Ⅲa型EA又被称为长段缺失型EA(Long gap esophageal atresia,LGEA)[14],缺失长度多在2cm以上,大部分学者认为这种EA术中无法行一期近远端食管吻合[15]。产前如果能评估闭锁段长度,将会对患儿生后及早确定手术方式提供帮助。本文我们通过在食管的标准纵切面及横切面观察食管,发现15例患儿的闭锁段长度可估测,且与产后结果相吻合,提示产前评估闭锁段长度的可行性。但本研究中,只有50%的病例可估测,但随着对这一指标的研究和经验积累,相信可测量的比例还会升高。
随着对EA认识的提高,气管软化的诊断率也越来越高。气管软化的早期诊断非常重要,一旦气管过度塌陷或阻塞导致无效通气及分泌物无法排出,这可导致反复呼吸道感染及肺炎,甚至危及生命[16]。随着对EA认识的深入,我们也逐渐关注胎儿气管的变化,本研究发现7例合并食管气管瘘患儿的气管及主支气管增宽,虽然这一指标在本组病例中检出率不高,但也提示这一指标可作为诊断Ⅰ型及Ⅲ型EA的辅助指标。我们的病理结果表明扩张的气管管腔扩张,管壁变薄,黏膜层及黏膜下层萎缩显著,层次分界不清,软骨及肌肉成分减少,这也合理解释了患儿产后出现气管软化的原因,表明胎儿期气管扩张是提示患儿产后气管软化的重要指征,为产后EA患儿气管软化的早期诊断提供了依据,更好的帮助临床评估预后。
本研究中,我们对下段食管组织病理分析示,Ⅲ型EA下段食管外膜层组织内可见局灶性软骨成分,软骨成分可影响下段食管组织收缩,进而可以解释我们之前研究发现的闭锁段下方食管充盈机会增多的现象[4]。Ⅰ型EA下段食管管壁结构不全,层次不清,管壁厚薄不均,我们认为一方面长期缺乏内容物的刺激会影响食管的发育,另一方面局部组织分化异常同样也会导致下段食管发育异常。
为了快速而有效地提高该疾病的产前诊断率,当遇到羊水过多或合并小或无胃泡的胎儿时,可以重点筛查胎儿的食管及气管,当看到食管局部软组织增厚或囊袋征时,可高度怀疑食管闭锁,继而观察气管有无增粗以及下段食管与气管间是否存在瘘口,进而再对食管闭锁段进行测量,从而对产后手术治疗提供更多帮助。另外对于疑诊EA的胎儿,我们还要详细检查胎儿的其他结构,为孕产妇的优生提供更多依据。
综上所述,Ⅰ型和Ⅲ型EA胎儿有典型的超声表现,闭锁上方食管软组织增厚可作为筛查、Ⅰ型及Ⅲ型EA的首要超声征象,其他的超声表现还包括上段食管囊袋状扩张、气管、支气管管径扩张及羊水过多合并无或小胃泡。
利益冲突:所有作者均申明不存在利益冲突。

