Ghrelin对6-OHDA诱导SH-SY5Y细胞线粒体损伤和细胞凋亡的影响*
高文明 李嘉铮 王慧青 董 康 孟 尧 程葆华△
(1济宁医学院基础医学院;2济宁医学院临床医学院,济宁 272000;3山东大学齐鲁医学院,济南,250014)
帕金森病(Parkinson’s disease,PD)是最常见的神经退行性运动障碍性疾病,以运动和非运动症状为主要临床表现[1]。以中脑黑质致密部(substantia nigra pars compacta,SNpc)多巴胺能神经元进行性丢失,残存的多巴胺神经元内出现路易小体为主要病理学特征[2]。PD发病的确切机制尚不十分清楚,现有的证据表明线粒体功能损伤与PD 的病理生理学有关[3]。凋亡是最常见的程序性细胞死亡形式,与线粒体功能密切相关,原因是内在的凋亡途径与线粒体去极化有关[4]。6-OHDA是儿茶酚胺的羟基化衍生物,其结构与儿茶酚胺类似,是一种有效导致多巴胺神经元变性的神经毒剂,广泛用于选择性儿茶酚胺能神经毒剂作用的细胞或者动物PD模型[5]。
Ghrelin又名胃饥饿素,是生长激素促分泌素受体(growth hormone secretagogue receptor,GHS-R)的唯一内源性配体[6]。Ghrelin可促进生长激素释放,参与多种内分泌调节过程,具有抗凋亡、抗氧化作用,可以拮抗1-甲基-4-苯基-1,2,3,6-四氢吡喃(1-methyl-4-phenyl-1,2,3,6-tetrahydropyran,MPTP)所致的神经毒性,发挥神经保护作用[7-9]。Ghrelin对于6-OHDA所致的线粒体损伤和细胞凋亡的作用还有待研究。本实验通过6-OHDA处理人神经母细胞癌细胞(SH-SY5Y细胞),构建PD体外模型,观察Ghrelin对线粒体功能和细胞凋亡的影响,探究其神经保护作用。
1 材料与方法
1.1 材料
1.1.1试剂 Ghrelin(美国Phoenix Pharmaceuticals公司);SH-SY5Y细胞(美国菌种保藏中心);6-OHDA(美国Sigma公司);DMEM培养液(美国Hyclone公司);CCK-8(日本Dojindo公司);LDH(中国南京建成生物有限公司);线粒体膜电位检测试剂盒(JC-1)(中国江苏凯基有限公司);RIPA裂解液(中国碧云天生物技术有限公司);BCA蛋白浓度测定试剂盒(中国天根生物有限公司);超敏ECL化学发光试剂盒、Bcl-2抗体(中国万类生物科技有限公司);Bax抗体(美国Cell Signaling Technology公司);β-actin抗体(北京中山金桥有限公司)。
1.1.2仪器 CO2培养箱(美国Thermo公司);超声波细胞粉碎仪(江苏波场智能科技股份有限公司);微量移液器(德国 Eppendorf公司);台式低温高速离心机(美国Beckman公司);酶标仪、电泳仪、转膜仪(美国Bio-Rad公司);普通光学显微镜、倒置生物显微镜(日本Olympus公司);激光共聚焦扫描显微镜(SP8)(德国 Leica公司)。
1.2 方法
1.2.1细胞培养 SH-SY5Y细胞培养在含有10%胎牛血清、100U/mL 青霉素和100U/mL链霉素的DMEM培养基中,放置于37℃含有5% CO2的细胞培养箱中培养,待生长到约90%时进行相应传代或接种到96、6孔板中,行后续药物处理。
1.2.2药物处理及分组 取对数生长期SH-SY5Y细胞,接种于96或6孔板中,随机分成4组:对照组、Ghrelin组、6-OHDA组、6-OHDA+Ghrelin组,置于37℃含有5% CO2的细胞培养箱中培养,待细胞长到合适密度,Ghrelin组、6-OHDA+Ghrelin组先给予Ghrelin(1μM)预处理,其他两组给予相同剂量的磷酸盐缓冲液(PBS),6-OHDA组、6-OHDA+Ghrelin组2h后给予6-OHDA(400μM)处理,其他两组给予相同剂量的磷酸盐缓冲液(PBS),放入培养箱培养24h,后行后续实验操作。
1.2.3细胞活力测定 将对数生长期细胞接种于96孔板内,置于细胞培养箱中,待细胞生长到合适密度,按上述方法进行药物处理。在细胞培养箱继续培养22h后,每孔加入10μl CCK-8溶液,用锡箔纸包好避光条件下,细胞培养箱孵育2h,孵育结束后用酶标仪450nm处测定吸光度(A)。每组设6个复孔,实验平行重复3次,计算细胞活力。
1.2.4LDH释放量检测[10]取对数生长期细胞接种于96孔板内,置于细胞培养箱中,待细胞生长到合适密度,按上述方法进行药物处理。培养24h后,收集上清液并转移到新的96孔板中,按照LDH检测试剂盒步骤进行操作,反应结束后用酶标仪450nm处测定吸光度(A)。每组设6个复孔,并且设置只加入培养基的空白孔作为空白对照,实验平行重复3次,LDH释放率=给药组LDH活力/空白组LDH活力。
1.2.5线粒体膜电位(ΔΨm)检测[11]JC-1染色法来检测ΔΨm在各处理组中的变化。取对数生长期细胞接种于含有黏附载玻片的12孔板中,待细胞生长到合适密度后进行相应药物处理。24h后,吸去培养基,用PBS洗1次,然后加入JC-1(1x)染色液,避光条件下孵育20min,孵育完成后吸去染色液,用洗涤液洗涤2次,最后放在SP8荧光显微镜下观察拍照,实验平行重复3次,用Image J分析荧光强度。
1.2.6Bcl-2、Bax蛋白表达检测[12]取对数生长期细胞接种于6孔板内,置于细胞培养箱中,待细胞生长到合适密度,按上述方法进行药物处理。培养24h后收集细胞,加入强裂解液和蛋白酶抑制剂,冰上裂解30min,在12000rpm的4℃离心机离心30min,收集上清即为细胞总蛋白。取10μl用BCA法测定蛋白浓度,剩余蛋白按照3∶1加入相应的4×SDS后,在金属水浴锅煮蛋白10min,室温冷却。随后进行SDS-PAGE凝胶电泳,随后转移到PVDF膜上,脱脂奶粉封闭,孵育一抗稀释液,4℃过夜。次日TBST溶液洗膜,二抗稀释液室温孵育1h。再次洗膜3次,加入ECL溶液,暗室内曝光显影。实验平行重复3次,用Image J分析条带灰度值。
1.3 统计学方法

2 结果
2.1 Ghrelin对6-OHDA处理的SH-SY5Y细胞活力的影响
为了初步探究Ghrelin对6-OHDA诱导PD体外模型的作用,运用CCK-8检测各组细胞经处理后的细胞活力变化。首先,为了验证单独给予Ghrelin是否会对细胞活力产生影响,分别给予0.01、0.1、1、10μM Ghrelin处理细胞,结果显示,不同浓度的Ghrelin对细胞活力没有影响,无毒副作用(图1A)。随后我们研究6-OHDA单独对细胞的毒性作用,结果显示,6-OHDA以剂量依赖性的方式降低了细胞活力(图1B),我们采用400μM的6-OHDA用于后续实验。最后我们检测Ghrelin预处理对6-OHDA处理的细胞的影响,如图1C显示,0.1、1、10μM Ghrelin改善了6-OHDA介导的细胞活力的下降,我们选择1μM Ghrelin用于后续实验。以上结果表明,Ghrelin对6-OHDA诱导损伤的SH-SY5Y细胞存活存在一定的保护作用。
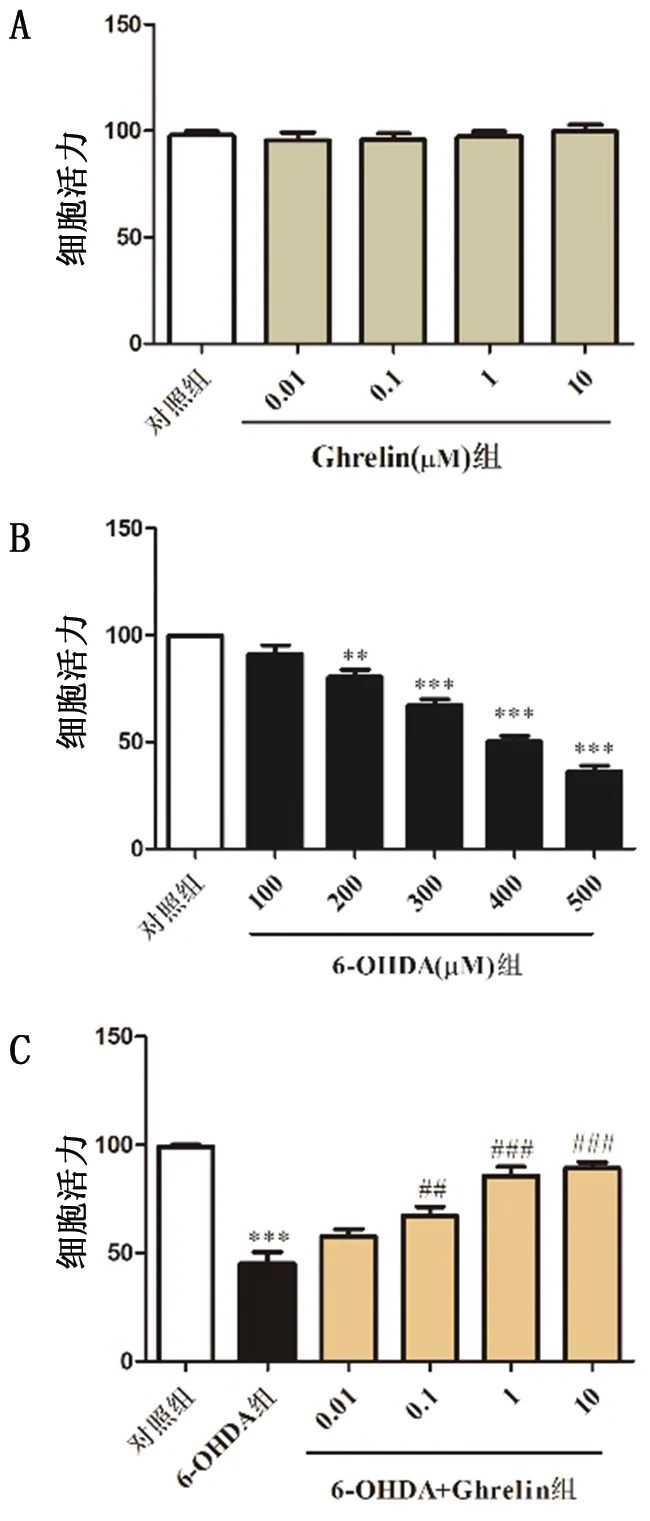
注:Ghrelin或等剂量PBS提前2h处理细胞,在有或没有6-OHDA的情况下培养24h,CCK-8实验检测细胞活力。(A)单独给予Ghrelin对细胞活力的影响;(B)单独给予6-OHDA对细胞活力的影响;(C)Ghrelin对6-OHDA刺激的细胞活力的影响。**P<0.01,***P<0.001 vs 对照组;##P<0.01,###P<0.001 vs 6-OHDA 组
2.2 Ghrelin对6-OHDA诱导损伤的SH-SY5Y细胞LDH释放率的影响
与对照组相比,6-OHDA导致LDH的大量释放,表明发生细胞死亡;而给予Ghrelin预处理后,与6-OHDA组相比,6-OHDA+Ghrelin组LDH的释放率明显降低,说明Ghrelin降低了6-OHDA所致的细胞毒性作用。见图2。
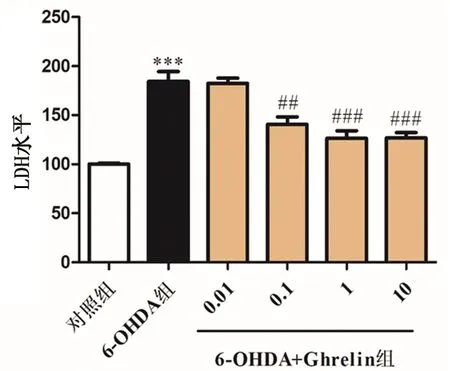
注:(A)按照上述方法处理细胞,LDH试剂盒检测各组LDH释放量的变化,进一步反映细胞毒性作用。***P<0.001 vs对照组;##P<0.01,###P<0.001 vs 6-OHDA 组
2.3 Ghrelin对6-OHDA处理的SH-SY5Y细胞ΔΨm的影响
与对照组相比,给与6-OHDA处理后,细胞红色荧光强度显著下降,表明ΔΨm下降;而给予Ghrelin预处理后,6-OHDA+Ghrelin组细胞红色荧光强度明显增加,ΔΨm显著上升。表明Ghrelin预处理能部分恢复6-OHDA所致的ΔΨm的下降,具有线粒体保护功能。见图3。
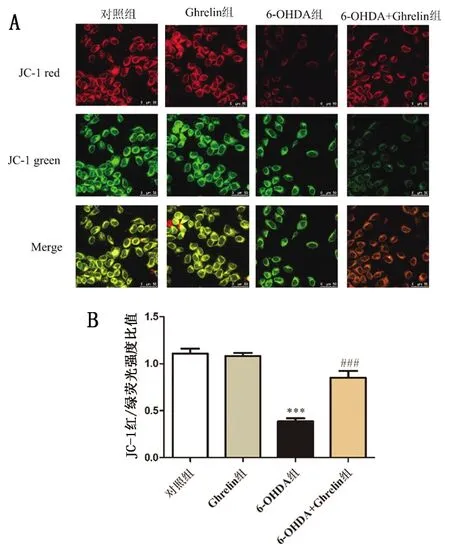
注:(A-B)按照上述方法处理细胞,JC-1实验红、绿荧光强度比值反映ΔΨm的变化。Scale bar = 50 μm。***P<0.001 vs 对照组;###P<0.001 vs 6-OHDA 组
2.4 Ghrelin对6-OHDA诱导损伤的SH-SY5Y细胞Bcl-2和Bax表达的影响
与对照组相比,6-OHDA组Bcl-2/Bax比值降低;而给与Ghrelin预处理后,与模型组相比,6-OHDA+Ghrelin组Bcl-2/Bax的比值明显升高,表明Ghrelin降低了6-OHDA所致的细胞凋亡反应。见图4。
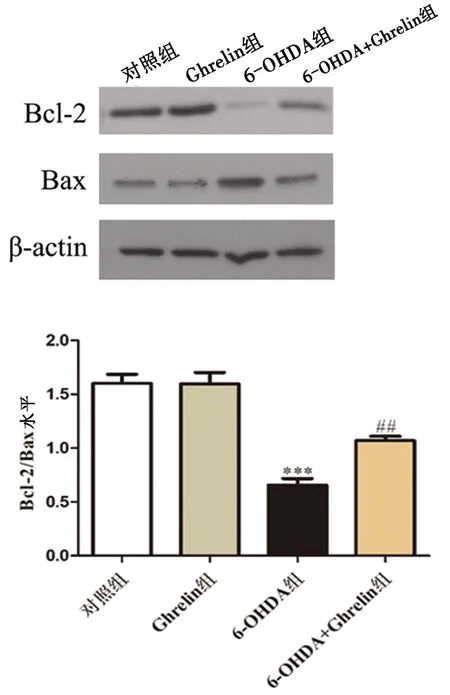
注:(A-B)按照上述实验方法处理细胞,提取细胞总蛋白,运用Western blotting方法检测Bcl-2和Bax的表达,Bcl-2/Bax的比值反映细胞内凋亡水平。***P<0.001 vs 对照组;##P<0.01 vs 6-OHDA 组
3 讨论
PD是一种与年龄有关的中枢神经退行性疾病,威胁人类健康,据统计我国PD患者接近300万,预计2030年全世界将有900万PD患者[13]。PD神经元变性的确切机制尚不十分明确,目前PD 的治疗主要以左旋多巴替代疗法为主,其可以缓解症状,但存在一定的不良反应,且无法阻止疾病的发展,而诸如干细胞治疗,神经核毁损术和脑深部电刺激术等替代策略均有严格的适应证[14],药物治疗仍然是治疗PD的基石,因此开发一种能快速通过血脑屏障(blood-brain barrier,BBB)的靶向药物对于PD的治疗是十分有益的。
Ghrelin作为一个含28个氨基酸的脑肠肽,可以通过BBB在神经系统疾病发挥保护作用。以往有研究报道,Ghrelin通过与受体结合,发挥抗凋亡、抑制胶质细胞激活,在神经退行性疾病的体内外模型中发挥神经保护作用[8,15-16]。本课题组前期研究结果已经证明Ghrelin可以通过促进自噬、抑制内质网应激、激活ERK1/2等信号转导途径对PD的体内外模型发挥神经保护作用[9,17-18]。然而,Ghrelin对6-OHDA诱导的细胞毒性作用及机制仍需要进一步研究。
PD发病机制复杂,既往研究表明,线粒体功能障碍会加重神经元的退变[3]。本文结果显示,Ghrelin预处理增加了细胞活力,降低了细胞毒性作用。6-OHDA可以抑制线粒体复合体Ⅰ,抑制ATP产生,阻断细胞内ATP参与的过程,产生大量自由基,从而导致线粒体功能异常,进一步引起细胞死亡[19]。Ghrelin 显著提高了ΔΨm水平,增加了Bcl-2/Bax的比值,表明Ghrelin降低了6-OHDA所致的线粒体功能损伤和细胞凋亡,有利于线粒体稳态的维持。综上所述,Ghrelin减轻了6-OHDA所致的SH-SY5Y细胞损伤。我们所有的工作旨在进一步探索Ghrelin的潜在分子机制,同时为Ghrelin成为治疗PD的临床药物提供了新的证据。
利益冲突:所有作者均申明不存在利益冲突。

