浓缩生长因子(CGF)对人根尖牙乳头干细胞生物学特性的影响*
王景莉 冯保静
年轻恒牙及未完全发育牙齿因龋病或牙外伤导致牙髓坏死或根尖周炎,其治疗措施包括传统的根尖屏障术、根尖诱导成形术以及近年来实施的牙髓血运重建,其生物学基础是根尖区组织含有大量前体细胞。Sonoyama 等[1]首先将这部分处于未分化状态的前体细胞分离培养,并命名为根尖牙乳头干细胞(stem cells from apical papilla,SCAPs),进一步研究发现其具有高增殖率、较强的自我更新能力和多向分化潜能。研究显示SCAPs长期高表达抗凋亡蛋白及端粒逆转录酶,且来源于同一牙齿的SCAPs 较其他牙源性干细胞具有更强的增殖、分化能力[1-3]。另外,SCAPs具备更强的抗感染能力,当牙髓组织感染将导致牙髓干细胞失去活力,SCAPs 仍可继续保持其活性,这是由于其所处的生长环境血运侧支循环较髓腔内的牙髓干细胞更为丰富[4]。SCAPs 作为组织工程中极具潜力的种子细胞,其出现为牙齿修复再生及组织重建再生提供了新的思路。
CGF 是近年来发现的一种新型血液来源的生物支架材料,由静脉取血后通过差速离心制作而成[5]。CGF 作为继富血小板纤维蛋白(platelet-rich fibrin,PRF)、富血小板血浆(platelet-rich plasma,PRP)后的新一代血小板浓缩物,其不仅是新一代生物支架材料,富含多种高浓缩的纤维蛋白(fibrous protein)及生长因子(growth factor),包括血小板衍生生长因子(platelet derived growth factor,PDGF)、转移生长因子-β(Transferring growth factor-β,TGF-β)、类胰岛素生长因子(insulin-like growth factor,IGF)以及成纤维细胞生长因子(fibroblast growth factors,FGF)等[6]。研究报道CGF 既有利于骨髓间充质干细胞的分化,又能促进牙龈细胞增殖、粘附及胶原纤维的合成,加快软组织愈合[7-8]。另外,CGF 的制备不需要特殊的添加剂,其纤维蛋白的三维网状结构与天然纤维蛋白网络更加相似,制备后捕获的多种生长因子可在后期节律性缓慢释放[6,9],使得CGF 在牙髓损伤修复及及组织工程再生领域具有广阔临床应用前景。
目前研究发现自体CGF 可显著促进SCAPs增殖、迁移及成骨向分化,但患有贫血等血液疾病者其自体CGF 的使用受到了限制,那么异体CGF 是否能够发挥同样的作用尚不明确,为阐明人异体CGF 对SCAPs 影响的差异,本实验通过制取异体CGF,检测其对SCAPs 生物学特性的影响,为异体CGF的临床应用提供实验依据。
1.材料与方法
1.1 主要试剂与仪器 磷酸盐缓冲液(PBS)、胰酶细胞消化液、α-MEM 培养基(Hyclone,美国);CCK-8(DOJINDO,日本);ALP试剂盒(碧云天,中国);紫外线分光光度仪(Eppendorf,德国);细胞培养板(Costar,美国);实时定量PCR仪(ABI,美国);细胞培养箱(Heraeus,德国);逆转录试剂盒(Takara,日本);倒置相差显微镜(Olympus,日本);胎牛血清(FBS);(Hyclone,美国);酶联免疫检测仪(BIO-TEK,美国);细胞培养板(Costar,美国);CD29、CD90、CD105、CD34、CD45(BIOLEGEND,美国);牛血清白蛋白(BSA)(Biosharp,中国)。
1.2 hSCAPs 的分离、培养及鉴定 口腔颌面外科收集12名15-22岁志愿者正畸拔除前磨牙及第三磨牙,要求牙齿完整无龋坏且根尖未发育完全,其中6名志愿者同期抽取静脉血,进行自体CGF 膜片制备。拔除牙齿立即放入冰浴PBS 中,超净台内反复冲洗牙齿表面并去除牙龈、牙周膜软组织,使用手术刀片分离出根尖牙乳头组织放入1.5mL EP 管,使用眼科剪将根尖牙乳头组织块剪碎至1mm3大小,加入Ⅰ型胶原酶(3mg/mL),轻柔混匀后放入37℃细胞培养箱中消化45min,10min使用移液枪混匀一次,终止消化、离心去上清,细胞重悬并接种于培养瓶中,待细胞融合率达80%左右时,扩大培养用于后续实验。
流式细胞术鉴定:取第3代hSCAP接种于培养瓶,当hSCAP融合率达80%左右,消化细胞为单细胞悬液后离心,0.5%牛血清白蛋白(BSA)重悬细胞,在流式细胞仪样品管中分别加入1mL细胞悬液(1×106个/mL),常温下孵育细胞悬液与目标抗体(CD29、CD90、CD105、CD34、CD45、IgG)1h,1000r/min离心后去上清,PBS洗脱未结合抗体,上机检测表面标记物。
hSCAPs 成骨向诱导及成脂向诱导培养:当根尖牙乳头干细胞生长融合率达80%左右时,将完全培养基更换为成骨诱导培养基或成脂诱导培养基[9],定期更换诱导培养基,诱导培养4周后使用4%多聚甲醛固定细胞15min,使用三蒸水洗脱残留多聚甲醛,参照茜素红及油红O染色说明书进行染色,显微镜下观察并记录脂滴及钙化结节形成情况。
1.3 CGF膜片的制备 经安阳市第六人民医院伦理委员会审批同意,在口腔颌面外科招募12名15-22岁男性志愿者,要求身体健康,无系统性疾病,使用真空采血试管采取其中6名志愿者前臂静脉血,其余6名志愿者拔除前磨牙或第三磨牙,进行根尖牙乳头干细胞培养。采血管放入离心机,不间断差速离心13min,即可得到CGF 纤维蛋白层,此时可见真空管内血液分为三层,中间层即为CGF凝胶。采血管内取出CGF凝胶,制备CGF膜,裁剪备用。hSCAPs 患者之外志愿者来源的CGF 为异体CGF(homogenous CGF,H-CGF)。
1.4 CCK8检测细胞增殖 将异体CGF膜裁剪至标准膜的1/2 及1/4 大小,并置于96 孔板中,取20μl 浓度为5×105/ml 的细胞悬液接种于96 孔板不同体积的异体CGF 上,培养箱中静置2h,待细胞附着后,补加培养基至l00μl,继续培养7d 后,更换为CCK-8 工作液孵育2h,酶联免疫检测仪测定各组在1、3、5、7d时450nm处吸光度(OD)值。
1.5 ALP 活性检测 将异体CGF 置于6 孔板中,状态良好的细胞消化离心,并使用不同的培养基重悬,空白对照组(Con)使用单纯α-MEM 重悬细胞,成骨诱导组(Osteogenic differentiation Medium,OM)及CGF 组均使用成骨诱导培养基重悬细胞,接种于6 孔板及异体CGF 上培养24h,然后更换为成骨诱导液继续培养7d、14d,对照组(Con)更换为不含CGF 膜的成骨诱导液,根据说明书测定各组ALP活性。
1.6 实时定量聚合酶链反应检测成骨/成牙基因表达 成骨诱导培养液条件下培养7d,提取细胞总RNA 并逆转录成cDNA,以cDNA 为模板,采用Real Time-PCR 检测各组ALP、DSPP、BSP、OCN 成骨/成牙相关基因的表达,以β-actin 为内参基因。Real Time-PCR 反应条件及反应体系参照说明书操作,引物序列见表1。

表1 成骨相关基因引物序列
1.7 Transwell 检测细胞迁移采用无血清a-MEM 和完全培养基重悬细胞,不含血清的a-MEM 为空白对照组(Con),含10%FBS 的a-MEM 为阳性对照组(positive group,PG),含10%FBS 的a-MEM 加CGF 膜片为H-CGF 组,在24 孔板Transwell 小室的下层加入600μL 培养液及异体CGF 膜,取150μL(5×104/ml)细胞悬液接种于小室,培养24h 后,多聚甲醛固定小室上迁移的细胞,用小棉签擦去小室上层为迁移细胞,1g/L结晶紫染色液20min,清洗后显微镜下观察并记录细胞迁移数量。
1.8 统计学分析 采用SPSS 13.0 软件对数据作单因素方差分析,组间比较采用t 检验或方差分析,实验均各重复3次,数据为均数±标准差,P<0.05具有统计学意义。
2.结果
2.1 hSCAPs 的培养及鉴定hSCAPs 成骨、成脂向诱导4 周后,茜素红染色可见成骨诱导组细胞可形成大量钙化结节(图1),而油红O 染色可见成脂诱导组细胞内有红色脂滴形成(图2),说明hSCAPs具有多向分化潜能。流式结果显示干细胞表面标记分子CD105、CD90、CD29呈阳性表达,而血细胞标记分子CD34、CD45 则呈阴性表达,符合间充质干细胞的表面分子表达特性(图3)。



2.2 CGF对hSCAPs增殖能力的影响
CCK-8 检测结果显示,异体CGF 组(H-CGF)和对照组在培养hSCAPs 1、3、5、7d 时,不同浓度的H-CGF 均明显高于其对照组的OD值,表明CGF 可提高hSCAPs 的增殖率(P<0.05);但不同膜片大小的H-CGF 组间无显著性统计学差异(P>0.05),提示促进hSCAPs 增殖能力的CGF不具有浓度依赖性(图4)。
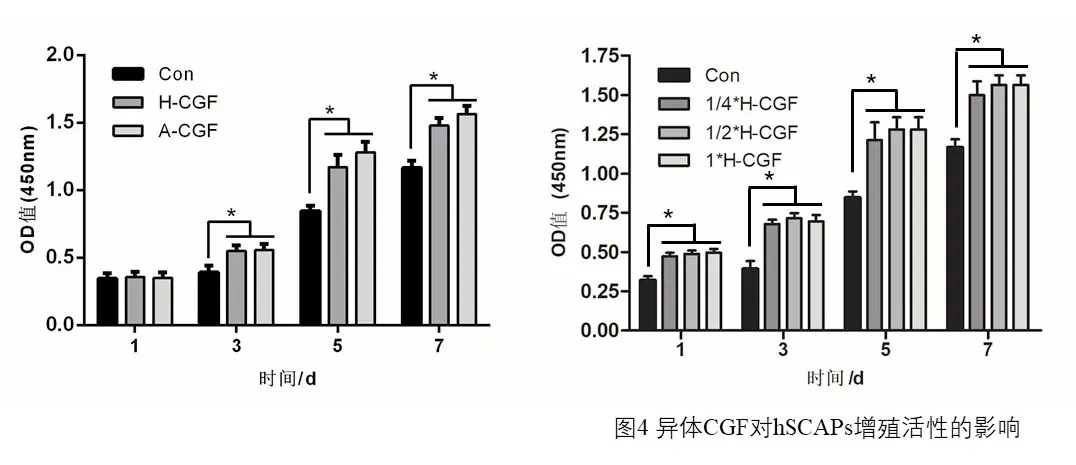
2.3 CGF 对hSCAPs成骨/成牙能力的影响
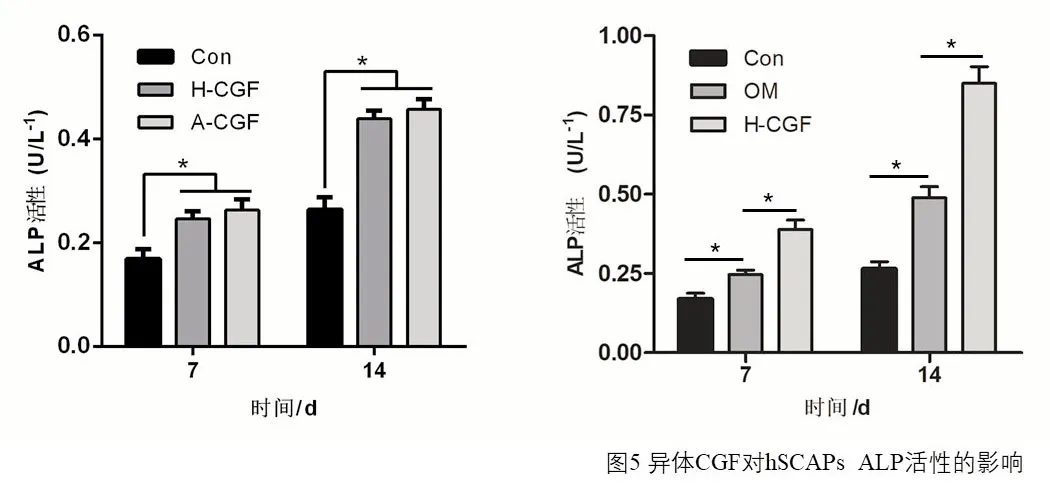
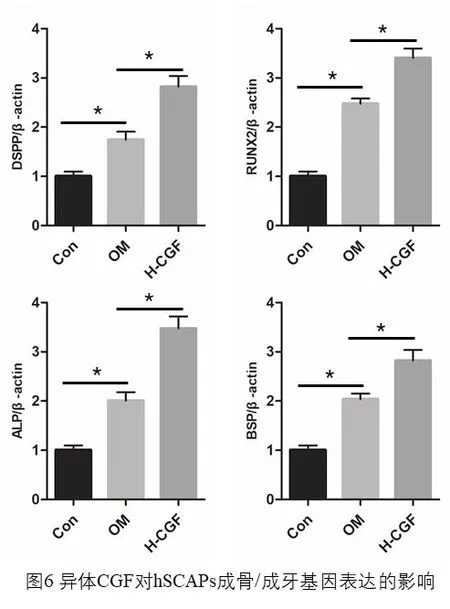
成骨诱导组(OM)的ALP 活性在hSCAPs 成骨诱导培养7d、14d 时均明显高于空白对照组(P<0.05),且H-CGF 组的ALP 活性显著高于OM 组(P<0.05),(图5)。qPCR 检测结果显示H-CGF 组中成骨基因ALP、DSPP、BSP、OCN mRNA 的表达均明显高于OM 组,差异有统计学意义(P<0.05),(图6)。
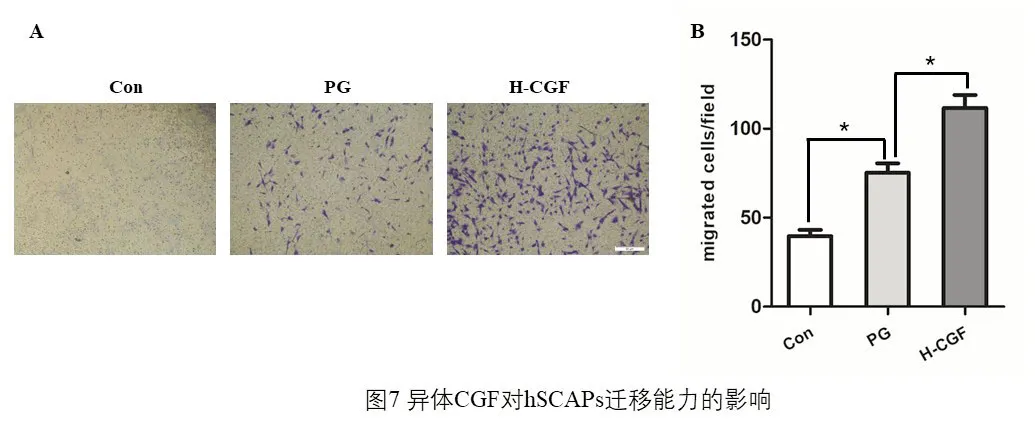
2.4 CGF 对hSCAPs迁移能力的影响
Transwell 结果发现,阳性对照组(PG)迁移至下室的细胞数目明显高于空白对照组(Con)(P<0.05),且H-CGF 组迁移至下室的细胞数目均明显高于阳性对照组(PG)(P<0.05),(图7)。
3.讨论
SCAPs 位于牙根未发育完全的年轻恒牙及乳牙中,其具有高度增殖能力和成骨/成牙分化能力,在牙根发育过程中发挥着重要作用[10]。研究发现将SCAPs复合培养于羟基磷灰石(HA-TCP)支架材料后植入裸鼠皮下,4-8 周后可形成类牙齿样结构[11],提示SCAPs 在牙齿修复再生及组织重建中起着重要作用。
由于CGF 具备更加接近天然结构的纤维网状支架,并能更好的富集高浓度生长因子,使得CGF迅速成为研究热点[12]。此外,CGF 纤维支架中各组生长因子的释放更接近组织愈合的自然过程,在软、硬组织愈合过程中的发挥的作用更强[9]。研究发现,CGF 刺激间充质干细胞后,可通过TGF-β/BMP、Wnt/β-catenin 等通路上调干细胞内成骨基因的表达,进而调控细胞成骨向分化,促进骨组织再生[13]。Hong 等[14]发现,CGF 内的细胞因子可趋化牙髓干细胞聚集,促进细胞增殖和分化,在根尖周炎中炎症性牙髓的再生中发挥重要作用。Ding 等临床研究表明CGF 在牙髓再生治疗中可发挥缓慢释放细胞生长因子和作为细胞生长支架的双重作用,不仅能替代牙髓血运重建传统治疗中的血凝块,还可提高牙髓再生治疗的成功率[15]。体外研究显示自体CGF 可促进PDLSC 的增殖、成骨向分化能力[16],而hSCAP 在牙根的形成和发育中发挥关键作用,尤其是根尖诱导成形术中牙根继续发育的重要细胞来源,明确CGF 对SCAP 生物学特性的影响对CGF 在牙组织工程中的应用具有重要意义。
本研究选取异体CGF对hSCAPs进行培养,检测hSCAPs 的增殖、迁移及成骨/成牙分化等生物学特性。CCK8 实验结果显示,异体CGF 在第1、3、5、7d均可明显促进hSCAPs的增殖。此外,本研究发现异体CGF 对SCAPs 成骨/成牙向分化具有显著促进作用。细胞迁移实验则显示异体CGF 对hSCAPs 迁移能力具有明显促进作用。研究表明,制备CGF 过程中,真空离心管的不同规格可使最终获得的CGF 纤维支架具有一定的差异[17],并且不同志愿者的身体状况、年龄、性别及生活习惯等差异较大,则制备出的CGF 在浓度和活性方面也会产生较大差异[18];因此,本实验制备CGF 时选用18-20岁健康男性志愿者,并采用同一批次静脉血采集管,以减少年龄、性别差异引起的实验误差。
综上,CGF 作为继PRP 和PRF 后的最新一代血小板纤维蛋白浓缩物,其类似天然的支架结构可为细胞提供生长及增殖的空间,且富含多种细胞生长因子并具有可吸收性生物膜的特性,在牙髓-牙本质再生中可发挥重要作用。本研究显示异体CGF 可明显促进SCAPs 增殖、迁移能力,增加碱性磷酸酶活性、提高成骨/成牙相关基因的表达水平,促进成骨/成牙向分化,为异体CGF 在口腔组织工程的临床应用提供理论基础。

