阿片相关雄激素缺乏症的外周机制及胰岛素样生长因子1的治疗作用
黄坚坚,陈星驰,崔燕华,周江平,南海函,郝欣蕊,林 函
〔1.温州医科大学附属第二医院、育英儿童医院麻醉与围术期医学科,浙江 温州 325000;2.温州医科大学检验医学院(生命科学学院),浙江 温州 325035〕
阿片类药物作为世界卫生组织癌痛三阶梯镇痛方案中不可或缺的一部分,主要用于第二和第三阶梯的治疗[1]。近10年来,阿片类药物也广泛应用于慢性非癌性疼痛的治疗。然而,随着其临床应用的持续增加,相关不良反应的发生率如阿片相关雄激素缺乏症(opioid-induced androgen deficiency,OPIAD)也持续增加,主要表现为睾酮水平低下、性欲降低、男性勃起功能障碍、疲劳、情绪低落、潮热和骨质疏松等[2-3]。研究发现,长期使用阿片类药物治疗的慢性疼痛患者会出现OPIAD[4],严重影响了男性患者的情绪和生活质量。对于长期使用阿片类药物镇痛并出现OPIAD的患者,睾酮全身替代治疗是主要的治疗方法,但替代治疗有着诸多禁忌证,包括前列腺癌、有下尿路症状的良性前列腺增生、血细胞比容>50%和心功能较差者等,同时也存在相关并发症,如红细胞增多症、睡眠呼吸暂停、痤疮、少精不育和亚临床前列腺癌等[5-6]。目前关于OPIAD机制研究主要集中在中枢机制,涉及外周机制的研究较少,如能明确OPIAD的外周机制,并采用局部用药进行治疗,则能避免替代治疗的不良反应,为OPIAD的治疗提供新方法。
离体研究证明,胰岛素样生长因子1(insulinlike growth factor 1,IGF1)在睾酮合成过程中也发挥着重要的作用,能有效改善氟化物引起的睾酮水平下降[7]。本研究通过小鼠在体及离体实验,初步探讨OPIAD的外周机制及验证IGF1治疗作用。
1 材料与方法
1.1 动物
90~120日龄健康雄性C57BL/6小鼠,20~30 g,动物许可证:SYXK(浙)2019-0009,购于北京维通利华实验动物技术有限公司。小鼠每笼4~6只饲养,温度23~25℃,相对湿度40%~50%,光照时间07:00~19:00,自由饮食饮水。实验动物的使用均获得温州医科大学实验动物管理机构伦理审查许可。
1.2 药品、试剂和仪器
阿片μ受体激动剂DAMGO,英国Tocris公司;IGF1,美国PeproTech公司;IGF1受体拮抗剂鬼臼苦素(picropodophyllin,PPP),美国MCE公司;盐酸吗啡,东北制药集团股份有限公司;DMEM/F12和青、链霉素,美国Gibco公司;7.5%牛血清白蛋白,北京索莱宝科技有限公司;DMSO,美国Sigma公司;Trizol和引物,美国Invitrogen公司;逆转录试剂盒,日本Takara公司;荧光定量PCR试剂盒,德国Qiagen公司;乙腈、甲醇和异丙醇(色谱纯),德国Merck公司;甲酸,美国Fisher公司;睾酮标准品和睾酮-D3,比利时Acros公司;IGF1酶联免疫检测试剂盒,美国R&D Systems公司。PCR扩增仪,美国Bio-Rad公司;超高效液相色谱-串联质谱(ultra performance liquid chromatography mass spectrometry,UPLC-MS)仪 和 Waters Acquity UPLC HSSC18色谱柱(100 mm×2.1 mm,1.7 μm),美国Waters公司;多功能酶标仪,美国Bio-Tek公司。
1.3 小鼠实验
1.3.1 分组、药物处理和样品制备
将16只小鼠随机分为正常对照组和吗啡组(n=8),分别sc给予吗啡5 mg·kg-1[8]或同体积生理盐水。4 h后,小鼠麻醉后摘眼球取血,置室温静置10~20 min,4℃,626×g离心 20 min,取血清,-40℃保存。收集睾丸,去除睾丸表面的白膜及其他组织,加入1 mL预冷的PBS(pH 7.4),于冰上手动研磨制成组织匀浆,4℃,626×g离心20 min,取上清,-40℃冷冻待测。按照BCA试剂盒说明书检测睾丸匀浆总蛋白浓度。
1.3.2 UPLC-MS法检测小鼠血清和睾丸组织中睾酮含量
用甲醇配制不同浓度的睾酮标准品。分别取1.3.1制备的血清、睾丸组织匀浆或睾酮标准品100 μL,加入10 μL内标(睾酮-D3样品,10 μg·L-1),涡旋2 min混匀,随后加入200 μL乙腈沉淀蛋白,涡旋3 min后4℃,13 523×g离心10 min,取上清进行UPLC-MS分析。液相色谱条件如下:色谱柱为Waters Acquity UPLC HSS C18(100 mm×2.1 mm,1.7 μm),柱温30℃,样品室温度 10℃,进样体积10 μL,流速0.4 mL·min-1。流动相:0.1%甲酸(流动相A)+乙腈(流动相B),采用梯度洗脱。质谱条件:电离方式为ESI+,毛细管电压3 kV,离子源温度150℃,脱溶剂气温度500℃,脱溶剂气流量1000 L·h-1,锥孔气流量50 L·h-1,锥孔电压38 V,碰撞气为氩气,碰撞能量22 V。洗脱程序:0~1 min,40%B;1.1~2.5 min,40%B~90%B;2.6~4 min,90%B~40%B。以相应浓度的标准品与内标峰面积的比值经加权线性回归法得到标准曲线方程,并根据其计算血清和睾丸匀浆样品中的睾酮含量[9]。睾丸匀浆中睾酮含量(ng·g-1)=睾酮含量(ng·L-1)/睾丸匀浆总蛋白含量(g·L-1)。
1.3.3 ELISA检测小鼠血清和睾丸组织中IGF1含量
取1.3.1制备的血清和睾丸匀浆,按照ELISA试剂盒说明书检测IGF1含量。睾丸匀浆中IGF1含量(μg·g-1)=IGF1含量(μg·L-1)/睾丸匀浆总蛋白含量(g·L-1)。
1.4 小鼠睾丸曲细精管离体培养
1.4.1 组织分离和培养
将雄性C57BL/6小鼠处死后在无菌条件下取睾丸,去除睾丸周围的附睾及结缔组织,置于预冷的DMEM/F12中,分别经75%乙醇浸泡消毒1次、PBS清洗2次,随后将睾丸置于装有培养基的玻璃培养皿中,去除外层白膜,分离睾丸组织为长短大致相同的单根曲细精管。在24孔板或48孔板中分别加入500或300 μL培养基(DMEM/F12+0.1%BSA),将曲细精管移至培养板中,保证各孔中曲细精管数量相同,置34℃,5%CO2培养箱培养24 h,而后进行相应分组和药物处理。于药物处理前分别测定组织培养基中睾酮和IGF1的基础含量。实验重复3次,每组设6复孔。
1.4.2 UPLC-MS法检测IGF1对睾酮合成的时效作用
将睾丸曲细精管分为正常对照组和IGF1组,分别给予生理盐水或IGF1 100 μg·L-1进行孵育,于孵育12,24或48 h后收集培养基,同1.3.2检测睾酮含量。以药物处理后的睾酮含量与基础含量的比值表示睾酮相对含量。
1.4.3 ELISA检测DAMGO对IGF1合成分泌的影响
将睾丸曲细精管分为正常对照组和DAMGO组[10],分别给予生理盐水或 DAMGO 10 μmol·L-1,培养48 h后收集培养基,同1.3.3检测IGF1含量。以药物处理后IGF1含量与基础含量的比值表示IGF1相对含量。
1.4.4 UPLC-MS法检测IGF1对DAMGO睾酮合成抑制作用的影响
将睾丸曲细精管分为正常对照组(给予生理盐水)、IGF1组(加入IGF1 100 μg·L-1)、DAMGO 组(加入 DAMGO 10 μmol·L-1)和 IGF1+DAMGO 组(同时加入IGF1 100 μg·L-1和DAMGO 10 μmol·L-1),培养48 h后收集培养上清,同1.3.2检测睾酮含量。
1.4.5 荧光定量RT-PCR检测睾丸曲细精管组织睾酮合成相关酶mRNA表达水平
实验分组和给药同1.4.4。药物处理后收集曲细精管,Trizol法提取收集的曲细精管RNA,并测定其浓度和纯度。按照逆转录试剂盒说明书操作,将RNA逆转录为cDNA,随后按照荧光定量RT-PCR试剂盒说明书操作,检测睾酮合成相关酶—清道夫受体B1(scavenger receptor B-1,Scarb1)、类固醇合成急性调节蛋白(steroidogenic acute regulato⁃ry protein,Star)、胆固醇侧链裂解酶(cholesterol side chain cleavage enzyme,Cyp11α1)、17α-羟化酶1(17α-hydroxylase-1,Cyp17α1)、3β-羟化类固醇脱氢酶1(3β-hydroxysteroid dehydrogenase-1,3βHsd1)和17β-羟基类固醇脱氢酶3(17β-hydroxys⁃teroid dehydrogenase-3,17βHsd3)mRNA水平,引物序列见表1。荧光定量RT-PCR的反应条件:预变性(95℃,2 min),变性(95℃,5 s)、退火及延伸(60℃,10 s),共40循环,最后65℃延伸5 s。采用双标准曲线法检测样本中各睾酮合成相关酶mRNA相对表达水平。
1.4.6 UPLC-MS法检测IGF1促进睾丸曲细精管合成睾酮的受体特异性
将睾丸曲细精管分为正常对照组(给予生理盐水)、溶剂对照组(加入0.01%DMSO)、PPP组(加入 IGF1 受体特异性拮抗剂 PPP 1 μmol·L-1[11])、IGF1 组(加入 IGF1 100 μg·L-1)和 PPP+IGF1 组(加入 PPP 1 μmol·L-1孵育 2 h 后,再加入 IGF1 100 μg·L-1共同培养 24 h),药物处理后收集培养基,同1.3.2检测睾酮含量。

Tab.1 Primer sequences of qRT-PCR
1.5 统计学分析
实验结果数据用±s表示,采用SPSS18.0统计软件进行数据统计处理分析。IGF1时效作用实验采用重复测量方差分析,2组比较采用成组样本t检验;3组及以上采用单因素方差分析(ANOVA),组间两两比较采用LSD检验。P<0.05表示差异有统计学意义。
2 结果
2.1 吗啡对小鼠血清和睾丸组织中睾酮和IGF1含量的影响
UPLC-MS和ELISA检测结果显示,雄性成年小鼠sc给予吗啡5 mg·kg-14 h后,与正常对照组比较,吗啡组小鼠血清和睾丸匀浆中的睾酮含量(图1A和1C)和IGF1含量(图1B和1D)均显著下降(P<0.05,P<0.01)。
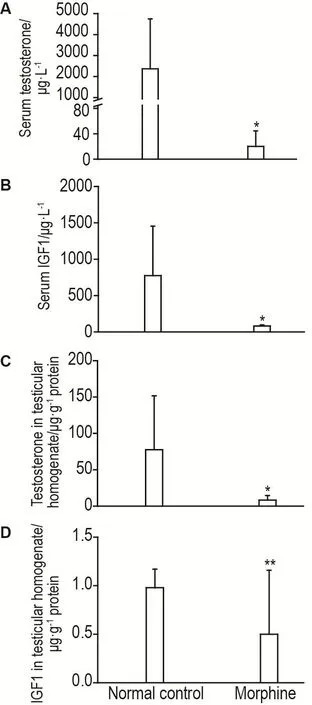
Fig.1 Contents of testosterone and insulin-like growth factor 1(IGF1)in serum and testicular homogenate.C57BL/6 mice were sc given morphine(5 mg·kg-1)or saline for 4 h.The testosterone contents of serum(A) and testicular homogenate(C)in mice were measured by ultra performance liquid chromatography mass spectrometry(UPLC-MS),and the IGF1 contents in serum(B)and testicular homogenate(D)were measured by ELISA.±s,n=8.*P<0.05,**P<0.01,compared with normal control group.
2.2 IGF1对曲细精管睾酮合成的时效的影响
UPLC-MS检测结果显示(图2),与正常对照组相比,离体培养的睾丸曲细精管经IGF1 100 μg·L-1孵育12 h后,IGF1组培养基中睾酮相对含量无明显变化;而孵育24和48 h后,IGF1组培养基中睾酮相对含量明显增加(P<0.01)。

Fig.2 Effect of different durations of IGF1 treatment on relative testosterone content in seminiferous tubules culture supernatant detected by UPLC-MS.The seminif⁃erous tubules were isolated from male C57BL/6 mice and treated with IGF1 100 μg·L-1for 12,24 and 48 h.Relative testosterone content was the ratio of testosterone content after drug treat⁃ment to the basic content.±s,n=3.**P<0.01,compared with normal control group.
2.3 DAMGO对曲细精管合成分泌IGF1的影响
ELISA检测结果显示,与正常对照组(0.57±0.11,n=3)比较,DAMGO组培养基中IGF1相对含量(0.26±0.01,n=3)显著降低(P<0.01),提示DAMGO抑制曲细精管合成分泌IGF1。
2.4 IGF1对DAMGO抑制睾酮合成的影响
UPLC-MS检测结果显示(图3),与正常对照组相比,IGF1组离体睾丸曲细精管培养基中睾酮相对含量明显升高(P<0.01),DAMGO组培养基中睾酮相对含量降低(P<0.05);与 DAMGO 组相比,IGF1+DAMGO组培养基中睾酮相对含量显著上升(P<0.01)。
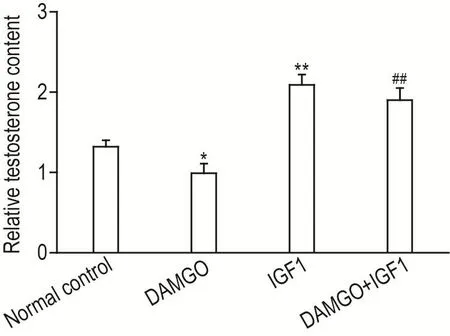
Fig.3 Effect of IGF1 on relative testosterone content induced by DAMGO detected by UPLC-MS.The seminif⁃erous tubules were isolated and divided into normal control group,IGF1 group(IGF1 100 μg·L-1),DAMGO group(DAMGO 10 μmol·L-1)and IGF1+DAMGO group(DAMGO 10 μmol·L-1 and IGF1 100 μg·L-1).Drugs were incubated or co-incubated for 48 h,respectively.±s,n=3. *P<0.05,**P<0.01,compared with normal control group;##P<0.01,compared with DAMGO group.
2.5 IGF1及DAMGO处理对离体曲细精管组织中睾酮合成相关酶mRNA水平的影响
荧光定量RT-PCR结果(图4)显示,与正常对照组相比,IGF1组和IGF1+DAMGO组Star和17βHsd3mRNA水平显著增加(P<0.05)(图4B和4F),DAMGO组3βHsd1mRNA表达水平明显降低(P<0.01)(图4E);而与DAMGO组相比,IGF1+DAMGO组Star和17βHsd3mRNA表达显著增加(P<0.05)(图4B和4F);其余各基因表达水平在各组间无明显改变。
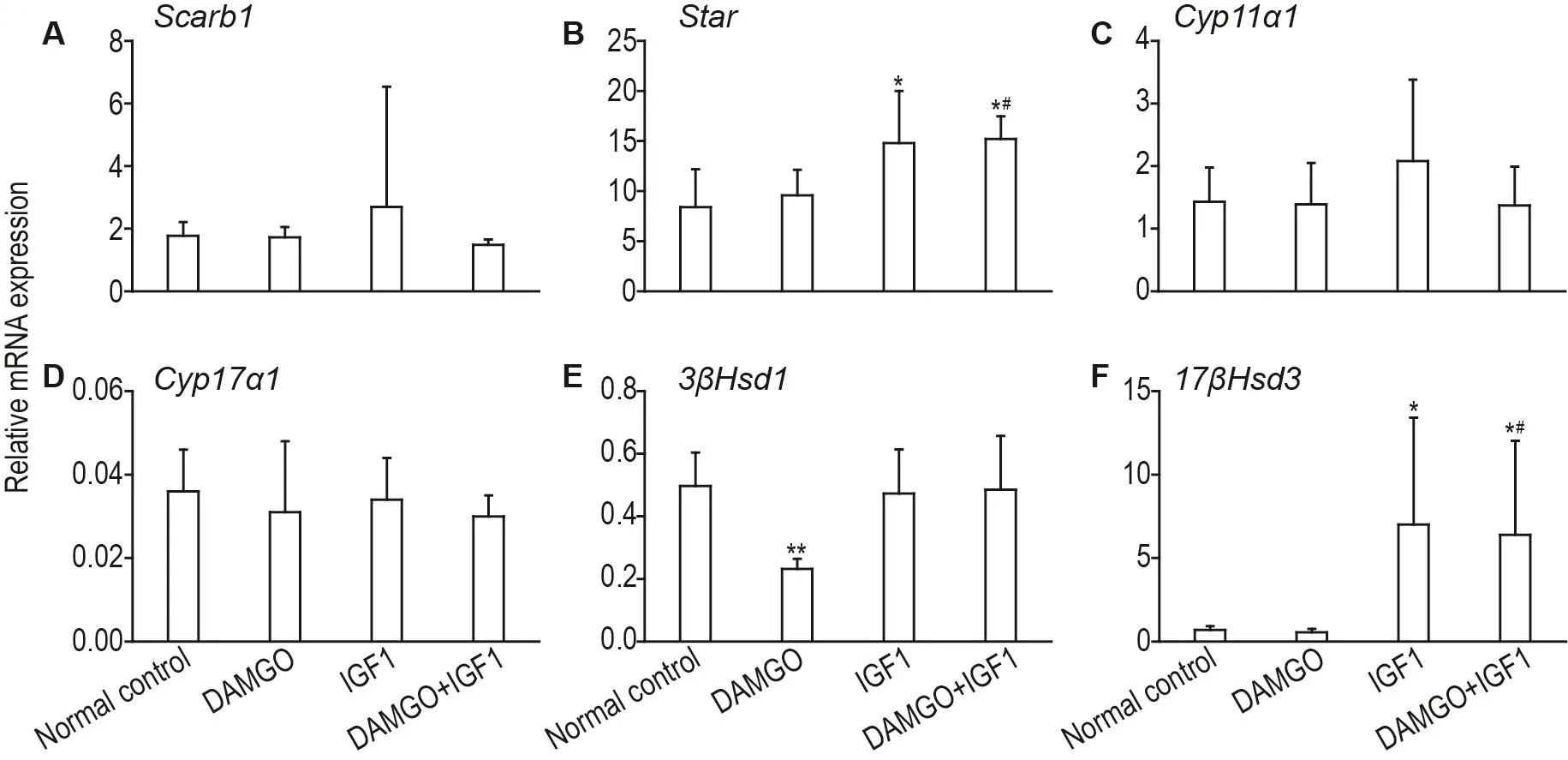
Fig.4 Effects of IGF1 and DAMGO on mRNA levels of testosterone synthesis-related enzymes in seminiferous tubule tissue by qPCR.See Fig.4 for the treatment.±s,n=6.*P<0.05,**P<0.01,compared with normal control group;#P<0.05,compared with DAMGO group.
2.6 IGF1促进睾丸曲细精管合成睾酮的受体特异性
UPLC-MS检测结果显示(图5),离体睾丸曲细精管经IGF1和PPP单独或联合孵育后,与正常对照组相比,IGF1组培养上清中睾酮相对含量明显升高(P<0.01);与溶剂对照组相比,PPP组和PPP+IGF1组培养上清中睾酮相对含量无明显变化;与PPP组相比,PPP+IGF1组培养上清中睾酮相对含量无明显变化;与IGF1组相比,PPP+IGF1组培养上清中睾酮相对含量明显降低(P<0.01)。

Fig.5 Effects of IGF1 and picropodophyllin(PPP)on relative testosterone content in culture superna⁃tant of seminiferous tubules detected by UPLC-MS.The seminiferous tubules were isolated and divided into normal control group,vehicle group(0.01%DMSO),IGF1 group(IGF1 100 μg·L-1),PPP group(PPP 1 μmol·L-1),and PPP+IGF1 group.The PPP+IGF1 group was incubated with PPP 1 μmol·L-1 for 2 h,then co-incubated with IGF1 100 μg·L-1for 24 h.The other groups were incubated with diffrent drugs or vehicles for 24 h,respectively.±s,n=3.**P<0.01,compared with normal control group;##P<0.01,compared with IGF1 group.
3 讨论
阿片类药物主要通过μ,κ和δ等阿片受体产生作用[12],其中阿片μ受体作为经典的G蛋白偶联受体,除广泛分布于下丘脑、垂体等中枢神经系统外,在其他组织细胞中也有分布。较多的研究结果显示,在人和啮齿类动物睾丸组织中,成熟的精子、精原细胞和巨噬细胞等均表达阿片μ受体[13-14]。另外,Fabbri等[15]发现,睾丸支持细胞和未成熟的睾丸间质细胞表面表达了大量的阿片μ受体,然而成熟的睾丸间质细胞表面却并不表达阿片μ受体。本研究首先通过成年小鼠sc给予吗啡,发现小鼠血清和睾丸匀浆中睾酮和IGF1水平均显著下降,提示吗啡可能通过中枢机制和(或)外周机制抑制睾酮和IGF1的分泌。吗啡抑制睾酮合成的中枢机制主要通过下丘脑-垂体-性腺轴(hypothalamic-pitu⁃itary-gonadal axis,HPG)调控,阿片类药物可作用于下丘脑μ受体,减少下丘脑释放促性腺激素释放激素,抑制垂体合成分泌黄体生成素和卵泡刺激素,或直接作用于垂体的阿片μ受体,减少黄体生成素和卵泡刺激素的分泌,进而干扰机体睾酮的合成[16]。而关于阿片类物质影响睾酮合成分泌的外周机制目前尚未明确,有研究者发现,在未成年大鼠睾丸内局部注射脑啡肽可抑制睾酮分泌,提示阿片类物质可能通过外周机制调控睾酮的合成分泌[17],但整体动物睾丸内局部注射模型并不能完全排除中枢机制的干扰。本研究采用了离体曲细精管培养模型,可以相对保留睾丸原有微环境的同时,避免了HPG轴对睾酮合成分泌的中枢调控[18],有利于OPIAD的外周机制探讨及验证IGF1外周治疗作用。研究结果发现,在离体曲细精管模型中,DAMGO明显抑制睾酮及IGF1的合成分泌,表明OPIAD存在相应的外周机制。
IGF1是一种在分子结构上与胰岛素类似的多肽物质,主要由肝合成释放[19],能与IGF1受体结合,在儿童的生长发育和机体的物质合成代谢中起重要调控作用。2005年,美卡舍明(重组人胰岛素样生长因子1)通过美国FDA的批准作为严重原发性IGF1缺乏症治疗药进入临床,但因其全身注射具有较多的不良反应,如缺铁性贫血、淋巴结病、扁桃体肿大、甲状腺肿大和关节痛等,使美卡舍明的临床应用范围变得十分狭窄[20]。如果局部注射IGF1对OPIAD具有外周治疗作用,则能避免IGF1全身给药的副作用,开辟新的临床应用前景。目前临床上对于睾丸鞘膜积液等疾病的治疗,也可以使用局部外周注射的方式,通过睾丸鞘膜内注射相应药物,减少细胞浸润和炎性渗出等,同时刺激鞘膜腔形成无菌性粘连,从而治愈鞘膜积液[21]。另外,关于局部睾丸透皮给药贴剂的专利也早有报道,如1989年美国Campbell等[22]的睾丸透皮给药装置,均提示睾丸外周局部治疗具有很好的可行性及实用性。
在睾丸组织中,IGF1可由睾丸间质细胞、生精细胞及巨噬细胞等合成分泌[23],睾丸内合成分泌的IGF1可通过旁分泌或自分泌作用调控上述3种细胞或其他细胞的功能[24-25]。有研究表明,IGF1能明显降低睾丸间质细胞的凋亡率并促进未成熟睾丸间质细胞合成睾酮[26],而将小鼠全身Igf1基因敲除后,基因敲除小鼠血清中睾酮水平较野生小鼠明显降低[27]。本研究发现,在离体OPIAD模型中,IGF1能逆转DAMGO所引起的睾酮水平降低,提示IGF1在OPIAD治疗方面的重要作用。胰岛素受体、IGF1受体及IGF2受体在睾丸组织中广泛分布,睾丸支持细胞、间质细胞和生殖细胞上均有它们的存在[28],与IGF1有一定的亲和力。本研究结果表明,IGF1可通过睾丸组织中的IGF1受体促进睾丸间质细胞合成睾酮。
另外,睾酮的合成与分泌过程涉及到诸多睾酮合成相关酶类如Scarb1,Star,3βHsd1,Cyp17α1,Cyp11α1和17βHsd3等。有研究表明,IGF1能增加Star基因的表达,而当敲除Igf1基因后,Scarb1,Star,Cyp17α1,Cyp11α1和17βHsd3 mRNA水平明显降低[7,29]。本研究结果也发现,IGF1能显著增强曲细精管组织中Star和17βHsd3 mRNA表达水平,对Cyp11α1,Cyp17α1,Scarb1和3βHsd1 mRNA水平则无影响。同时,经DAMGO处理后,曲细精管组织中的3βHsd1 mRNA表达水平明显降低,而Cyp11α1,Cyp17α1,Scarb1,17βHsd3和Star mRNA表达水平则无明显变化。
本研究采用IGF1对OPIAD进行外周治疗的方法,未见文献报道。然而本研究依旧存在些许不足之处,如睾丸组织中各类细胞上是否存在阿片μ受体,阿片类药物以及IGF1具体作用于睾丸中何种细胞上的受体产生相应的生物学效应,其他类型的阿片受体是否参与OPIAD的外周机制,这些是后续研究应解决的关键性问题。
综上所述,在整体动物和离体组织培养实验均表明,OPIAD存在中枢和外周2种机制。阿片类药物直接作用于睾丸组织上的阿片μ受体,抑制3βHsd1等睾酮合成相关酶mRNA表达,减少睾酮和IGF1的合成分泌,IGF1能直接通过睾丸组织中的IGF1受体,促进Star和17βHsd3 mRNA表达,从而对OPIAD产生相应的治疗作用。

