巨噬细胞分泌转化生长因子 β对百草枯中毒致肺纤维化的影响
孙阳阳,王 倩,孙明尧,王小宁,刘凤英,王 帅,杨维杰,王道辉,张敏敏,骆 媛,王永安
(1.军事科学院军事医学研究院毒物药物研究所,抗毒药物与毒物学国家重点实验室,北京 100850;2.中国人民解放军96604部队医院药剂科,甘肃 兰州 730030)
百草枯(paraquat,PQ)是一种广泛应用的速杀型除草剂,对人畜具有高毒性。肺是PQ中毒的主要靶器官,中毒早期可引起肺泡炎、肺水肿、肺出血等症状,度过急性期后往往发展为肺纤维化。组织受损时,巨噬细胞一方面产生活性氧及其他毒性介质影响正常代谢,诱导细胞凋亡,加重组织损伤;另一方面又会产生胰岛素样生长因子1、血管内皮生长因子α和转化生长因子β(transforming growth factor-β,TGF-β)等,参与调节上皮细胞和内皮细胞增殖及成纤维细胞活化[1-3]。TGF-β通过诱导细胞分化、迁移、侵袭或增生性改变,在特发性肺纤维化发病中起主导作用[4]。研究表明,TGF-β通过激活Smad2/3、丝裂原活化蛋白激酶等信号通路诱导成纤维细胞分化为肌成纤维细胞,并使α平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)表达增加,分泌大量Ⅰ型和Ⅲ型胶原蛋白及纤连蛋白等细胞外基质,肺泡正常结构被破坏,影响气体交换,最终导致呼吸衰竭而死亡[5-6]。PQ中毒患者和动物肺组织中出现大量巨噬细胞聚集[7],提示其可能在PQ所致肺纤维化过程中发挥重要作用。本研究利用Tran⁃swell技术建立人胚肺成纤维细胞与巨噬细胞共培养体系,并使用PQ染毒构建肺纤维化细胞模型,以探讨巨噬细胞参与PQ所致肺纤维化的分子机制。
1 材料与方法
1.1 细胞和试剂
人胚肺成纤维细胞MRC-5和人急性单核细胞白血病细胞THP-1,中国医学科学院基础医学研究所基础医学细胞中心。MEM培养基、RPMI 1640培养基和胎牛血清,美国赛默飞公司;佛波酯(phor⁃bol 12-myristate-13-acetate,PMA),美国Sigma公司;Trizol,美国Invitrogen公司;Prime ScriptR RT试剂盒、gDNA及 SYBR Premix Ex TaqTM,日本TaKaRa公司;兔抗人TGF-β、α-SMA、Smad2、基质金属蛋白酶9(matrix metalloprotein-9,MMP-9)和3-磷酸甘油醛脱氢酶(glyceraldehyde-3-phos⁃phate dehydrogenase,GAPDH)单克隆抗体(一抗),英国Abcam公司;兔抗人纤连蛋白单克隆抗体(一抗),美国Immunoway公司;辣根过氧化物酶标记的山羊抗兔IgG抗体(二抗),北京中杉金桥生物技术有限公司;Alexa FluorTM 488标记鬼笔环肽和Hoechst33342,美国Invitrogen公司;CCK-8试剂盒,日本同仁公司;TGF-β抑制剂GW788388,美国Selleck公司。CFX-96实时荧光定量PCR仪、MyCycler梯度PCR仪、垂直板电泳槽、PowerPac™HC稳压稳流电泳仪及Trans-Blot SD半干电转仪,美国 Bio-Rad 公司;24 mm Transwell,美国康宁公司;引物购自中国北京擎科生物科技有限公司;TGF-β引物序列为:正向,GCTGCTGTGGC⁃TACTGGTG;反向,CATAGATTTCGTTGTGGGTTTC;GAPDH:正向,AACGGATTTGGTCGTATTG,反向,GCTCCTGGAAGATGGTGAT。
1.2 巨噬细胞的诱导分化
将对数生长期的THP-1细胞离心,弃上清,用含有PMA 320 nmol·L-1的RPMI 1640培养基重悬,按1.0×109L-1细胞接种至T25培养瓶中培养24 h,倒置显微镜下观察细胞形态。若细胞由悬浮生长转变为贴壁成簇生长,并伸出伪足,则表示THP-1细胞分化为巨噬细胞[8]。
1.3 CCK-8法检测细胞存活率
取1.2诱导分化的对数生长期的巨噬细胞消化、离心、重悬,计数后以1×109L-1接种于96孔板,每孔 100 μL。37℃,5%CO2条件下培养 24 h。待细胞贴壁生长密度为80%时吸弃培养基,染毒组分别加入含PQ 20,40,60,80,100,120,140,160和180 μmol·L-1(终浓度)的完全培养基〔RPMI 1640和MEM培养基(V∶V=1∶1),含10%FBS〕100 μL,细胞对照组加入100 μL不含PQ的完全培养基,同时设空白组(不含细胞),每组设6复孔。培养48 h后,每孔加10 μL CCK-8溶液,继续培养3 h,用酶标仪在450 nm波长下测定各孔吸光度(A450nm)值。实验重复3次。细胞存活率(%)=(实验组A450nm-空白组A450nm)/(细胞对照组A450nm-空白对照组A450nm)×100%。
1.4 巨噬细胞与MRC-5细胞共培养体系及肺纤维化细胞模型的建立
用孔径0.4 μm的6孔Transwell小室构建巨噬细胞与MRC-5细胞交互作用的共培养体系。MRC-5和1.2诱导分化的巨噬细胞用胰酶消化、离心、弃上清,用完全培养基重悬后,MRC-5细胞以1×108L-1接种于Transwell下室,每孔 2.6 mL;巨噬细胞以1×109L-1接种于Transwell上室,每孔1.5 mL;培养24 h后为共培养体系。PQ染毒组更换为含PQ(终浓度为75,100和125 μmol·L-1)的完全培养基,细胞对照组更换为完全培养基,GW788388干预组更换为含PQ(终浓度100μmol·L-1)和GW788388(终浓度10 μmol·L-1)的完全培养基,置37℃培养箱继续培养48 h。
1.5 Western印迹法检测巨噬细胞TGF- β和MRC-5细胞 α-SMA、Smad2 、MMP-9和纤连蛋白表达
收集1.4分组处理的上、下室细胞,分别加入100 μL细胞裂解液。充分裂解后,4℃,12 000×g离心5 min取上清,用BCA法测定总蛋白浓度,并用上样缓冲液和裂解液对各组蛋白定量并煮沸变性;用SDS-聚丙烯酰胺凝胶电泳,半干法转膜,5%脱脂牛奶室温振荡2~3 h进行封闭。取出PVDF膜,分别加入抗 α-SMA、Smad2、MMP-9、TGF-β、纤连蛋白和GAPDH单克隆抗体(1∶1000)溶液,4℃孵育过夜,TBST常温振荡漂洗5 min,漂洗5次;加辣根过氧化物酶标记山羊抗兔IgG抗体(1∶2000)溶液,室温孵育1 h,用TBST常温振荡5 min,漂洗5次。ECL化学发光成像后,用Quanti⁃tyOne图像分析软件对蛋白条带积分吸光度(inte⁃grated abosorbance,IA)值进行半定量分析,目的蛋白相对表达水平以目的蛋白条带与内参蛋白条带IA比值表示。
1.6 实时荧光定量逆转录PCR(qRT-PCR)检测MRC-5细胞和巨噬细胞TGF- β mRNA表达
取1.4分组处理的上、下室细胞,弃上、下室培养上清,并用预冷的PBS清洗1次。各小室加入0.5 mL Trizon反复吹打后移至1.5 mL EP管中,室温静置5 min后加入0.25 mL三氯甲烷,振荡15 s;静置3 min后12 000×g,4℃离心15 min;取上清加入0.25 mL异丙醇,混匀后静置10 min,12 000×g,4℃离心10 min;弃上清后加入75%乙醇12 000×g,4℃离心6 min;弃上清后室温干燥5 min;加入20 μL无RNA酶H2O溶解并检测mRNA浓度。按说明书将mRNA逆转录成cDNA,于96孔板中进行PCR扩增。TGF-β mRNA表达检测采用SYBRgreen荧光标记法,扩增过程采取两步法:95℃5 min预变性;(95℃10 s→60℃ 30 s)共 40个循环反应;95℃,15 s;59.5℃,60 s;95℃ 15 s进行溶解曲线分析。目的基因相对表达水平用2-ΔCt表示。
1.7 免疫荧光染色法检测MRC-5细胞纤维状肌动蛋白(F-actin)的表达
取1.4处理的下室MRC-5细胞,弃上清,用预冷的PBS迅速漂洗下室3次;4%多聚甲醛固定15 min,PBS漂洗3次;加0.1% Triton X-100透化细胞膜20 min;PBS漂洗3次;再用5%牛血清白蛋白封闭1 h,吸弃液体;滴加稀释的鬼笔环肽染液(0.25 mg·L-1),室温孵育45 min,PBS漂洗3次,每次3 min;滴加Hoechst33342避光孵育5 min,进行核染;用PBS漂洗4次(每次5 min)洗去剩余的Hoechst33342,荧光显微镜下观察MRC-5细胞绿色荧光的变化,拍照并记录。采用imagepro-Plus 6.0图像分析软件对各组图像进行分析,计算各组细胞荧光强度。
1.8 统计学分析
2 结果
2.1 PMA诱导THP-1细胞分化为巨噬细胞的鉴定
经PMA诱导24 h后,倒置显微镜下观察发现,THP-1细胞由悬浮生长(图1A)转变为贴壁成簇生长,并伸出伪足(图1B),表示细胞分化为巨噬细胞,可用于以下实验。
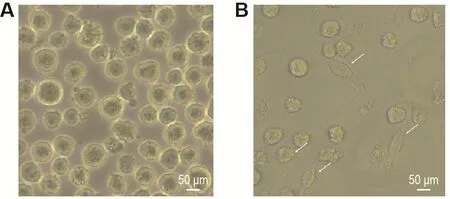
Fig.1 Macrophages differentiated from THP-1 cells induced by phorbol 12-myristate 13-acetate(PMA)for 24 h.THP-1 cells were treated with PMA 320 nmol·L-1for 24 h before cell morphology was identified by microscope.A:spherical THP-1 cells growing in suspension;B:macro⁃phages growing adherently and extending pseudopods after PMA induction.The white arrows indicate pseudopodia.
2.2 PQ降低巨噬细胞存活率
CCK-8结果(图2)显示,与细胞对照组相比,PQ 20 ~180 μmol·L-1作用于巨噬细胞48 h后,细胞存活率显著降低(P<0.01),半数抑制浓度(IC50)为 57.13 μmol·L-1。
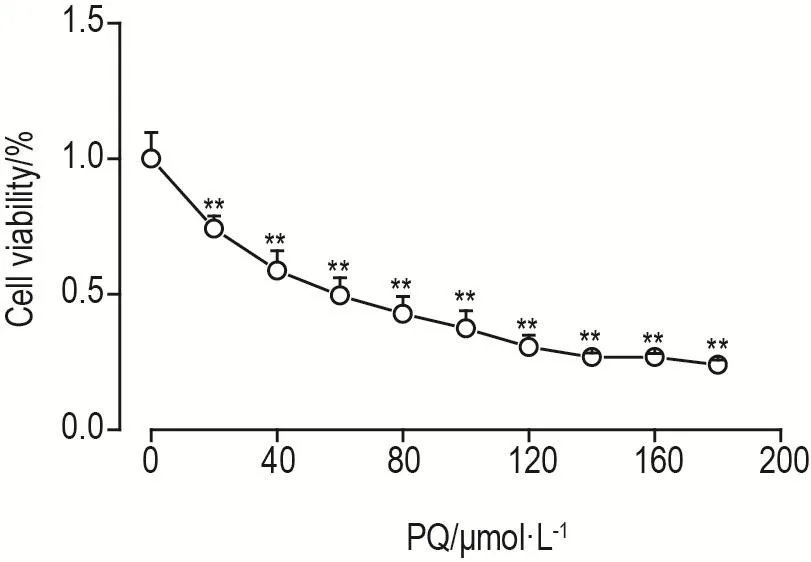
Fig.2 Effect of parquat(PQ)on cell viability of macro⁃phages by CCK-8 assay.Macrophages were treated with PQ 20,40,60,80,100,120,140,160 and 180 μmol·L-1for 48 h before the cell vibility was detected by CCK-8 assay.±s,n=3.**P<0.01,compared with cell control(0 μmol·L-1)group.
2.3 PQ和TGF- β受体抑制剂GW788388对共培养体系MRC-5细胞纤维化相关蛋白表达的影响
图3结果显示,与细胞对照组相比,PQ染毒后MRC-5细胞α-SMA和纤连蛋白表达显著增加(P<0.01);与PQ染毒组相比,TGF-β受体抑制剂GW788388处理后,α-SMA和纤连蛋白表达显著降低(P<0.01,P<0.05)。
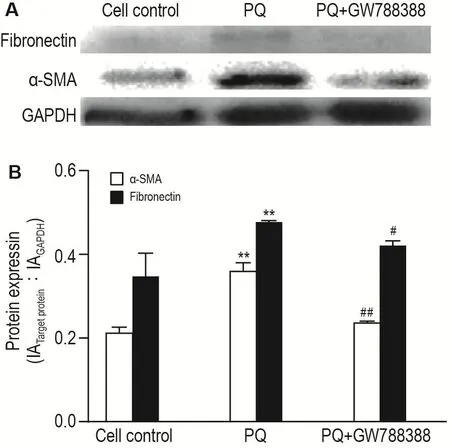
Fig.3 Effect of PQ and GW788388 on protein expres⁃sion of α -smooth muscle actin( α -SMA)and fibronectin in MRC-5 cells detected by Western blotting.The co-cul⁃ture systerm was treated with PQ 100 μmol·L-1or PQ 100 μmol·L-1 withGW788388 10 μmol·L-1for 48 h.B was the semi-quantitative result of A.±s,n=3.**P<0.01,compared with cell control group;#P<0.05,##P<0.01,compared with PQ group.
2.4 PQ对共培养体系中MRC-5细胞纤维状肌动蛋白表达的影响
图4结果显示,PQ染毒巨噬细胞和MRC-5细胞共培养体系48 h后,用荧光标记的鬼笔环肽染色MRC-5细胞。与细胞对照组相比,PQ染毒组MRC-5细胞中荧光强度增强(P<0.01);与PQ染毒组相比,GW788388处理后MRC-5细胞荧光强度降低(P<0.01)。

Fig.4 Effect of PQ and GW788388 on expression of F-actin in MRC-5 cells detected by immunofluores⁃cence assay.See Fig.3 for the cell treatment.B was the semi-quantitative result of A.±s,n=3.**P<0.01,compared with cell control group;##P<0.01,compared with PQ group.
2.5 PQ对巨噬细胞TGF- β mRNA和蛋白表达的影响
图5结果显示,巨噬细胞暴露于PQ 75,100和 125 μmol·L-148 h,与细胞对照组相比,PQ 100 μmol·L-1组TGF-β mRNA表达显著增加(P<0.01)。Western印迹结果(图6)亦表明,与细胞对照组相比,PQ 100和125 μmol·L-1组 TGF-β 蛋白表达显著增加(P<0.01)。

Fig.5 Effect of PQ on transforming growth factor- β(TGF- β)mRNA expression in macrophages detected by qRT-PCR.The co-culture systerm was treated with PQ for 48 h.±s,n=3.**P<0.01 ,compared with cell control(0 μmol·L-1)group.
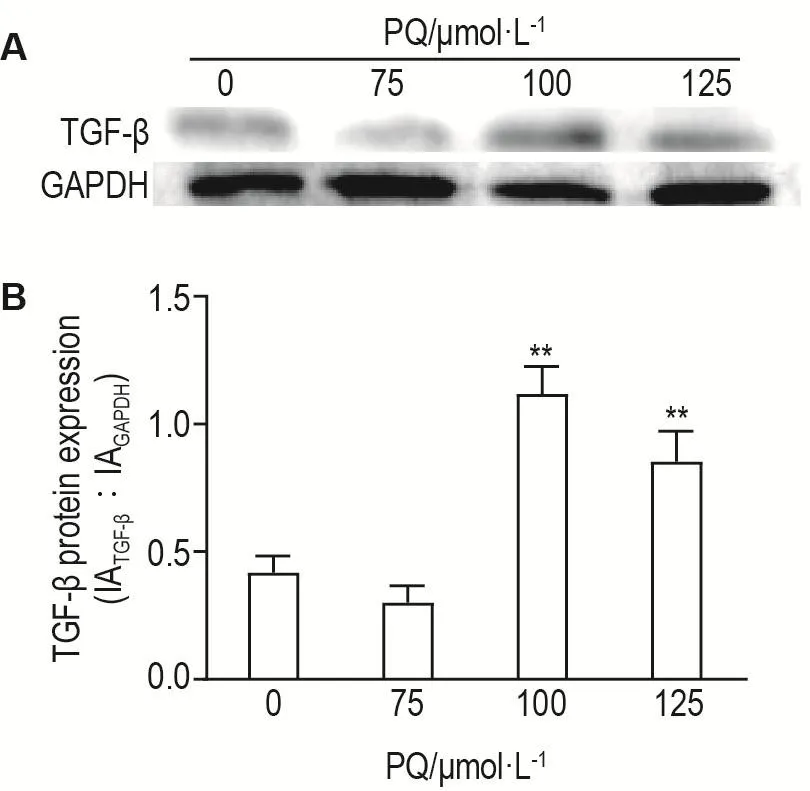
Fig.6 Effect of PQ on TGF- β protein expression in macrophages detected by Western bloting.See Fig.5 for the cell treatment.B was the semi-quantitative result of A.±s,n=3.**P<0.01,compared with cell control(0 μmol·L-1)group.
图7结果显示,细胞对照组巨噬细胞TGF-β mRNA表达显著高于MRC-5细胞;PQ染毒48 h后2种细胞TGF-β mRNA表达均显著升高(P<0.01)。
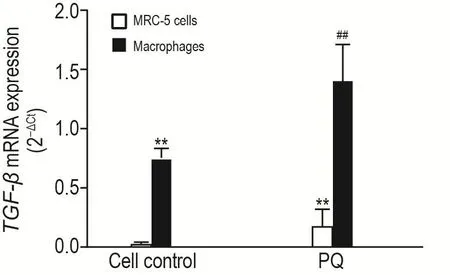
Fig.7 Effect of PQ on TGF- β mRNA expression in macrophages and MRC-5 cells detected by qRT-PCR.The co-culture systerm was treated with PQ 100 μmol· L-1for 48 h.±s,n=3. **P<0.01,compared with MRC-5 cell control group;##P<0.01,compared with macrophages control group.
2.6 PQ和GW788388对MRC-5细胞TGF- β/Smads通路相关蛋白表达影响
图8结果显示,与细胞对照组相比,PQ染毒后MRC-5细胞Smad2和MMP-9蛋白表达显著增加(P<0.05,P<0.01);与PQ染毒组相比,GW788388处理后,Smad2和MMP-9蛋白表达显著降低(P<0.05)。
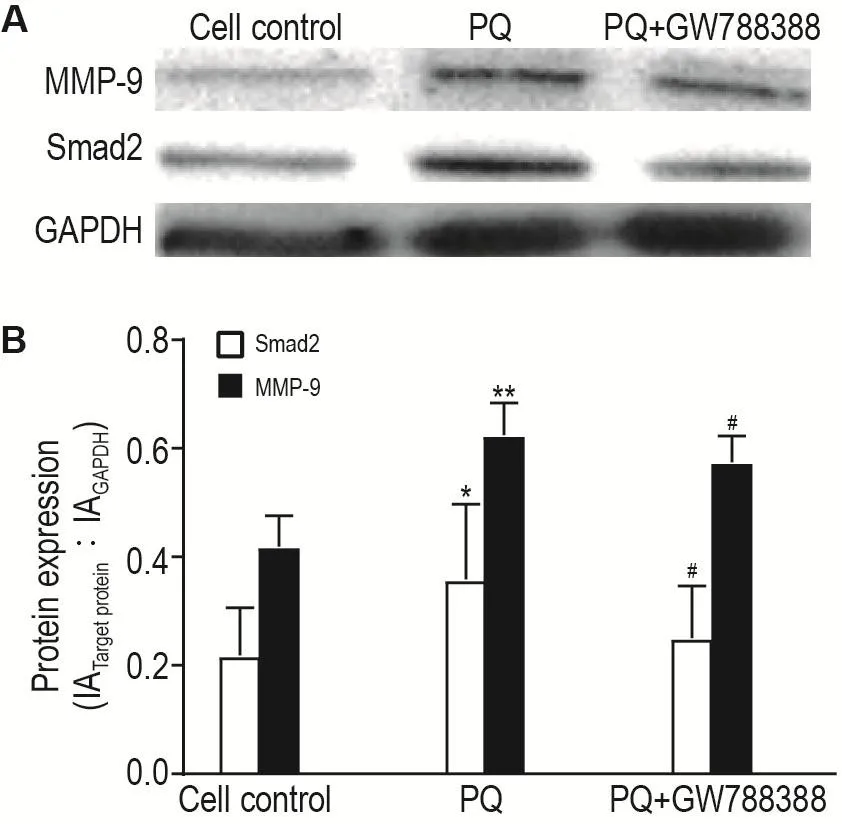
Fig.8 Effect of PQ and GW788388 on protein expres⁃sion of matrixmetalloprotein-9(MMP-9)and Smad2 in MRC-5 cells detected by Western blotting.See Fig.3 for the cell treatment.B was the semi-quantitative result of A.±s,n=3.*P<0.05,**P<0.01,compared with corresponding cell control group;#P<0.05,compared with corresponding PQ group.
3 讨论
PQ是一种高毒速杀型除草剂,每年因误服或自服PQ导致的中毒事件屡有发生。PQ中毒易致肺纤维,但其机制尚未明确。既往关于PQ中毒致肺纤维化的研究多局限于肺上皮细胞的损伤及损伤后细胞因子对成纤维细胞的调控[10-11],对巨噬细胞在此过程的作用尚未阐明。本研究基于Tran⁃swell技术建立PQ诱导肺纤维化细胞模型,探讨巨噬细胞参与PQ中毒致肺纤维化的作用机制。
PQ中毒所致肺纤维化是一种涉及多种细胞类型和细胞通路的复杂病理过程,在此过程中巨噬细胞可以通过多种细胞因子调控肺成纤维细胞激活并分泌细胞外基质。有鉴于此,基于单一类型细胞构建的体外模型不能很好地反映整个疾病的发生发展过程,基于此类模型研究疾病的发生机制也具有一定的局限性。因此,构建巨噬细胞与肺成纤维细胞共培养体系,研究细胞间通讯在肺成纤维化机制中的作用,对于阐明PQ中毒所致肺纤维化机制非常重要。本研究利用Transwell小室将巨噬细胞和肺成纤维细胞分开培养,2种细胞通过分泌于培养基中的细胞因子和代谢产物等完成细胞间的交流。这种无需接触既可实现细胞间交互作用的系统,既避免了细胞接触所介导的生长抑制效应,又可实现细胞分泌的细胞因子和细胞外基质对2种细胞的通讯作用。
在多种特发性肺纤维化体外、体内模型中均发现,TGF-β是诱导成纤维细胞分泌细胞外基质的主要细胞因子之一。以往多项研究表明,巨噬细胞是肺纤维化发展过程中TGF-β的主要来源[12-13]。此外,在正常肺实质组织中,TGF-β只分布于肺内的巨噬细胞。本研究RT-PCR结果也表明,TGF-β在共培养体系中呈现出表达的空间特异性,即在巨噬细胞中的表达量约为MRC-5细胞的21倍。在PQ染毒共培养体系48 h后,TGF-β在2种细胞中的表达均显著增加,但仍以巨噬细胞表达为主,其表达量约为MRC-5细胞的7倍。为此认为,在本研究所建立的模型中,巨噬细胞通过旁分泌TGF-β刺激肺成纤维细胞活化而发挥促进肺纤维化的作用。
本研究所构建的共培养体系中,暴露PQ 48 h,巨噬细胞TGF-β表达显著增加,并通过上调TGF-β/Smads通路相关蛋白Smad2诱导MRC-5细胞分化为肌成纤维细胞。此外,MRC-5细胞纤维化标志物纤连蛋白、α-SMA和纤维状肌动蛋白表达显著增高,表明巨噬细胞和MRC-5细胞共培养体系暴露于PQ,肺纤维化细胞模型构建成功。同时用TGF-β受体抑制剂GW788388处理,可显著降低TGF-β/Smads通路相关蛋白及纤维化相关蛋白表达,进一步提示PQ可能直接刺激巨噬细胞高表达TGF-β,TGF-β通过激动TGF-β/Smads通路而活化成纤维细胞,活化后的成纤维细胞分泌大量细胞外基质导致肺纤维化。以往报道,PQ通过氧化应激反应损伤肺泡上皮细胞,损伤后的肺上皮细胞表达TGF-β及其他细胞因子,继而活化成纤维细胞引起肺纤维化[14]。本研究结果发现,PQ可促进巨噬细胞分泌TGF-β而参与PQ中毒致肺纤维化的发生。
综上所述,本研究表明,PQ可诱导巨噬细胞分泌TGF-β,刺激肺成纤维细胞活化,活化后的成纤维细胞分泌大量细胞外基质;TGF-β受体抑制剂GW788388可拮抗肺成纤维细胞的活化,并减少TGF-β下游蛋白和纤维化相关蛋白的表达。由此推测,巨噬细胞可通过旁分泌TGF-β激活肺成纤维细胞TGF-β/Smads通路而促进肺纤维化。本研究可为PQ中毒致肺纤维化机制及PQ中毒治疗新靶点的发现提供科学依据。

