纤维基支架在骨和软骨组织再生中的应用
张 宇, 刘来俊, 焦勇杰, 李超婧, 王富军, 王 璐
(东华大学 a.纺织面料技术教育部重点实验室; b.产业用纺织品教育部工程研究中心; c.纺织学院, 上海 201620)
临床上在治疗因创伤、感染、肿瘤切除造成的骨缺损、骨质疏松和关节炎等骨科疾病时,通常采用自体骨、异体骨以及合成移植物进行骨组织重建[1]。自体移植尽管是移植手段中的黄金标准,但健康移植物数量有限,且供体部位易发生损伤;异体移植则存在感染疾病的风险;合成移植物能够很好地弥补前两者的应用缺陷,因此受到了广泛的关注[2-3]。随着组织工程的提出,骨修复研究取得了重大进展[4]。骨和软骨组织工程旨在通过生物材料、细胞和生长因子协同组合诱导新的功能性骨再生[5],其中的关键组件是为新生组织提供结构支持的支架。
骨组织和软骨组织分别是骨和软骨的结构主体,属于固态结缔组织,但两者在硬度上存在显著差异。骨基质包括无机成分(约65%,主要以羟基磷灰石结晶形式存在)和有机成分(约35%,主要为I型胶原纤维)[6];软骨基质则由以蛋白聚糖和水为主的无定形基质以及包埋在其中的胶原纤维构成[7]。组织工程纤维基支架通常指结构中包含微、纳米纤维的支架,与非纤维支架相比,其具有较高的比表面积、一定的力学强度和可控的结构,因此可以很好地模拟骨和软骨组织的细胞外基质(extracellular matrix,ECM),从而促进细胞的黏附和增殖[8-10]。支架的结构和生物学性能直接影响其植入后的修复效果,因此对支架成型方法的研究显得至关重要[11],不仅需要调控纤维基支架的宏观结构以适应缺损部位,还需要对其微观结构进行设计以增强蛋白质的吸附能力和细胞活性,从而改善成骨化、血管化以及软骨再生效果,推动其在临床治疗上的应用扩展。
1 纤维基支架的成型方法及应用
支架作为细胞增殖和ECM沉积的临时基质,高度参与组织的再生和功能重建过程,其刚度决定组织的最终形态,即骨组织或软骨组织[12]。理想的组织工程支架需要考虑材料的宏/微观结构、表面性质、孔隙率和孔径、界面相互作用、生物相容性、生物降解性和力学性能等要素[13],然后根据支架的综合性能需求选择合适的成型方法。目前纤维基支架的制备方法包括静电纺丝法、热致相分离法、自组装肽法和溶剂热法等,表1总结了骨和软骨组织工程中上述制备方法适用的材料及其优缺点。

表1 纤维基支架常用的成型方法
1.1 静电纺丝法
静电纺丝法的原理是利用聚合物熔体或溶液在高压电场作用下喷射、牵伸形成纳米纤维,基于该方法制备的纳米纤维支架已在组织工程各领域得到广泛应用[41]。静电纺支架具有与天然ECM相似的结构、较高的孔隙率和极大的比表面积,并且支架的厚度、力学性能、生物学性能可控,原料来源广泛[42]。通过改变纳米纤维的材料[43]、表面形貌[41]、核壳结构[44]、取向排列[45]等可以对支架性能进行调控[46-48],从而改善支架的骨修复效果。然而,静电纺支架通常难以控制孔隙率和孔隙的形状,而较小的孔径不利于细胞的长入,并且二维的纤维膜难以与三维的骨缺损部位相匹配,力学性能较差[29]。Cai等[49]利用EYA(electrospinning-based yarn assembly)技术制备出静电纺PLLA/PCL取向纳米纤维3D大孔支架,结果表明,该支架具有良好的机械强度和相互连接的微孔,可为细胞的向内生长和骨组织形成提供模板。Lee等[20]利用乳酸辅助制备静电纺PLLA/β-三磷酸钙(tricalcium phosphate,TCP)纤维支架,结果表明:单体乳酸包含带负电的羧基导致纺丝喷嘴强烈排斥,从而产生蓬松且高度多孔的纳米纤维网;与2D支架的无穿透性纤维膜相比,接种在蓬松纤网上的细胞在整个支架深度中均有所浸润,细胞活性明显更高。利用静电纺丝法制备3D支架的研究除了对纺丝设备进行改造外,应用更多的是将静电纺丝与其他方法结合,从而构建理想的三维多孔结构。
1.2 热致相分离法
Ma等[33]以四氢呋喃为溶剂通过热致相分离(thermally-induced phase separation, TIPS)法率先制备出仿天然ECM的PLLA纳米纤维支架,这种方法通常涉及聚合物溶解、相分离和凝胶化、溶剂萃取、冷冻、真空冷干等5个步骤。TIPS的原理如图1所示,在较高温度下将聚合物均匀溶解到溶剂中,然后降温冷却,冷却过程中均相溶液分离为富聚合物相和贫聚合物相,随后通过冷冻干燥或冷冻萃取程序除去溶剂得到纳米纤维支架[50]。纤维网络的形成主要取决于聚合物溶液的溶剂和凝胶温度,以这种方式制得的纤维直径从50 nm到500 nm不等,孔隙率高达98%[35]。Wang等[34]采用TIPS技术制备了具有大孔和纳米纤维结构的PLLA/PLGA/PCL支架,并将骨形态发生蛋白(bone morphogenetic protein,BMP)-2负载的PLGA微球掺入支架中,结果表明,含BMP-2的复合支架可在体内显著促进细胞向内生长,从而改善胶原蛋白的形成,刺激成骨细胞的成熟并加快缺损

(a) TIPS各相的示意图

(b) TIPS纳米纤维SEM图[51]
部位骨的形成。由传统TIPS技术制得的支架通常孔径较小,这不利于其在骨组织工程中的应用[30]。Chen等[52]使用浊点热致相分离法利用PLLA/1,4-二氧杂环己烷/H2O三元体系制备出具有孔径为300 μm以上大孔的PLLA支架,经丙酮处理并浸入壳聚糖溶液进行改性,在增加孔径的同时保持支架的纳米纤维结构。虽然TIPS制备方法简单,但是通常制得的支架力学性能较差,可结合其他处理技术通过控制支架的微观和宏观结构加以改善[29]。
1.3 自组装肽法
自组装肽(self-assembling peptide, SAP)是化学合成材料之一,表2列举了几种骨和软骨组织工程支架的自组装肽。自组装过程主要依赖非共价的相互作用(如氢键、范德华力、π —π键的相互作用等)形成有序的纳米结构(如纳米管、纳米球、纳米纤维等)[53],如图2所示。β-折叠结构的SAP纳米纤维有利于模拟天然ECM、构建三维网络结构的水凝胶支架[37]。基于自组装肽RAD16-I的水凝胶已广泛用于软骨细胞培养的体外组织修复,但其较低的pH值(3~4)对细胞和宿主组织而言存在潜在风险。自组装肽SPG-178在中性pH下即可形成稳定的水凝胶(SPG-178-Gel),可避免细胞坏死,且无需预中和[54]。Tsukamoto等[54]使用SPG-178-Gel和α修饰的Eagle’s培养基的混合物填充大鼠颅骨缺损部位,显著诱导了牙髓干细胞的增殖和成骨分化。

表2 骨和软骨组织工程自组装肽

(a) 肽自组装示意图 (b) SAP纳米纤维SEM图
Takeuchi等[55]研究SAP纳米纤维水凝胶对大鼠牙周缺损愈合的影响,发现质量分数为2.5%的RADA16表现出直径为5~200 nm的纳米纤维结构,并通过诱导细胞募集和血管生成促进牙周缺损的愈合。这种SAP已被命名为PuraMatrix进行商业出售[37]。
SAP纳米纤维支架具有良好的生物相容性、细胞黏附性和生物活性[59],可通过功能基序列修饰或分子信号受控释放来模拟天然ECM,并且细胞易于在自组装过程中包裹在基质内,可避免细胞渗透,再则材料胶凝速率和降解速率可控[60]。Mujeeb等[61]设计一种FEFEFKFK短肽(F=苯丙氨酸,E=谷氨酸,K=赖氨酸),在溶液中自组装形成β-折叠的纳米纤维,并在临界凝胶浓度以上缠结形成自支撑水凝胶,结果表明:这种新型肽支架具有稳定的凝胶特性,能够封装软骨细胞;在不使用生长因子的情况下,可于体外保持长达35 d的细胞活性;3D培养可观察到细胞形态的保留以及富含II型胶原的ECM沉积。Eren等[62]设计一种由疏水尾基和亲水头基组成的两亲性肽(peptide amphiphile,PA)分子,通过CaCl2电荷中和触发PAs自组装从而得到矿化的纳米纤维多肽凝胶,促进了羟基磷灰石晶体的形成,且相比非矿化时刚度显著增强,表明支架矿化有利于增强SAP纳米纤维系统的成骨分化功能。然而,SAP纤维直径通常较小,例如离子型互补肽形成的支架的纳米纤维直径为10~20 nm,孔径为5~200 nm[60],这限制了骨组织的向内生长以及新生血管的形成[29]。此外,支架的抗剪切力、抗压力、韧性等力学性能相对不足[63],用这种生物材料支架来修复承重软骨的缺陷具有一定难度,可通过与高分子聚合物、无机陶瓷等材料复合以及结合生物分子实现结构和功能的多样性[64],从而在提高植入物生物活性的同时改善骨和软骨缺损部位的力学性能[65-66]。
1.4 溶剂热法
羟基磷灰石(hydroxyapatite,HA)是骨组织的主要无机成分,其化学组成为Ca10(OH)2(PO4)6[67]。人工合成的HA纳米颗粒对硬组织有较强的亲和力,且生物相容性和骨传导性较好[68],但其封闭的结构和较低的孔隙连通率致使骨诱导缓慢[69-70],低断裂韧性和抗弯强度使其仅限于非承重支架的应用[71]。而HA纳米线不仅可以改善这一缺陷,还可以模拟天然骨ECM的结构和成分[39]。溶剂热法合成HA纳米线最早用于制造无机纸张,随后在生物医学领域得到广泛探索[40, 67]。该方法是在单羟基醇中以油酸钙为前体制备直径在纳米级、长度在微米级的超长无机纳米纤维,反应原理[72]如式(1)~(4)所示。

(1)

(2)
(3)

(4)

捷太格特(JTEKT)是2006年由光洋精工(Koyo)和丰田工机(TOYODA)合并成立的一家跨国企业。作为“汽车零部件”、“轴承”、“机床”的全球综合系统供应商,捷太格特通过为客户提供世界顶级的No.1产品和Only One技术,为社会的发展持续做出贡献。捷太格特在华共设立了 25 家企业,在华员工人 数近 5 000 人。

(a) HANW@MS核壳多孔结构的形成示意图

(b) HANWs

(c) HANW@SiO2

(d) HANW@MS

(e) CS支架

(f) HANWs/CS支架

(g)HANW@MS/CS支架
由图3可知,该复合支架表现出镁和硅元素的可持续释放,并促进大鼠骨髓间充质干细胞(rat bone marrow mesenchymal stem cells, rBMSCs)的黏附和生长,与纯CS和HANWs/CS支架相比,显著诱导rBMSCs的成骨分化相关基因和血管内皮生长因子(vascular endothelial growth factor, VEGF)基因的表达。尽管溶剂热法制备HA纳米线有诸多优点,但合成过程难以精确控制,使得纤维的直径无法像静电纺纳米纤维一样均匀一致,因此稳定合成高柔性且均匀超长的HA纳米线仍然是一个很大的挑战。
1.5 其他方法
对于3D组织工程再生而言,较小的孔径和致密的结构将极大地限制细胞的浸润,单一成型方法往往难以满足支架的复杂需求。因此,对支架的研究趋向于将上述制备方法与其他技术相结合,从而改进支架的结构与性能,以形成类似天然ECM复杂性和层次性的组织。表3列举了多种方法联合制备骨和软骨组织工程支架的实例。

表3 联合法制备骨和软骨组织工程支架
2 纤维基支架修复效果面临的挑战
图4为典型长骨和关节软骨的结构示意图。骨和软骨因结构和生理功能不同,对组织工程支架的需求也不同。适当的血管形成对于骨骼再生和重塑必不可少,股骨头缺血性坏死和骨质疏松等骨骼疾病都与血管供应受损直接相关[88]。因此,临床中对临界尺寸骨缺损进行修复时,组织工程植入物内的血液供应尤其重要。骨关节炎等关节软骨缺损是临床上常见的软骨类疾病[89],与硬骨相比,关节软骨尽管无血管形成,且组织相对简单,但由于ECM中软骨细胞的非增殖特性和天然软骨杰出的力学性能(高压缩模量和弹性)[90],功能性软骨组织的重建再生仍面临巨大的挑战。
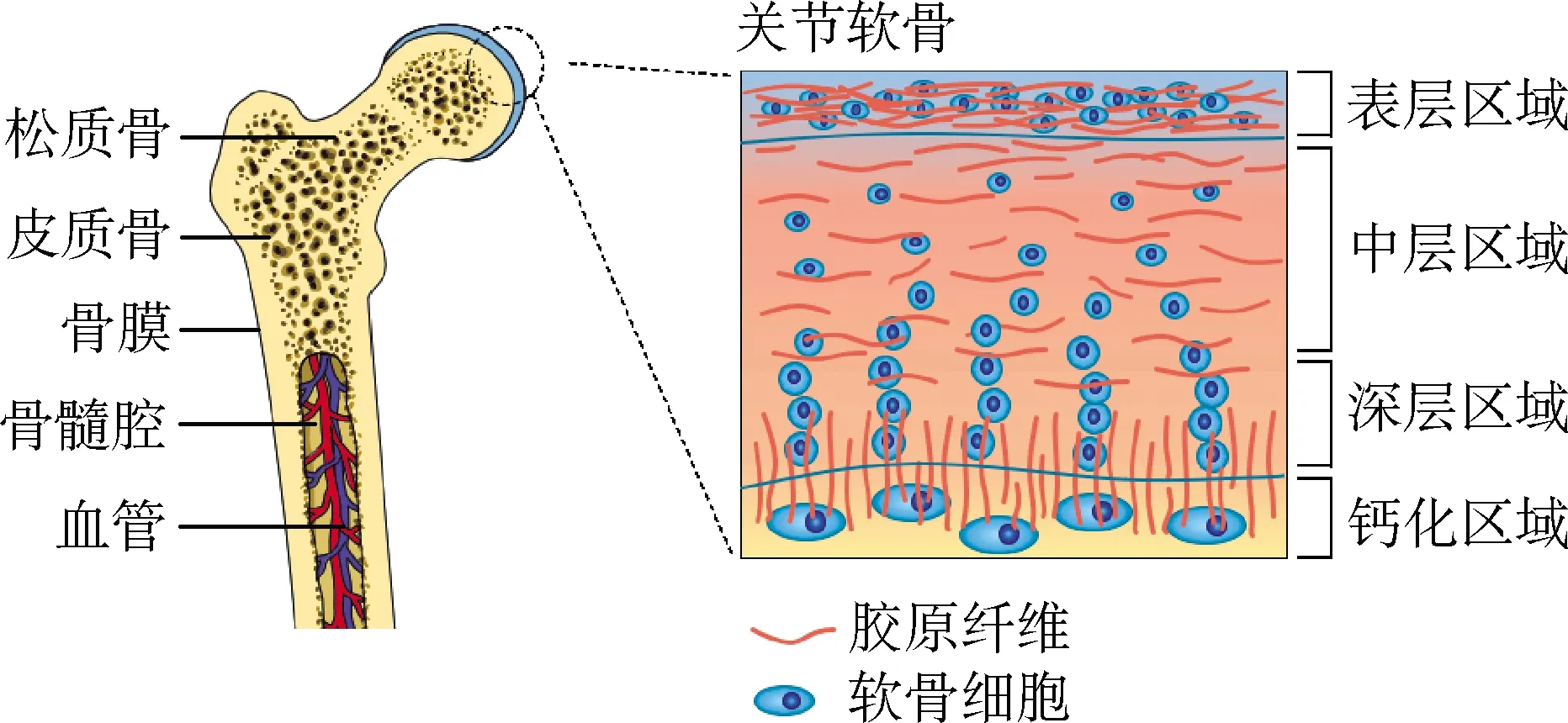
图4 长骨及关节软骨组织结构示意图Fig.4 Schematic diagram of histologic structure of long bone and articular cartilage
骨愈合过程包括炎症、修复和重塑等3个重叠过程[91],克服植入物引起的炎症是组织工程支架临床应用的另一障碍。组织工程植入物的炎症反应主要由巨噬细胞进行调节,研究表明,纤维直径以及支架的表面形貌会影响巨噬细胞的活化和细胞因子分泌,纳米纤维的表面可以更好地降低炎症反应[92]。然而在骨组织工程领域,关于三维多孔的纤维支架结构对炎症和免疫反应调节相关的研究较少,本节主要介绍硬骨血管化和软骨再生中支架设计的关键。
2.1 血管化
骨是高度血管化的结缔组织,血管网络在为细胞提供氧气、营养物质以及清除代谢废物等方面起着至关重要的作用[93]。骨移植物通常依赖于体内植入后的血管化,然而许多支架不具有诱导血管生成的能力,体积较大的多孔支架还可能面临血管难以渗透到中央区域的问题[94]。不充分的血管网络会阻碍氧气和营养物质的输送,甚至导致细胞分化失控、凋亡或新生组织的坏死,不利于缺损部位的骨
支架的结构设计是形成血管网络的关键要素。骨骼再生和血管形成的最佳孔径范围为200~500 μm[11],孔径、孔隙率以及互连性的提高将会增加血管密度和浸润深度[97]。与单一尺度的孔径相比,兼具大孔、介孔和微孔的多级孔径结构更有利于促进血管生成[98-99]。数百微米的大孔可提升支架的结构稳定性,并支持MSCs成骨分化、ECM沉积和组织形成,几十微米或更小的介孔将促进营养物质的扩散和血管化的形成,而微米或以下尺寸的小孔则会影响基因表达等细胞行为[22]。Santos等[100]研究表明,PCL微/纳米纤维复合支架体系引发并指导了内皮细胞(endothelial cells,ECs)的三维分布,与没有纳米纤维的支架相比,使用纳米纤维作为桥梁时,微米纤维之间的人微血管和大血管ECs表现出更加伸长的表型。尽管较大的孔径、高度连通的孔隙以及微/纳米尺度的纤维形貌等支架结构有利于骨质和血管再生,但这些物理属性也在一定程度上牺牲了支架的结构完整性和力学性能,因此,在设计允许宿主细胞入侵并在植入后有效形成血管的骨组织工程支架时,需要在整个环节中分析微结构与力学性能的最佳组合[101]。
血管再生理想的支架应不仅能提供适当的物理微环境来模仿目标组织的结构和力学性能,还可以提供生长因子或其他生物活性分子来指导细胞行为。表4列举了骨缺损治疗中常用的血管生长因子。采用不同降解行为的聚合物或掺入微球将生长因子固定在支架中,可以实现生长因子局部和持续递送的目的[97]。此外,利用同轴静电纺丝技术制备的核壳结构纳米纤维为控制生长因子局部缓释提供了另一方案[44]。骨再生是一个高度复杂的过程,仅从支架材料中释放单一生长因子可能不足以刺激骨骼和血管再生[102]。Kuttappan等[103]比较生长因子单一释放系统(BMP-2/VEGF/FGF-2)和双重系统(VEGF+BMP-2/FGF-2+BMP-2)负载的纳米纤维支架促进血管和骨再生的能力,结果表明,双重系统形成的综合效果更明显。Wang等[104]通过多源多功率静电纺丝构建掺入VEGF、BMP-2和磷酸钙纳米粒子的3组分支架,通过不同降解速率的纤维成分实现VEGF快速释放和BMP-2缓慢稳定释放,不仅可以从结构上模仿天然骨组织,还可以模拟自然骨修复过程中不同生长因子的出现顺序。

表4 骨组织工程常用的血管生长因子
共培养技术已广泛用于血管化骨组织工程。成骨细胞与ECs共培养可刺激成骨细胞分化并形成微毛细血管样结构[111]。研究[112]表明,脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)与MSCs以1∶1的比例共培养可获得成骨分化和血管生成的最佳组合。支架微结构、刚度等均可影响细胞间的通信,Piard等[113]对3D打印微米纤维之间的距离进行调节,结果发现,HUVECs和MSCs间距小于200 μm时呈现出更多的血管和骨再生数量。除上述方法外,载有细胞的体外预血管化支架也可在一定程度上改善早期血管化不足的问题[114]。细胞来源包括骨髓基质细胞、脂肪干细胞(adipose-derived stem cells, ADSCs)和来源于骨膜的祖细胞等[1]。Debski等[115]通过熔融沉积建模制备了三维圆柱形PCL支架,将从大鼠脂肪沉积物中分离出的ADSCs接种在支架中,并将腹壁下的血管放置于流通式椎弓根系统(一种新型预血管化方法)支架内部,结果表明,支架接种ADSCs以及这种预血管化方法对于血管化具有协同作用,血管密度相比对照组增加了10倍,显著促进体内植入后的血管生成。
对于临界尺寸骨缺损的治疗,移植初期功能性血管网络的生成显得至关重要。炎症、血管化和骨再生在骨愈合过程中重叠存在[116],在早期愈合阶段,全身性炎症和局部生理性炎症相互作用,并且局部炎症受到愈合区中生物力学环境的影响[91],因此还需对炎症反应和骨再生的生理过程进行充分且深入研究,以结合现有技术构建符合预期要求的生物支架。
2.2 软骨再生
软骨由于无血管、软骨细胞不足以及缺乏营养供应,需要通过手术方法获得令人满意的再生效果[117]。尽管目前临床上倾向于使用非支架技术治疗软骨缺损,但基于支架的方法仍具有一定的发展潜力,例如:便于填充软骨缺损;较少的供体部位并发症;增加移植物的稳定性,缩短术后恢复时间;由于软骨细胞是在3D环境中培养,因此不易去分化,产生的类透明质软骨更多;植入前的体外培养可能有助于维持支架的修复[118]。
目前,软骨组织工程支架常用的结构有3种:水凝胶、海绵和纤维网络[119]。纳米纤维支架可在成分和结构上模仿天然软骨ECM的物理和生物学特征,因此对于关节软骨修复具有重要意义[120]。Ren等[121]利用聚多巴胺将硫酸软骨素涂覆在电纺取向PLLA多孔纤维表面,显著增加软骨细胞的增殖附着量以及rBMSCs的软骨基因表达。3D基质可为体外细胞培养提供稳定的支架,指导干细胞分化。HYAFF-11是一种透明质酸三维非织造支架[122],具有良好的生物相容性[123],支持软骨细胞的增长[124]。HYAFF-11支架和自体软骨细胞组成的Hyalograft-C在临床上已经用于研究全层软骨缺损的修复,其在治疗关节软骨病变上被证明安全有效[125]。由水凝胶基质和可生物降解的聚合物纤维网络组成的复合材料在软骨组织工程中的应用受到广泛关注,其中,水凝胶基质为细胞发挥功能提供合适的微环境,高模量纤维主要负责提供结构完整性和强度[126]。Bas等[127]以星形聚乙二醇/肝素水凝胶为软骨基质,以熔融静电纺丝打印技术制备的PCL纤维网络为水凝胶的增强结构,制备的复合支架表现出与天然组织相似的力学各向异性、非线性和黏弹性,并为体外软骨细胞培养和软骨组织再生提供了合适的微环境。
关节软骨由于在细胞分布和胶原纤维结构上具有区域差异,因此,其独特性除体现在优异的黏弹性上,还体现在生物学和力学特性的梯度分布上[90]。随着软骨支架的发展,支架由单相发展至双相和梯度结构[128-129],从而可更好地模拟骨、软骨过渡区域。研究[130]表明,双相合成支架治疗软骨损伤后的活性水平和软骨敏感磁共振成像表现优于传统微骨折技术。Liu等[131]开发了一种特异性释放干细胞分化诱导剂的仿生双相骨软骨支架(BBOS),由软骨再生层和成骨再生层组成,可促进干细胞在特定层分化,体内试验证实其具有足够的固定强度,植入2个月期间保持双相的稳定结合。Khoo等[132]采用顺序静电纺丝技术制备出具有纤维密度梯度的三层明胶纳米纤维支架,支架的力学性能随纤维直径、纤维密度和支架孔径等微观结构的差异而变化,相比均匀材料,表现出更好的断裂行为,同时可以防止组织界面上的力学性能不匹配和不连续,然而明胶支架的交联和水化程度将影响支架最终的力学性能。Wang等[25]采用溶胶-凝胶静电纺丝制备出具有优异柔韧性的SiO2纳米纤维,与壳聚糖复合从而得到3D多孔的形状记忆支架(SiO2NF/CS),通过控制SiO2的质量分数进一步获得刚度梯度支架。支架在水环境中表现出超弹性,多次循环载荷后仍具有较高的形状恢复率和抗疲劳性,刚度梯度使得MSCs在空间上分化为软骨细胞和成骨细胞。
目前纤维基软骨支架在临床上应用较少,其设计趋势在于模拟关节软骨生理结构及其优异的力学性能,从而开发具有区域特异性的多相支架。为提高纤维支架促进关节软骨再生的效率,可以将蛋白质或短肽等仿生信号固定在生物材料表面,从而更好地实现细胞黏附并促进软骨分化[133]。此外,对于骨关节炎引起的骨缺损治疗,炎症环境会加快支架的降解速度[134],因此,以生物材料为基础调节免疫反应、提高材料的稳定性,可为促进软骨再生提供一个新的研究思路。
3 结 语
骨和软骨组织工程中用于组织再生的关键是模拟ECM的支架,理想的支架应具备与修复部位相似的力学性能、良好的生物相容性和与组织再生相匹配的降解速率等特性,以满足宿主组织对细胞黏附、增殖、分化和ECM形成的要求。在众多支架中,纤维基支架因其独特的结构特征引起了广泛关注,其常用制备方法有静电纺丝法、热致相分离法、自组装肽法和溶剂热合成法。随着生物医学工程的目标越来越复杂,单一制备方法在力学性能、孔径尺寸、孔隙率及孔隙连通率等方面仍存在问题,因此结合多种成型方法的优势制备具有多级孔径结构的仿生复合纤维支架具有重要意义。
在临界尺寸骨缺损治疗中,生物材料的设计越来越关注骨组织和血管网络同步发展,早期血管化是临床上面临的一大挑战。兼具大孔、微孔和介孔的多尺度结构纤维支架更有利于促进血管生成,然而仅改变支架结构不能彻底解决这一问题,因此需要调节支架结构、负载血管生长因子、使用共培养系统和外预血管化等方法来实现血管和骨骼的同步再生。在关节软骨缺损治疗中,纤维支架植入物同样具有很大的发展潜力。控制纤维方向和密度梯度可以为材料带来理想的生理结构和力学性能。相比单相支架,多相或梯度的纳米纤维支架还可以更好地模拟关节软骨过渡态结构,使组织能够承受关节负荷并形成稳定的骨骼系统。
尽管基于纤维的三维多孔支架在骨和软骨组织工程应用中展现出了巨大的潜力,但仍有许多问题尚待解决。骨和软骨缺损的愈合是由多种类型细胞和细胞因子调节控制的复杂过程,仿生天然组织的复杂组成和空间分布,在材料、组成、排列、孔径等方面进行功能分级设计,有利于提高细胞的长入以及组织的再生。纤维基支架的体外应用已得到了广泛的研究,但对于体内应用而言,还需要对其组成和结构作进一步优化。此外,炎症在骨和软骨缺损的修复过程中具有不可忽视的作用,然而目前关于支架结构对炎症反应影响的相关研究报道较少且不成体系,因此对纤维基支架的炎症反应和免疫调节等方面进行研究将进一步深化其在骨和软骨组织再生中的应用。

