MALDI-TOF MS在人工关节置换术后病原菌快速鉴定中的价值
丁毅伟,韩志海
(解放军总医院第六医学中心呼吸与危重症医学科,北京 100084)
随着医学技术的进步,越来越多的患者选择人工关节置换,感染是手术后最严重的并发症之一[1],及时进行抗感染治疗是改善患者预后的关键,快速、准确的病原菌鉴定意义重大。但是,关节液样本的培养需要2~3 d,少数苛养菌和真菌的培养时间更长,甚至需要14 d;将关节液放入血培养瓶中进行增菌培养也需要至少8~12 h。采用基质辅助激光解吸电离飞行时间质谱(matrix-assisted laser desorption/ionization time-of-flight mass spectrometry,MALDI-TOF MS)技术可快速鉴定报阳血培养样本中的病原菌,较传代培养之后对琼脂上的单个菌落进行常规MALDI-TOF MS鉴定,鉴定时间可从平均24.48 h减少到1 h内[2-3]。常规MALDI-TOF MS最耗时的过程是在鉴定之前对样本进行传代培养。HB&L微生物培养系统(简称HB&L系统,意大利Alifax公司)最初被用于快速筛查尿液样本中的病原菌,能够快速增菌培养,采用独特的光散射技术实时监测麦氏浓度,提示细菌生长。有研究结果表明,HB&L系统可以用于报阳血培养样本的快速培养,联合MALDI-TOF MS,鉴定准确率和时效性均较高,已被应用于血流感染的快速诊断[4]。但将关节液样本置于血培养瓶中,阳性报警后,经HB&L系统前处理后直接采用MALDI-TOF MS鉴定病原菌的研究尚不多见。本研究采用MALDI-TOF MS对经HB&L系统前处理后的关节液样本进行直接鉴定,并与常规MALDI-TOF MS鉴定、分离胶富集细菌后直接MALDI-TOF MS鉴定、平板培养鉴定结果进行比较,评价直接MALDI-TOF MS与HB&L系统联用在快速鉴定血培养瓶报阳关节液样本病原菌中的价值。
1 材料和方法
1.1 样本来源
采用无菌方法采集解放军总医院第六医学中心人工关节置换术后疑似感染患者的关节液样本104例,分别注入需氧血培养瓶和厌氧血培养瓶各10 mL,另外3 mL关节液及时送至检验科行常规培养。104例关节液样本中,99例为单一细菌感染,5例为混合菌感染。
1.2 仪器与试剂
MALDI-TOF MS仪及配套α-氰基-4-羟基肉桂酸基质液(德国Bruker公司);甲酸、无水乙醇、乙腈(美国Sigma-Aldrich公司);2 mL血培养瓶(意大利Alifax公司);BacT/A lert 3D自动血液培养系统和需氧、厌氧血培养瓶(美国贝克曼库尔特公司);需氧血琼脂平板、麦康凯琼脂平板、巧克力琼脂平板(郑州安图公司);Insepack ST740CG血清分离胶促凝管(广州阳普公司)。
1.3 方法
1.3.1 常规MALDI-TOF MS鉴定 将已注入关节液的需氧和厌氧血培养瓶置于BacT/A lert 3D自动血液培养系统,将阳性报警关节液分别接种于血琼脂平板、麦康凯琼脂平板和巧克力琼脂平板进行传代培养,5% CO2环境下35 ℃孵育18~24 h,挑取单个菌落均匀涂布于靶板上,自然干燥后加入1 μL甲酸,干燥后加基质液1 μL,采用MALDI-TOF MS进行细菌鉴定。
1.3.2 HB&L系统处理后直接MALDI-TOF MS鉴定 用无菌注射器将需氧和厌氧血培养瓶中的阳性菌液抽出2 mL,吸取10 μL转种于HB&L血培养瓶中继代培养1~3 h,当达到1.5麦氏浓度后,从培养液中取1 mL阳性菌液置于1.5 mL的Eppondorf管中,11 346×g离心2 min,重复操作2次,取1 μL沉淀均匀涂布于MALDI-TOF MS仪靶板,自然干燥后加1 μL甲酸,干燥后加基质液1 μL,采用MALDI-TOF MS进行细菌鉴定。
1.3.3 分离胶富集细菌后直接MALDI-TOF MS鉴定 从报阳血培养瓶中抽取3 mL菌液至Insepack ST740CG血清分离胶促凝管,600×g离心10 min,弃上清液,用无菌棉签挑取富集在分离胶表面的细菌沉淀物,加入1 000 μL去离子水,混匀后11 346×g离心2 min,重复操作2次,弃上清,加入500 μL无水乙醇混匀,11 346×g离心2 min,弃上清,室温环境开盖放置2 min,取1 μL沉淀均匀涂布于MALDI-TOF MS仪靶板,晾干后加1 μL甲酸,干燥后加基质液1 μL,采用MALDI-TOF MS进行细菌鉴定。
1.3.4 平板培养 将无菌注射器收集的3 mL关节液充分混合后,分别滴加于血琼脂平板、麦康凯琼脂平板和巧克力琼脂平板,5% CO2环境35 ℃孵育18~24 h,挑取单个菌落均匀涂布于MALDI-TOFMS仪靶板,自然干燥后加1 μL甲酸,干燥后加基质液1 μL,采用MALDI-TOF MS进行细菌鉴定。
1.4 判断标准
根据MALDI-TOF MS仪说明书要求:>2.000分,可鉴定到种水平;1.700~1.999分,可鉴定到属水平;≤1.700分为结果不可靠;如≤1.700分,但鉴定结果前3位均属于同一种菌,也认为结果正确,否则为结果不可靠。
2 结果
2.1 4种方法鉴定结果比较
99例单一细菌感染样本中,采用HB&L系统处理后直接MALDI-TOF MS鉴定、分离胶富集细菌后直接MALDI-TOF MS鉴定和常规MALDITOF MS鉴定均有15例阴性,常规培养有39例阴性。血培养瓶增菌培养阳性样本中,2种直接MALDI-TOF MS鉴定和常规MALDI-TOF MS鉴定检出率均为84.8%(84/99),平板培养检出率仅为60.6%(60/99)。
HB&L系统处理后直接MALDI-TOF MS鉴定革兰阳性菌、革兰阴性菌的检出率分别为86.9%(40/46)、91.9%(34/37)。分离胶富集细菌后直接MALDI-TOF MS鉴定革兰阳性菌、革兰阴性菌的检出率分别为78.3%(36/46)、83.8%(31/37)。2种直接MALDI-TOF MS鉴定方法检出的革兰阳性菌以金黄色葡萄球菌和表皮葡萄球菌为主,革兰阴性菌以大肠埃希菌为主,有84株病原菌被鉴定至种水平,仅1株白念珠菌被鉴定至属水平。HB&L系统处理后直接MALDI-TOF MS鉴定和分离胶富集细菌后直接MALDI-TOF MS鉴定分别有9例和16例样本培养出细菌,但鉴定失败;常规MALDI-TOF MS鉴定均鉴定出细菌。平板培养检出率低于其他3种方法,革兰阳性菌、革兰阴性菌检出率分别为70.1%(35/46)、67.6%(25/37)。见表1。
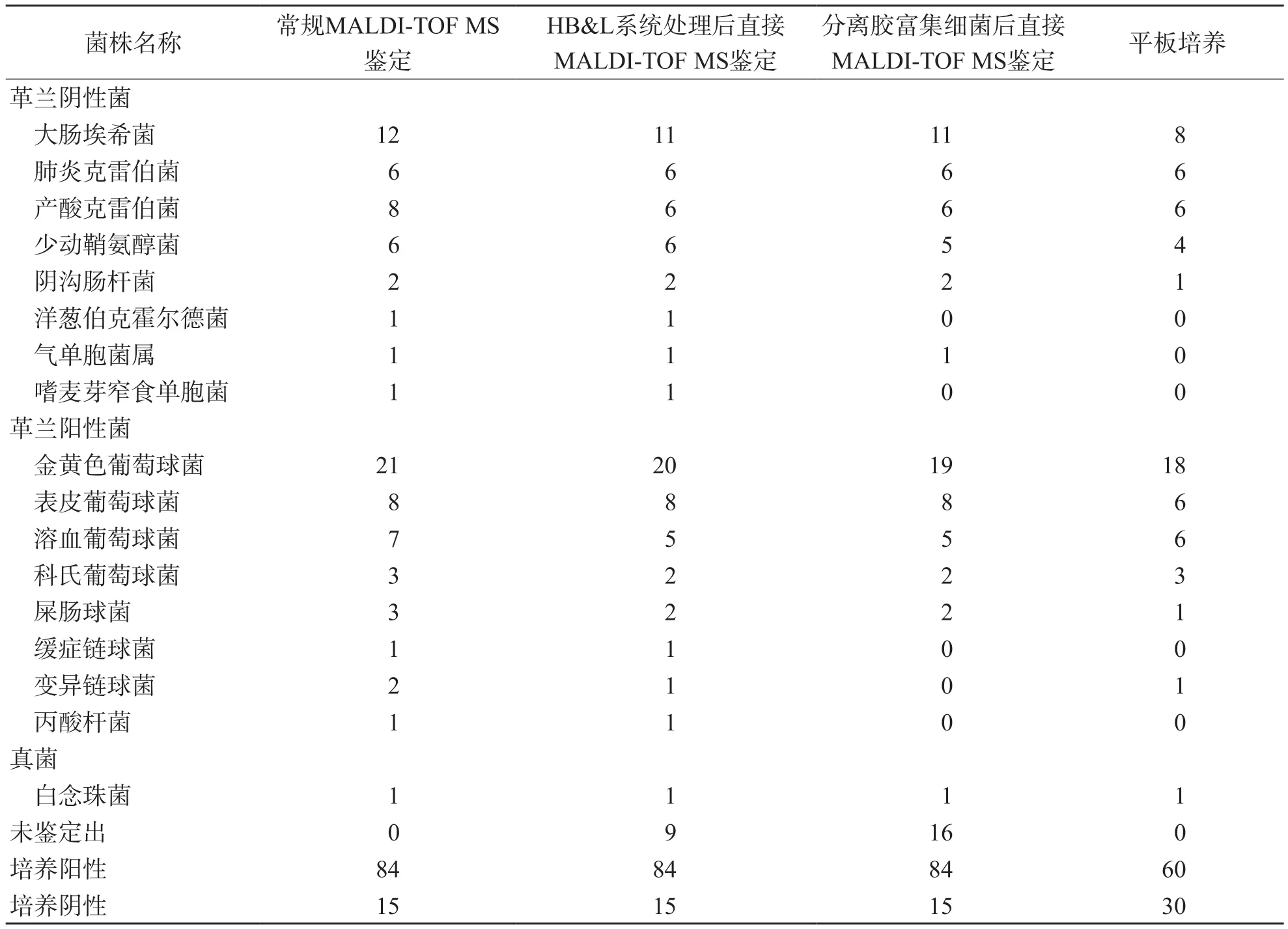
表1 4种方法鉴定结果 株
2.2 4种方法病原菌鉴定不一致结果
2.2.1 HB&L系统处理后直接MALDI-TOF MS鉴定和常规MALDI-TOF MS鉴定 有9例单数菌样本HB&L系统处理后直接MALDI-TOF MS鉴定失败,分别是2株产酸克雷伯菌、2株溶血葡萄球菌,大肠埃希菌、金黄色葡萄球菌、科氏葡萄球菌、屎肠球菌、变异链球菌各1株;常规MALDI-TOF MS鉴定全部检出。有5例混合菌样本HB&L系统处理后直接MALDI-TOF MS鉴定失败,分别为1例产酸克雷伯菌、屎肠球菌、表皮葡萄球菌样本,1例溶血葡萄球菌、表皮葡萄球菌样本,1例溶血葡萄球菌、屎肠球菌样本,1例科氏葡萄球菌、表皮葡萄球菌样本;1例变异链球菌、表皮葡萄球菌样本;常规MALDI-TOF MS鉴定全部检出。见表2。

表2 4种方法病原菌鉴定不一致结果
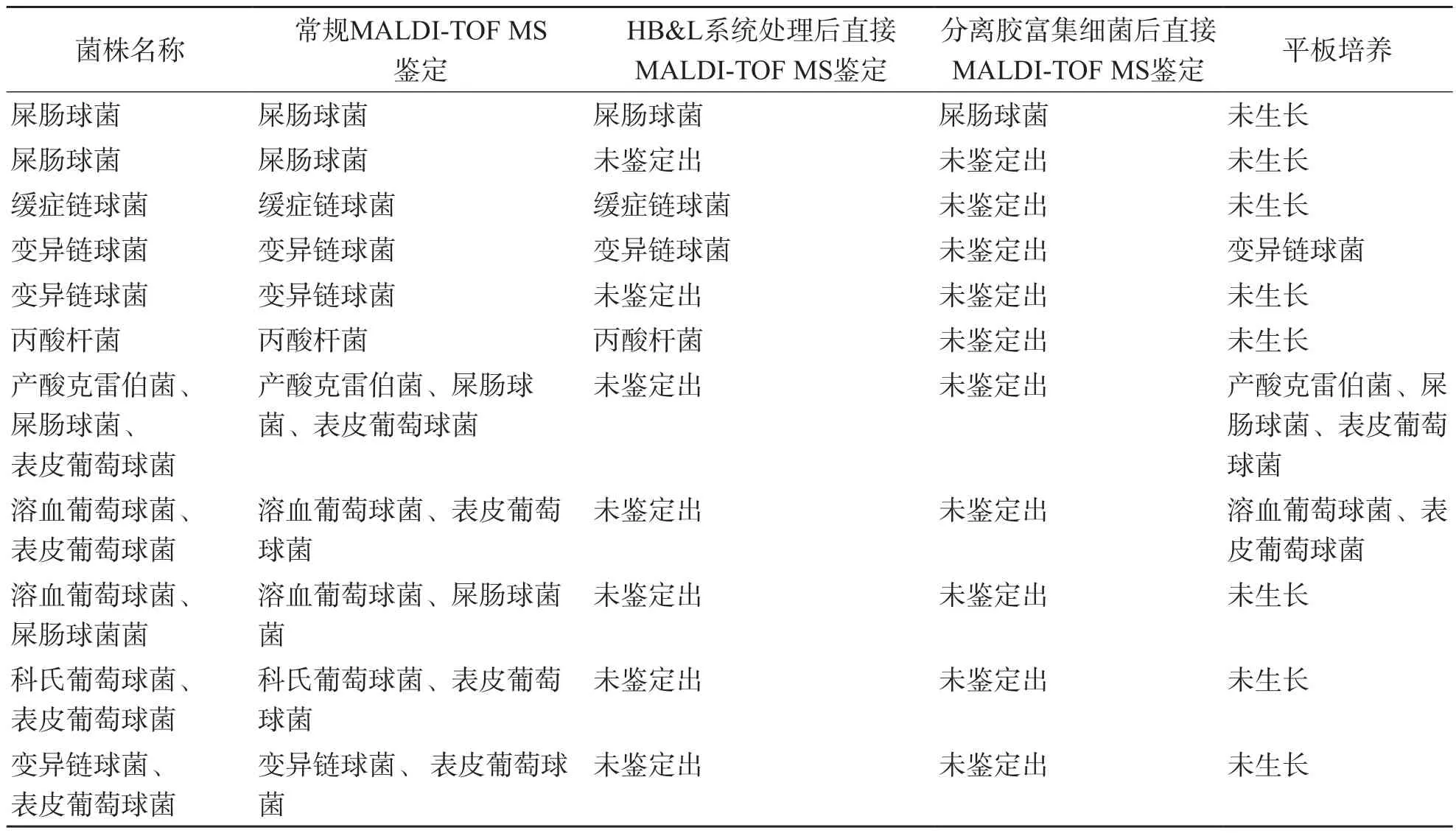
续表2
2.2.2 HB&L系统处理后直接MALDI-TOF MS鉴定和平板培养 有9例单数菌样本HB&L系统处理后直接MALDI-TOF MS鉴定失败。这9例样本中,平板培养鉴定出溶血葡萄球菌和科氏葡萄球菌各1株,其他7例样本未见菌株生长。2例混合菌样本平板培养均鉴定出病原菌,1例为产酸克雷伯菌、屎肠球菌和表皮葡萄球菌混合菌样本,1例为溶血葡萄球菌和表皮葡萄球菌混合菌样本;这2例混合菌样本HB&L系统处理后直接MALDI-TOF MS鉴定均未检出病原菌。见表2。
2.2.3 HB&L系统处理后直接MALDI-TOF MS鉴定和分离胶富集细菌后直接MALDI-TOF MS鉴定 HB&L系统处理后直接MALDI-TOF MS鉴定检出少动鞘氨醇菌、洋葱伯克霍尔德菌、嗜麦芽窄食单胞菌、金黄色葡萄球菌、缓症链球菌、变异链球菌、丙酸杆菌各1株,但分离胶富集细菌后直接MALDI-TOF MS鉴定未检出病原菌。5例混合菌样本2种直接MALDI-TOF MS鉴定均未检出病原菌。见表2。
2.2.4 常规MALDI-TOF MS鉴定和平板培养 2种方法对2株葡萄球菌的鉴定结果一致,分别是溶血葡萄球菌和科氏葡萄球菌。常规MALDITOF MS鉴定生长但平板培养未生长的菌株主要为产酸克雷伯菌、屎肠球菌、表皮葡萄球菌、溶血葡萄球菌、科氏葡萄球菌和变异链球菌。5例混合菌样本中,有2例2种方法鉴定结果一致,其他3例平板培养未见菌落生长。见表2。
2.3 4种方法检出时间比较
常规MALDI-TOF MS鉴定、平板培养、分离胶富集细菌后直接MALDI-TOFMS鉴定、HB&L系统处理后直接MALDI-TOF MS鉴定4种方法检出时间分别为45.2 、54.3、9.4、10.2 h。HB&L系统处理后直接MALDI-TOF MS鉴定均在14 h内检出微生物,其中11例样本7 h内即检出微生物,见表3。
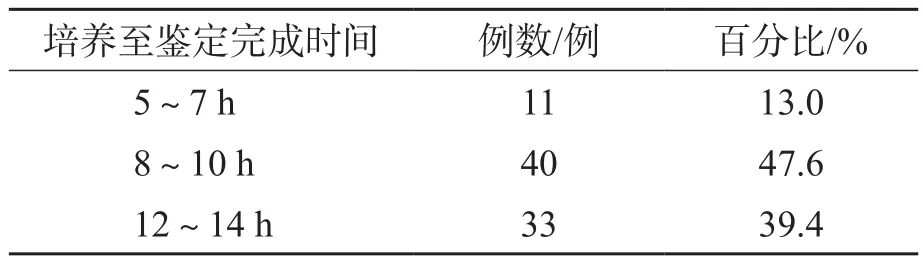
表3 不同时间HB&L系统处理后直接MALDI-TOF MS鉴定结果
3 讨论
本研究结果表明,HB&L系统处理后直接MALDI-TOF MS可鉴定出血培养瓶报阳关节液样本中与常规转种法鉴定结果相似的微生物,且耗时大大缩短。该方法病原菌鉴定率低于常规MALDI-TOF MS,有9例未鉴定出微生物,高于分离胶富集细菌后直接MALDI-TOF MS法和平板培养法,且鉴定时间大大缩短,对于关节置换术后人工关节感染患者的抗感染治疗有积极意义,有利于改善患者预后。
本研究中,HB&L系统处理后直接MALDITOF MS在关节液阳性血液培养物中鉴定出91.9%(34/37)的革兰阴性菌和86.9%(40/46)的革兰阳性菌,与之前报道的血流感染直接MALDI-TOF MS鉴定结果一致,即直接MALDITOF MS鉴定对革兰阴性菌具有较高的鉴定率,对于革兰阳性菌的鉴定率次之[5-8],原因可能是革兰阳性菌的细胞壁更坚固,降低了蛋白质提取率,使MALDI-TOF MS鉴定受到影响[9-10]。HB&L系统处理后直接MALDI-TOF MS鉴定对10.7%(9/84)的关节液阳性血液培养物鉴定失败(其中50%是革兰阳性球菌),但比分离胶富集细菌后直接MALDI-TOF MS鉴定失败率[19.0%(16/84)]低,而常规MALDI-TOF MS鉴定成功鉴定出培养物中的所有病原菌。本研究中,常规MALDI-TOF MS鉴定出5例多种菌混合感染样本,但是2种直接MALDI-TOF MS均未鉴定出,原因可能是MALDI-TOF MS鉴定混合菌样本时,会产生异常或多样的蛋白质谱,使MALDI-TOF MS无法从其数据库中识别出每个微生物。
用血培养瓶对人工关节置换术后关节液进行培养,通常需要3~5 d才能鉴定出病原菌[11-12],无法满足临床需求。如果可以较早地鉴定出病原菌,可以更精确地进行有针对性的经验治疗,以减少耐药菌株的产生。采用MALDI-TOF MS直接鉴定关节液阳性血液培养物具有可快速鉴定病原菌的优势。有研究结果表明,直接采用MALDI-TOF MS鉴定阳性血液培养物需7.1 h,比常规方法的48.1 h明显缩短[13]。在本研究中,直接MALDI-TOF MS关节液阳性血液培养物病原菌鉴定时间为5~14 h,明显低于常规MALDI-TOF MS鉴定的45.2 h和常规培养的54.3 h。
综上所述,直接MALDI-TOF MS可快速鉴定人工关节置换术后感染患者关节液样本中的单个病原菌,联合HB&L系统,能够在3 h之内提供MALDI-TOF MS所需的菌液沉淀物,大大缩短了鉴定时间,一旦直接MALDI-TOF MS鉴定出病原菌,临床就可在1 d内有针对性地进行经验治疗[8]。
本研究不足之处在于仅收集到1株真菌,虽然3种方法均培养出真菌,但采用直接MALDITOF MS鉴定对真菌的检出率较低,与相关文献报道一致[14],后续将扩大样本量进一步分析。另外,3种方法均无法进行抗菌药物敏感性分析,若能进一步提供快速的药物敏感性试验报告,将更加有利于指导临床用药[15-16]。

