红细胞裂解液在白细胞计数定量检测方法线性验证中的应用
俞 钱
(南京医科大学附属苏州市立医院,江苏 苏州 215002)
《医院检验科建设管理规范》[1],第4版《全国临床检验操作规程》[2],《CNAS—CL02:2012 医学实验室质量和能力认可准则(ISO 15189:2012,IDT)》[3]等均要求实验室在设备安装使用前和使用中验证其能达到必要的性能。线性是整个检测系统对应于系列分析物浓度与仪器最终输出的信号间是否比例恒定的性能,是方法学性能评价的重要指标之一。本研究根据美国国家临床实验室标准委员会(the National Committee for Clinical Laboratory Standards,NCCLS)定量测量方法的线性评价文件——EP6-A[4]和《WS/T408—2012 临床化学设备线性评价指南》[5]要求,使用红细胞裂解液制备高浓度白细胞(white blood cell,WBC)悬液,并对WBC计数定量检测方法线性进行验证。
1 材料和方法
1.1 研究对象
选取南京医科大学附属苏州市立医院健康体检者100名,用乙二胺四乙酸二钾真空采血管采集其肘静脉血2 mL。所有标本无溶血、黄疸、脂血。
1.2 仪器与试剂
XE-2100全自动血液分析仪(日本Sysmex公司)及配套试剂;KDC-2046低温离心机(安徽中佳公司);氯化氨(分析纯)、碳酸氢钾(分析纯)购自天津致远化学试剂有限公司,乙二胺四乙酸二钠(分析纯)购自天津市大茂化学试剂厂。
1.3 方法
1.3.1 验证准备 按《WS/T347—2011血细胞分析的校准指南》[6]要求对XE-2100全自动血液分析仪进行校准。在进行线性验证前,本底计数、携带污染率、精密度必须符合《WS/T 406—2012 临床血液学检验常规项目分析质量要求》[7]相关规定。
1.3.2 配制红细胞裂解液 取碳酸氢钾1.0 g、氯化氨8.3 g、乙二胺四乙酸二钠0.037 g,加双蒸水至1 000 mL,配制成工作液[8]。
1.3.3 制备高浓度白细胞悬液 (1)将100份体检者血常规标本,分别装入15 mL的玻璃试管中,每管加入工作液6 mL,混匀15 min后,400×g离心10 min,弃上清液。(2)每管加入工作液1 mL,混匀,每10管转移至1支玻璃试管中,混匀15 min后,400×g离心10 min,弃上清液。(3)每管加入工作液1 mL,混匀,每5管转移至1支玻璃试管中,混匀15 min后,400×g离心10 min,弃上清液。(4)用0.9%NaCl溶液混悬2支试管中的沉淀,混匀15 min后,400×g离心10 min,弃上清液。(5)重复步骤(4)3次后,用AB型血浆混悬所得的沉淀,制成5 mL约200×109/L的白细胞悬液。
1.3.4 分段验证 白细胞医学决定水平在临床诊断和治疗中具有重要意义[9]。为了覆盖所有白细胞医学决定水平,线性验证分低、中、高(0~2.0)×109/L、(2.0~20.0)×109/L、(20.0~200.0)×109/L 3段进行验证。
1.3.5 线性范围评价试验 按NCCLS EP6-A[4]方案将稀释液(L)标记为1号标本,制备的高浓度标本(H)标记为6号标本,2、3、4、5号标本按0.8L+0.2H、0.6L+0.4H、0.4L+0.6H、0.2L+0.8H体积比配制,每份标本重复测定3次,取均值;先初步检查数据,再进行离群值检验,然后进行多项式回归分析;以回归标准误(standard error,SE)最小为最适多项式,如最适多项式为一次多项式,则为线性;如为二次或三次多项式,则进行t检验,公式为:t=bi/SEi,式中bi为非线性系数b2或b3,SEi为非线性系数b2或b3的SE,判断非线性系数b2和b3与0的差异是否有统计学意义,无即为临床可接受线性,有则为非线性;计算线性偏离,公式为:DLi=p(Xi)-(b0+b1Xi),式中p(Xi)为最适多项式在每个稀释度处的估计值,b0+b1Xi为拟合线性在每个稀释度处的估计值;线性偏移=(DLi/b0+b1Xi)× 100%,判断标准为7.5%,白细胞计数为1/2允许总误差(allowable total error,TEa),如线性偏移<7.5%,则为临床可接受线性,线性偏移>7.5%,则为非线性。
1.4 统计学方法
采用SPSS 17.0软件进行统计分析,组间比较采用t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 低、中、高浓度白细胞悬液测定结果
采用格拉布斯法进行离群值检验,计算每个浓度点数据统计量t1、t2,结果显示t1<1.135、t2<1.135,没有离群值,具体结果见表1。
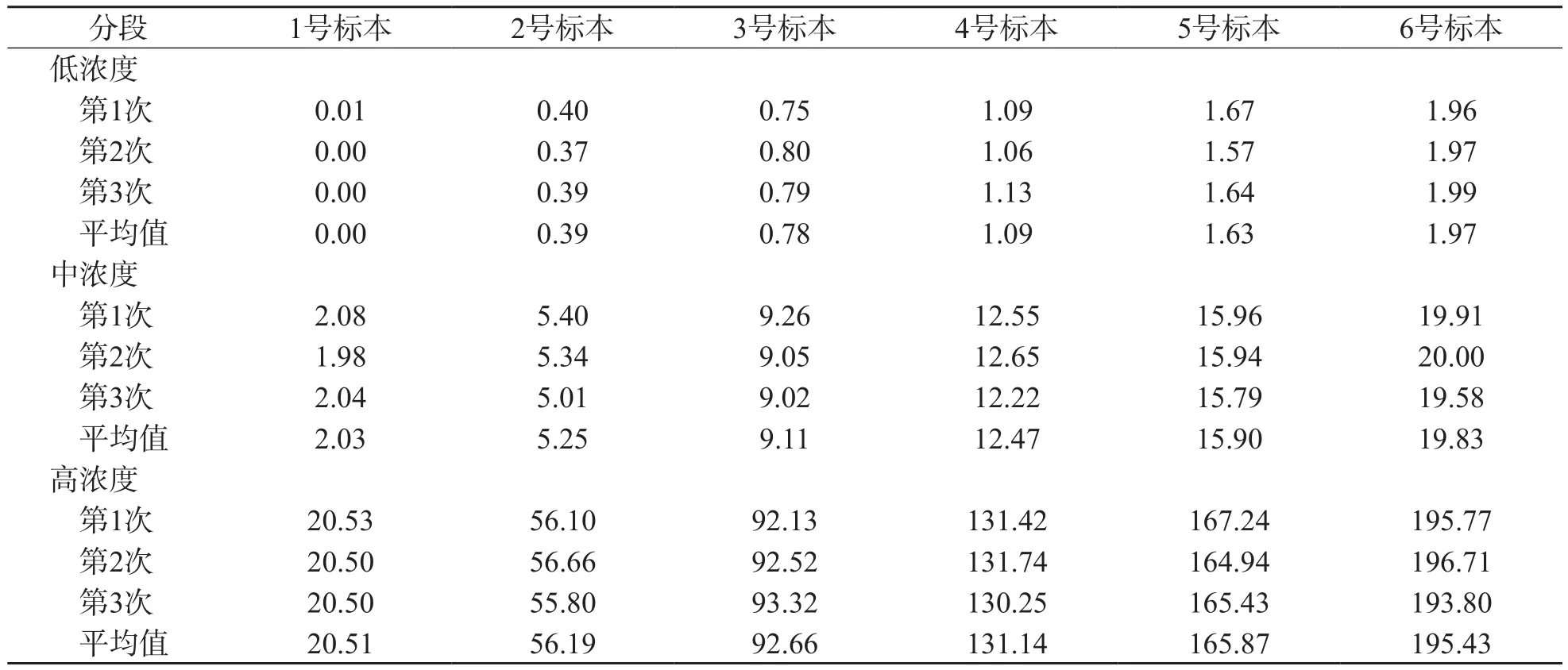
表1 低、中、高浓度白细胞悬液线性验证测定结果
2.2 低、中、高浓度多项式回归分析
低浓度回归SE(0.052)最小,以一次多项式为最适多项式,白细胞计数在(0.0~2.0)×109/L浓度范围内呈线性。中浓度二次多项式回归SE(0.189)最小,以二次多项式为最适多项式,对非线性系数b2进行t检验,自由度为15,t=1.056,P=0.369;b2与0比较差异无统计学意义,白细胞计数在(2.0~20.0)×109/L浓度范围内为临床可接受线性。高浓度三次多项式回归SE(0.615)最小,以三次多项式为最适多项式,对非线性系数b2、b3进行t检验,自由度为14,b2:t=4.829,P=0.040;b3:t=-5.702,P=0.029;b2、b3与0比较差异有统计学意义。见表2。

表2 低、中、高浓度白细胞计数多项式回归参数及最适多项式的非线性系数
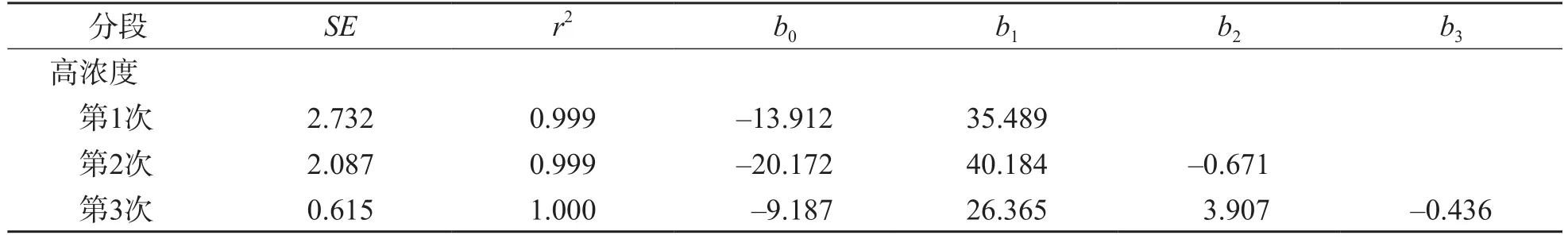
续表2
2.3 高浓度白细胞计数三次多项式与一次多项式估计值的偏移
白细胞计数三次多项式与一次多项式估计值最大偏移为4.3%,<7.5%,在临床可接受误差允许范围内,白细胞计数在(20.0~195.0)×109/L范围内为临床可接受线性。见表3。
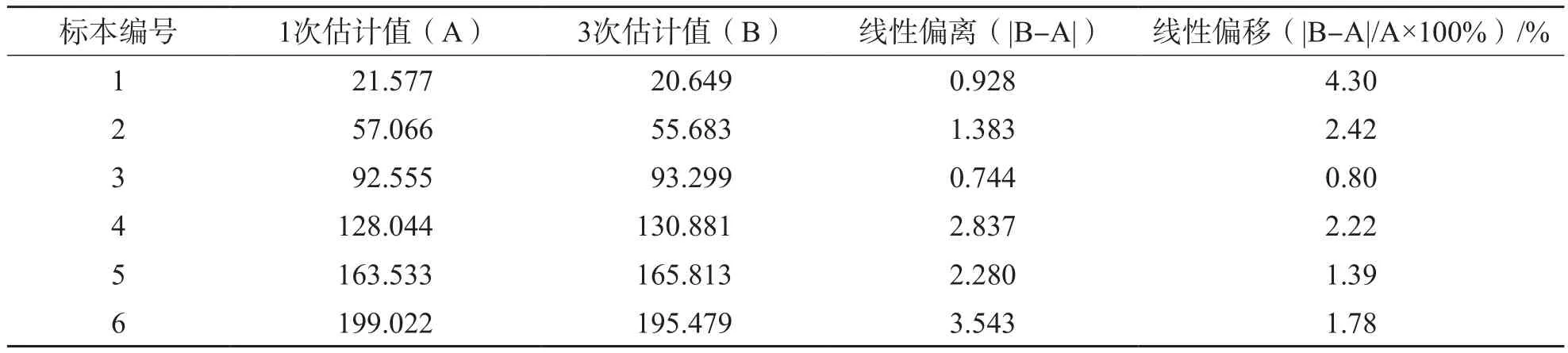
表3 高浓度白细胞计数三次多项式与一次多项式估计值的线性偏移
3 讨论
临床工作中,进行全血细胞计数性能验证时,需要大量高浓度标本,有文献报道用临床标本离心分离白细胞[10],吸取白细胞层,进一步浓缩获得高浓度白细胞悬液,此法要求操作精度较高,对操作人员技术要求也较高。本研究用红细胞裂解液方法获得高浓度标本,来源方便、配制简单,经验证,重复性好、精密度高,是制备高浓度白细胞标本的理想方法。可以在血细胞计数性能验证工作中推广使用。
目前,一般采用几个不同浓度标本测量2~3次的平均值与实际值之间是否有趋势上的线性关系来进行全血细胞计数线性验证,r≥0.975,斜率为0.95~1.05,则验证呈线性,这一方法简单、适用,但不太科学。本研究采用多项式回归分析,先判断非线性多项式拟合数据是否比线性好,如非线性多项式拟合数据点比线性好,再对各个数据点进行非线性评估,判断最适多项式与线性拟合之间的线性偏移是否<1/2 TEa,当评价结果统计学上为非线性时,若采用线性方式处理患者检测结果,引入的误差在临床允许误差范围内,则为临床可接受线性,可按线性处理结果,这一方法虽然验证过程较为繁琐,但更科学、合理,且更有说服力。NCCLS EP6-A文件[1]推荐的方法利用统计学原理保证了结果的准确和客观,将线性评价与临床目标完美结合,更适合临床应用。

