血清β-CTX、IGF-1水平对老年骨质疏松患者并发髋部骨折的预测价值
周 伟,阮 锋,刘 平,黄 松
华中科技大学同济医学院附属梨园医院骨科,武汉 430000
随着我国人口老龄化,老年骨质疏松人群越来越多,骨质疏松易引起骨折尤其是髋部骨折,增加患者残疾率和病死率[1]。骨质疏松无典型临床症状,多数患者在发生骨质疏松骨折时确诊,因此早期识别老年骨质疏松患者发生髋部骨折的风险将有助于减轻患者负担。骨代谢异常引起骨组织钙化和骨生成减少是骨质疏松并发骨折病理基础,骨代谢生物学指标可能为骨折风险评估提供帮助[2]。Ⅰ型胶原羧基端肽β特殊序列(type I collagen carboxyl telopeptide beta specific sequence,β-CTX)是国际骨质疏松症基金会推荐的骨代谢标志物,在骨吸收时β-CTX高表达,是骨吸收的标志物[3]。胰岛素样生长因子-1(insulin-like growth factor-1,IGF-1)是一种骨生成刺激因子,具有促使骨愈合和成骨细胞生成作用[4]。本研究前瞻性分析2018年1月—2019年12月笔者医院收治的164例老年骨质疏松患者临床资料,拟探讨血清β-CTX、IGF-1水平与老年骨质疏松髋部骨折的关系,旨在为临床骨质疏松性骨折的预防提供参考。
资料与方法
1 一般资料
纳入标准:(1)结合临床症状、实验室和影像学检查诊断为骨质疏松,符合中华医学会骨质疏松和骨矿盐疾病分会拟定的2017版《原发性骨质疏松症诊疗指南》[5];(2)年龄≥60岁;(3)近1个月未服用影响骨代谢药物。排除标准:(1)骨关节炎、骨结核、骨肿瘤;(2)既往髋部手术史或创伤史;(3)合并严重心、肺、肾、肝功能障碍;(4)免疫疾病、血液系统疾病、急慢性感染。
164例中85例发生髋部骨折,经X线片、CT确诊,为骨折组;79例未发生髋部骨折,为无骨折组;另选择72例于笔者医院门诊体检正常者为对照组,对照组排除既往或出现骨折史、骨质疏松以及全身系统疾病。收集骨质疏松患者年龄、性别、既往吸烟史、既往饮酒史、基础疾病、合并疾病、骨质疏松病程、BMD、户外运动和补钙情况。本研究获医院医学伦理委员会批准(2018-LY-023),患者及家属均签署知情同意书。
2 血清β-CTX、IGF-1检测
受试者均采集外周静脉血3mL,置入无菌干燥试管中,室温下静置30min待血液凝固,取上层液于离心管,置于Microfuge20低速自动平衡离心机(美国贝克曼公司),4℃ 3 000r/min离心15min(离心半径10cm),取血清-70℃保存于SNOWSONG DW-105W型超低温冰箱(上海兰嫩有限公司)。E601型化学发光免疫分析仪(瑞士罗氏公司)采用化学发光法检测血清β-CTX水平,试剂盒购自北京科美东雅生物技术有限公司。ALISEI全自动酶标仪(意大利SEAC公司)采用酶联免疫吸附试验检测血清IGF-1水平,试剂盒购自武汉博士德公司。
3 骨密度测量
采用美国Hologic Discovery A型双能X线骨密度仪测定骨质疏松患者股骨颈、股骨、全髋、胫骨、大转子、腰椎(L1~L4前后位腰椎均值)骨密度(bone mineral density,BMD)。
4 统计学分析
结 果
1 一般资料比较
三组患者年龄、性别、既往吸烟史、既往饮酒史比较差异均无统计学意义(P>0.05)。骨折组年龄≥70岁比例、户外运动≥3次/周比例、补充钙剂比例高于无骨折组(P<0.05),骨质疏松病程长于无骨折组(P<0.05),股骨颈、全髋BMD低于无骨折组(P<0.05)。骨折组和无骨折组性别、既往吸烟史、既往饮酒史、基础疾病、股骨BMD、大转子BMD、腰椎BMD、合并疾病比较差异均无统计学意义(P>0.05)。见表1。
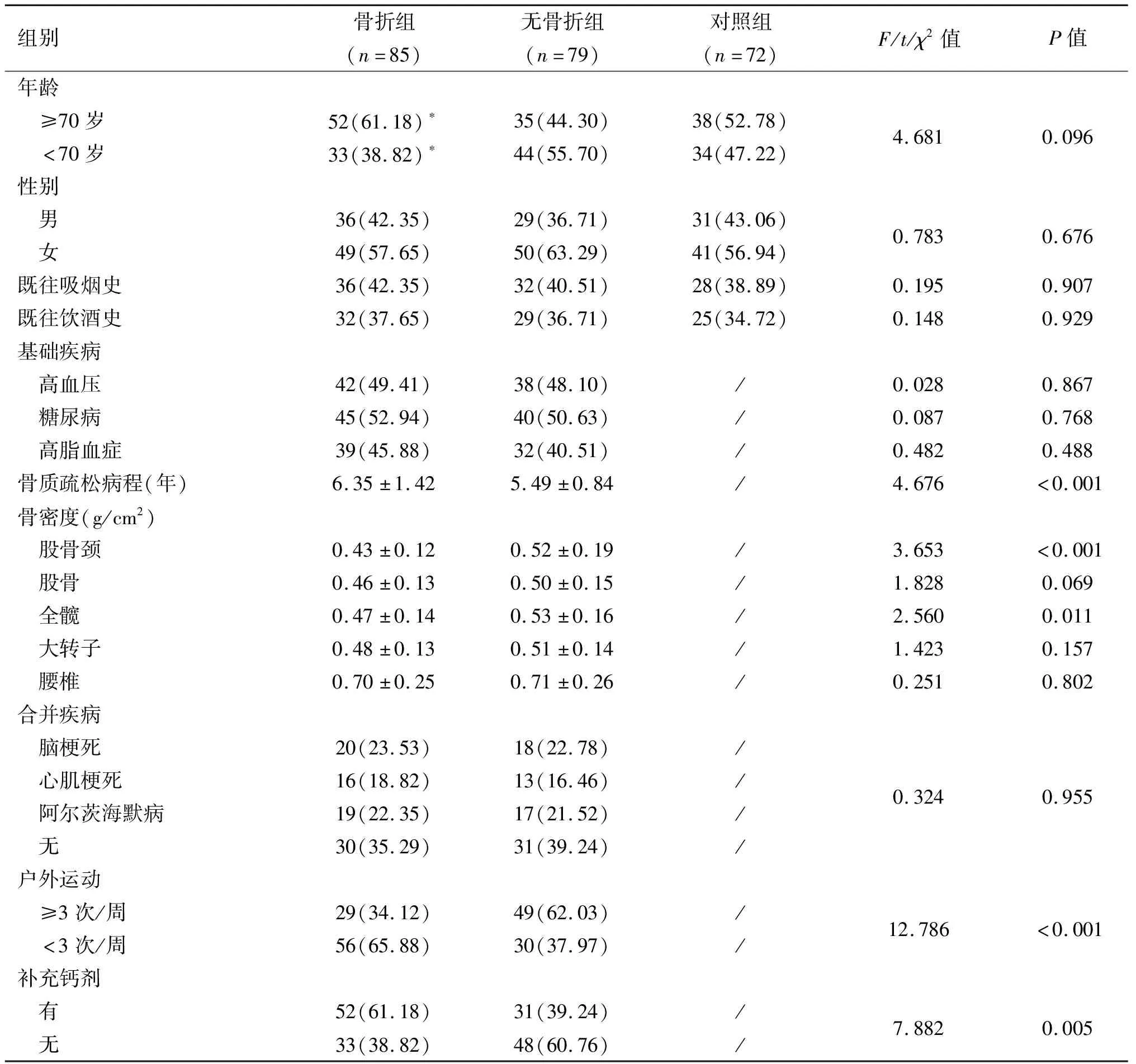
表1 三组患者一般资料比较[n(%)]
2 血清β-CTX、IGF-1比较
骨折组血清β-CTX水平高于无骨折组和对照组(P<0.05),血清IGF-1水平低于无骨折组和对照组(P<0.05)。无骨折组血清β-CTX水平高于对照组(P<0.05),血清IGF-1水平低于对照组(P<0.05)。见表2。

表2 血清β-CTX、IGF-1水平差异
3 血清β-CTX、IGF-1水平与BMD相关性
骨折组血清β-CTX水平与股骨颈、全髋BMD呈负相关(P<0.05),IGF-1与股骨颈、全髋BMD呈正相关(P<0.05),血清β-CTX、IGF-1水平与股骨、大转子、腰椎BMD无相关性(P>0.05),见表3。
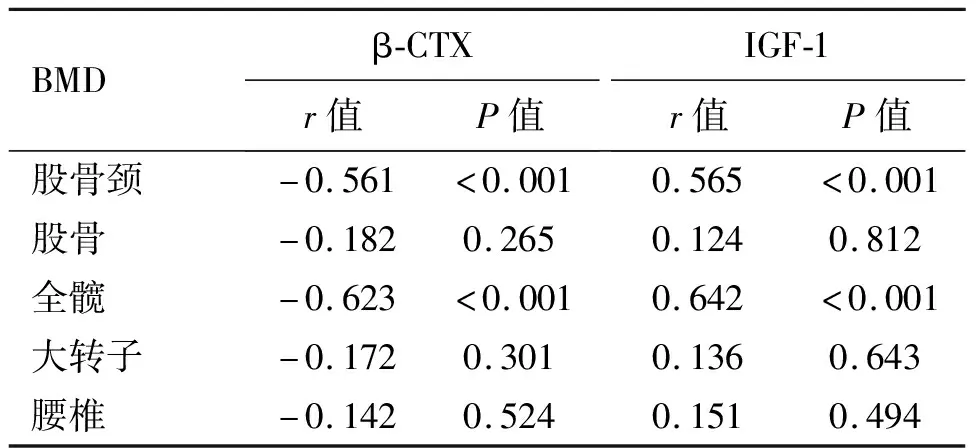
表3 血清β-CTX、IGF-1水平与BMD相关系数
4 影响老年骨质疏松患者并发髋部骨折的因素
以老年骨质疏松患者并发髋部骨折为因变量,年龄(赋值:1=<70岁,2=≥70岁)、户外运动(赋值:1=≥3次/周,2=<3次/周)、补充钙剂(赋值:1=有,2=无)、骨质疏松病程(连续性变量)、股骨颈BMD(连续性变量)、全髋BMD(连续性变量)、β-CTX(连续性变量)、IGF-1(连续性变量)为自变量,建立Logistic回归模型,校正性别、基础疾病等混杂因素,最终年龄≥70岁、低全髋BMD、户外运动<3次/周、高β-CTX、低IGF-1是老年骨质疏松患者并发髋部骨折的危险因素(P<0.01),见表4。
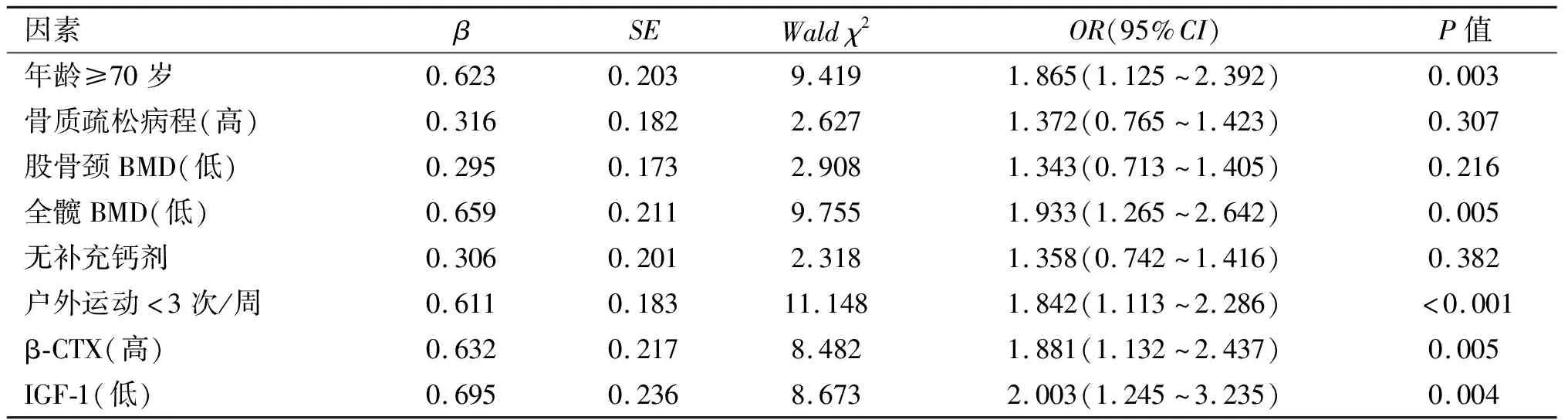
表4 影响老年骨质疏松患者并发髋部骨折的Logistic回归模型
5 血清β-CTX、IGF-1预测老年骨质疏松患者并发髋部骨折的价值
ROC分析β-CTX、IGF-1、β-CTX+IGF-1预测老年骨质疏松患者并发髋部骨折的曲线下面积(area under the curve,AUC)分别为0.734、0.723、0.894,见图1。β-CTX+IGF-1预测老年骨质疏松患者并发髋部骨折的AUC高于单独β-CTX、IGF-1(z=2.135、2.309,P<0.05),β-CTX、IGF-1、β-CTX+IGF-1预测老年骨质疏松患者并发髋部骨折的灵敏度、特异度、约登指数见表5。

表5 β-CTX、IGF-1、β-CTX+IGF-1预测老年骨质疏松患者并发髋部骨折的效能
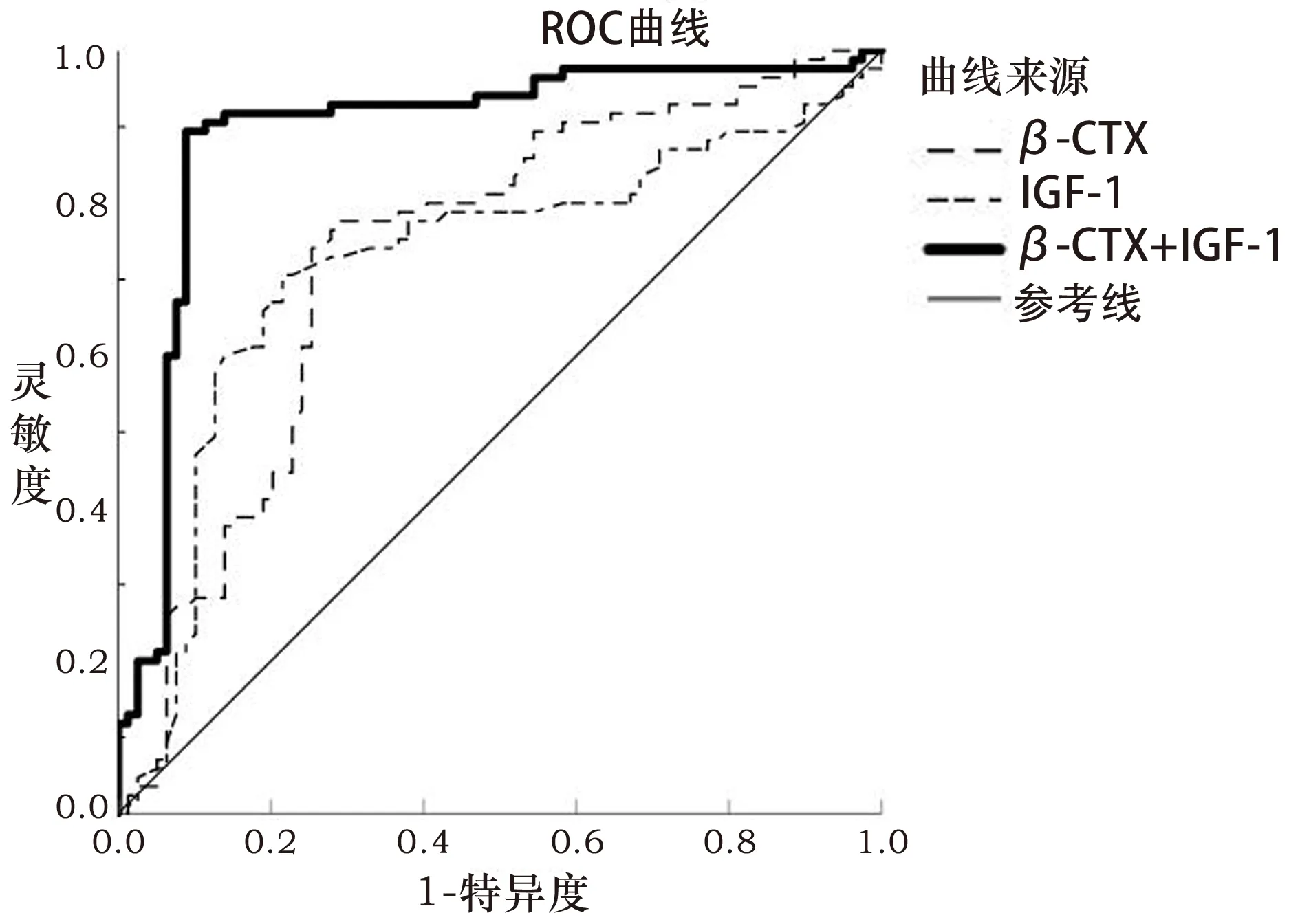
图1 β-CTX、IGF-1、β-CTX+IGF-1预测老年骨质疏松患者并发髋部骨折的ROC图
讨 论
老年骨质疏松并发髋部骨折手术风险大,术后并发症多,严重影响老年患者的健康状况和生活质量,甚至危及生命[6]。评估骨质疏松患者骨折风险一直是临床研究的热点,CT、MRI等影像学方法是临床评估骨质疏松患者并发骨折的主要方法,但CT辐射性大,MRI价格昂贵、检查禁忌证多,且对骨折无显著预防作用,多数患者检查时已经发生骨折。双能X线吸收法测定骨密度检查有助于发现骨质疏松,对骨折风险起到警示作用。本研究股骨颈、全髋BMD低于无骨折组,但股骨、大转子、腰椎BMD比较并无差异,提示BMD对骨折风险尚存一定局限性。生物学指标检测方便、无电离辐射、经济,是疾病诊断、病情评估、预后判断的理想标志物,骨代谢生物指标与骨质疏松、骨折均有密切关系[7]。
本研究发现骨折组、无骨折组血清β-CTX水平升高,高于对照组,骨折组血清IGF-1水平降低,低于无骨折组,说明β-CTX和IGF-1在骨质疏松合并骨折患者中表达明显异常。β-CTX是I型胶原蛋白的羧基端降解产物,在骨吸收增强时β-CTX经I型胶原蛋白降解形成,并释放入血,是骨吸收的重要生物学指标[8]。IGF-1是一种分泌型小肽生长因子,具有调节生长激素、中间代谢、组织修复作用,生长激素通过核因子κB受体激活剂、配体刺激骨保护素的产生以及在骨基质中蓄积,维持骨代谢稳定[9]。IGF-1作为调控生长激素的关键因子,通过复杂的激素相互作用增强成骨细胞活性,促使骨骼细胞有丝分裂和Ⅰ型胶原合成,并通过抑制胶原酶表达来减少骨胶原降解,刺激线性骨生长,激活骺软骨前细胞[9]。现有研究也显示β-CTX在老年男性股骨头坏死[10]、绝经后女性骨质疏松性腰椎骨折[11]、骨折延迟愈合[12]等疾病中均出现异常表达。Gao等[13]也指出IGF-1基因变异与中国绝经后女性罹患骨质疏松风险有关。
本研究相关性分析结果显示β-CTX水平与股骨颈、全髋BMD呈负相关,IGF-1与股骨颈、全髋BMD呈正相关,说明β-CTX越高、IGF-1越低,骨形成越少,骨吸收越严重,BMD越低,骨折风险越大。Logistic回归分析结果证实高水平β-CTX、低水平IGF-1是老年骨质疏松患者骨折的危险因素,证实β-CTX、IGF-1均参与老年骨质疏松患者骨折发病的过程。分析原因为高水平β-CTX加重骨吸收和骨破坏,骨吸收逐渐超过骨形成,最终引起骨量逐渐减少,BMD不断下降,在轻度外力作用下或自发发生髋部骨折[14]。IGF-1作为强刺激骨生成刺激因子,通过PI3K/Akt信号通路促进成骨细胞增殖[15],IGF-1缺失导致骨合成代谢障碍,骨吸收增加,骨量减少,骨质疏松骨折发生率增加。
本研究ROC分析示β-CTX、IGF-1预测老年骨质疏松并发髋部骨折AUC分别为0.734、0.723,说明β-CTX、IGF-1评估骨质疏松患者骨折风险具有较好的效能,可能成为老年骨质疏松患者骨折风险评估的潜在价值。而联合β-CTX、IGF-1能更好反映骨质疏松患者骨代谢、骨转化状态,进而更为准确判断骨折的风险,可提高预测灵敏度、特异度。
本研究Logistic回归分析结果显示年龄、全髋BMD、户外运动与老年骨质疏松并发髋部骨折有一定关系,年龄≥70岁老人骨质疏松患病率高达39.5%,需要接受治疗达59.5%[16],随着年龄增长,BMD逐渐下降,骨折风险越大。BMD是诊断骨质疏松的敏感指标,BMD的降低与骨折有着密切的关系。户外运动可通过Wnt/β-Catenin、BMP/Smads、OPG/RANK/RANKL等多种信号通路调节骨代谢,维持骨代谢平衡状态,利于骨形成[17],加强户外运动可预防骨质疏松性骨折发生。
综上,β-CTX水平升高,IGF-1水平降低是老年骨质疏松患者并发髋部骨折的主要危险因素,联合监测血清β-CTX、IGF-1水平有助于评估老年骨质疏松患者骨折风险。抑制β-CTX,提高IGF-1水平可能有助于骨质疏松髋部骨折的预防。

