一株白及内生细菌的分离鉴定及抑菌机理初步研究
王红莹,李春燕,宋发军,林爱华,孟艳艳
(中南民族大学 生命科学学院&生物技术国家民委重点实验室&武陵山区特色资源植物种质保护与利用湖北省重点实验室,武汉 430074)
白及(Bletillastriata)是兰科白及属多年生草本植物,又名连及草、地螺丝等,具有抗菌、消炎、抗衰老、抗过敏和止痒等多种药理作用[1-2]具有较高的药用价值和经济价值[3].
植物内生菌是具有高度多样性的微生物资源,寄生在健康植物的各组织、器官内以及各细胞和细胞间隙之间而不引起植物病变,在长期的进化过程中,由于基因交流,使其能够产生与宿主植物相同或相似的活性成分[4-5]. 在特定的生理环境下,植物内生菌可促进自身和宿主植物分泌活性物质提高宿主的抗病性、抗逆性,提升生态适应性. 据报道,目前从植物内生菌中分离得到的具有拮抗活性的代谢产物包括聚酮类、多肽类、有机酸类、生物碱、醌类、萜类、黄酮类、内酯类及香豆素类等[6]. 从药用植物中分离得到的内生菌可以产生多种活性物质,有些内生菌可产生独特新颖的次级代谢产物;有些可产生与宿主具有相似药理效应的活性物质[7]. 因此,药用植物内生菌的开发利用具有潜在的理论与实用价值. 然而,目前仅有少量白及内生菌代谢产物相关的文献报道[8]. 本研究从云南丽江地区种植的白及块茎中分离鉴定内生细菌,研究其抑菌活性,以期筛选出具有抑菌活性的优良菌株,进而研究其代谢产物中的抑菌成分,为后续深入开发白及内生菌资源奠定基础.
1 材料与方法
1.1 实验材料与试剂
本研究所用的白及采自云南丽江种植地区,样品采集后-80 ℃保存备用.
2×Taq PCR MasterMix、细菌基因组试剂盒、乙酸乙酯、石油醚、正丁醇、甲醇均购自武汉辰田生物.
1.2 实验方法
1.2.1 内生细菌的分离及纯化
白及内生菌的分离及纯化参照苏子敬[2]和本实验室前期报道[9]的方法并加改进. 新鲜的白及块茎自来水清洗后取约0.1 g用无菌水冲洗3次,依次用75%的乙醇、5%次氯酸钠、75%的乙醇消毒,无菌水依次清洗. 将最后一步消毒后无菌水溶液涂布在培养基上培养7 d,培养基上无细菌生长,说明白及块茎消毒彻底.
白及块茎组织加适量的生理盐水轻研磨成悬浮液,适当稀释后涂布培养基,28 ℃ 恒温培养 3~5 d.待平板上长出菌落后,用接种环挑取菌体转接至新的培养基上进行划线培养,获得各个内生细菌的单克隆.
1.2.2 内生细菌菌液抑菌活性测试
在 LA 培养基中按 1/1000 比例加入受试菌菌液倒平板冷却备用,将纯化后的内生细菌发酵培养备用,取20 μL菌液滴在滤纸上,然后将滤纸贴于加有受试菌的培养基上,受试菌分别为金黄色葡萄球菌(Staphylococcusaureus,S.au)、大肠杆菌 (Escherichiacoli,E.coli)、藤黄微球菌(Micrococcusluteus,M.Luteus)、胡萝卜果胶杆菌(Pectobacteriumcarolovorum,P.Ca). 恒温培养箱中倒置培养24 h后观察抑菌圈的大小. 最后筛选得到一株具有抑菌活性的拮抗菌,编号为 BSR2010,后续实验围绕该菌株展开.
1.2.3 菌株BSR2010发酵产物的提取
将保存在甘油里的BSR2010活化,单菌落转接至LA液体培养基上,28 ℃、180 r/min恒温摇床培养12 h得种子液. 取 100 μL种子液至1000 mL的LA液体培养基放大培养培养3~5 d. 发酵液浑浊后,按照发酵液∶有机溶剂(乙酸乙酯、石油醚、正丁醇)为1∶1的比例萃取,浓缩得后得到发酵产物粗浸膏. 用甲醇溶解后经0.22 μm滤器过滤后于4 ℃保存备用.
1.2.4 菌株BSR2010发酵产物的活性测定
在LA培养基中加入1/1000的金黄色葡萄球菌备用,将无菌滤纸贴于培养基上. 分别移取约 20 μL 乙酸乙酯、石油醚、正丁醇萃取物滴加在无菌滤纸上. 28 ℃恒温培养箱中倒置培养24 h后,观察抑菌圈的大小.
1.2.5 菌株BSR2010发酵产物的薄层色谱检识
将有机溶剂萃取的菌株发酵产物2 μL点在硅胶板上,以乙酸乙酯∶石油醚(9∶1)为展开剂,10%的硫酸乙醇溶液显色.
1.2.6 菌株BSR2010的鉴定
按照细菌基因组提取试剂盒说明书提取菌株 BSR2010 基因组DNA 作为模板,采用引物27F:5′-AGAGTTTGATCCTGGCTCAG-3′和1492R:5′-TACGG
CTACCTTGTTACGACTT-3′ 进行 PCR 扩增16S rDNA 基因片段. PCR 反应体系条件如下:94 ℃,3 min;94 ℃,30 s;55 ℃,30 s;72 ℃,1 min,共 30 个循环;72 ℃,5 min;4 ℃保温. 然后 PCR 扩增产物经1%琼脂糖凝胶电泳加以鉴定,扩增产物由擎科生物测序.将测得的序列在NCBI数据库中进行BLAST比对,并用软件MEGA 6.06进行系统发育分析,以自展法 (bootstrap)循环1000次进行检测,构建系统发育进化树.
1.2.7 菌株BSR2010抗生性次级代谢物相关功能基因的检测
以菌株 BSR2010 基因组为模板,扩增 2,4-二乙酰基藤黄酚(2,4-diacetyl phloroglucinol, DAPG)、吩嗅-1-竣酸(phenazine-1-carboxylacid, PCA)、藤黄绿脓菌素(pyoluteorin, PLT)、硝吡咯菌素(pyrrolnitrin, PRN)等 4 种抗生性次级代谢产物合成基因的保守片段,基因引物如表1所示.

表1 抗生素基因扩增引物Tab.1 Primers for antibiotic gene amplification
2 结果与分析
2.1 白及内生菌分离、纯化及抑菌活性测试
利用组织研磨法得到的组织悬浮液涂布于LA培养基上进行白及块茎内生细菌的分离纯化,最终分离得到白及内生细菌204株.
分离纯化后的内生细菌对4种受试菌的抑菌活性进行筛选并得到一株具有抑菌活性的拮抗菌,编号为 BSR2010. 该菌种能够不同程度地抑制金黄色葡萄球菌、藤黄微球菌、大肠杆菌、胡萝卜果胶杆菌(图1,图2). 其中对藤黄微球菌的抑制效果最强,抑菌圈直径为 34 mm,其次为金黄色葡萄球菌,抑菌圈直径为 22 mm,对大肠杆菌的抑菌圈直径大小为 11 mm,对胡萝卜果胶杆菌的抑菌圈直径大小为 10 mm. 参考《中国药理学》的抗菌活性判断标准[10], BSR2010 抗藤黄微球菌和金黄色葡萄球菌表现为极敏,抗大肠杆菌和胡萝卜果胶杆菌表现为中敏. 藤黄微球菌和金黄色葡萄球菌属于革兰氏阳性菌,大肠杆菌和胡萝卜果胶杆菌属于革兰氏阴性菌. 可见,BSR2010 对革兰氏阳性致病菌表现出较强的抑制活性,对于革兰氏阴性菌的抑制活性相对较弱.
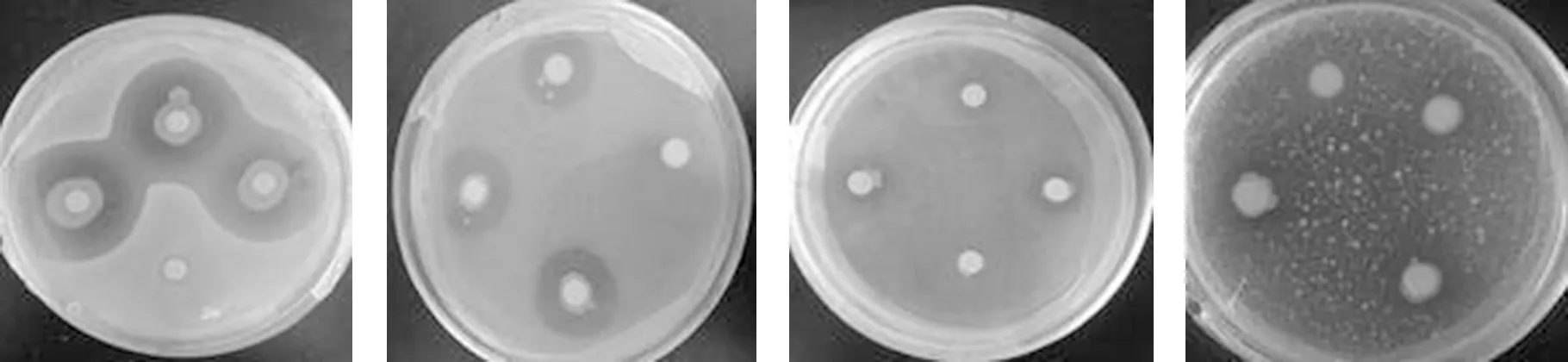
(a)对大肠杆菌 (b)对金黄色葡萄球菌 (c)对藤黄微球菌 (d)对胡萝卜果胶杆菌 图1 BSR2010菌株对四种受试菌的抑制活性检测Fig.1 Diameter circle images of inhibitory activity of BSR2010 against four tested bacteria
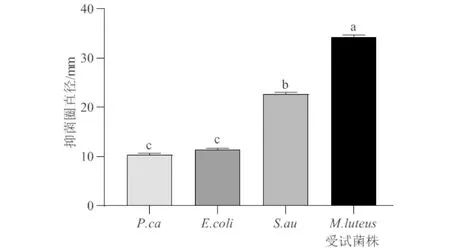
图2 白及内生菌BSR2010抑制4种受试菌生长的抑菌圈直径Fig.2 Antibacterial circle diameter of BSR2010 inhibiting the growth of four tested bacteria strains注:a、b和c代表不同致病菌对菌株BSR2010的抑菌活性的方差分析(P<0.05)的Dun-cans′新复极差检验结果
2.2 菌株BSR2010发酵产物的提取
从发酵产物的产量分析可以看出,用于萃取的有机溶液的种类对内生菌BSR2010发酵产物的提取有较大的影响(表2). 用乙酸乙酯萃取的发酵产物产量最高,为0.2524 g,石油醚和正丁醇萃取的发酵产物的产量次之,分别为0.1530 g和0.1120 g.

表2 白及内生菌BSR2010发酵产物的质量Tab.2 Quality and antibacterial circle diameter of the fermented metabolites of bacterial strain BSR2010 from Bletilla Striata
2.3 菌株BSR2010发酵产物检测
菌株BSR2010发酵产物对金黄色葡萄球菌的抑制活性结果如图3,乙酸乙酯提取物的抑菌活性明显大于石油醚和正丁醇的提取物,抑菌圈直径为35 mm,抑菌活性表现为极敏,薄层色谱结果如图4所示,用乙酸乙酯萃取的发酵产物显示有5条显色条带且分离程度良好,同样显示出BSR2010的乙酸乙酯部位可能存在多种有效抗菌物质.

图3 BSR2010的有机萃取物对金黄色葡萄球菌的抑菌效果Fig.3 Antibacterial activity of BSR2010 organic solventon on S.au

(A)乙酸乙酯;(B)石油醚;(C)正丁醇.图4 BSR2010的有机萃取物的TLC结果Fig.4 TLC results of organic solvent extracts of BSR2010
2.4 内生菌的分类及鉴定
扩增内生细菌BSR2010的16S rDNA序列并测序,根据序列比对结果发现,片段大小在 1500 bp左右,结果如图5所示. 16S rDNA测序获得的序列在NCBI数据库上做BLAST序列比对分析,结果发现菌株BSR2010与菌株Pseudmonasfluorescensstrain HN1205(HQ610446.1)序列的相似度高达99.93%.系统发育树分析显示菌株 BSR2010 与Pseudmonasfluorescensstrain HN1205(荧光假单胞菌)处于同一分支,亲缘关系较近,故将菌株 BSR2010 初步鉴定为假单胞杆菌属(Pseudomonassp.)(图5).

图5 基于16S rDNA 基因序列构建的菌株BSR2010与假单胞杆菌属相关菌株的系统进化树Fig.5 Phylogenetic tree of BSR2010 strain related to Pseudomonas sp. based on 16S rDNA gene sequence
2.5 菌株BSR2010抗生性次级代谢物相关功能基因的检测
BSR2010 菌株基因组中可检测到与 DAPG 合成基因保守区域phl大小一致的片段(图6),在NCBI数据库中进行BLAST比对分析,结果发现与荧光假单胞菌(Pseudomonasfluorescensstrain ALEB 7B)全基因组中的phlD序列相似度为 100%. 初步推测菌株BSR2010可通过产生2,4-二乙酰基藤黄酚抑制4种供试菌的生长.

M:DL2000 DNA Marker.图6 phl基因PCR扩增结果Fig.6 PCR result of phl gene
3 讨论
大部分植物内生细菌是通过产生次级代谢产物来抑制病原菌的生长[11]. 本研究筛选得到的白及内生细菌BSR2010对供试菌藤黄微球菌(G+)、金黄色葡萄球菌(G+)、大肠杆菌(G-)、胡萝卜果胶杆菌(G-)均具有抑制效果,但对于不同的致病菌抑制活性存在差异,可能是因为代谢产物中的成分对不同的病原菌敏感度不同[12].
研究结果表明BSR2010属于假单胞菌属(Pseudomonassp.),而假单胞菌是土壤和其他环境中常见的微生物群体,能够产生大量的次生代谢产物以适应环境的变化,不同环境中的假单胞菌可以合成不同结构的抗生素如2,4-二乙酰基藤黄酚(DPAG)、硝吡咯菌素等[13-14]. 本研究筛选到产生的抑菌成分DAPG的关键合成基因phlD. DAPG是一种广谱抗生素. 产生DAPG菌对金黄色葡萄球菌、藤黄微球菌等革兰氏阳性细菌有较强的抑制作用[15]. 其生物合成基因簇为phlABCDEF. DAPG的前体物质藤黄酚由phlD(编码Ⅲ型PKS的查耳酮合酶)介导合成. 随后藤黄酚经phlABC编码的各类酶催化形成最终的DAPG. 因此,推断菌株 BSR2010 可能通过产生DAPG来抑制病原菌的生长.
BSR2010菌株的乙酸乙酯部位具有良好的抑菌能力,而石油醚和正丁醇部位的抑菌能力相对较弱. 据报道,中药白及的乙酸乙酯部位的抑菌活性最强,其中对革兰阳性菌的抑制效果明显[16]. 推断白及内生细菌BSR2010可能产生与宿主植物白及相似的抑菌活性物质. 经乙酸乙酯萃取物的薄层层析发现BSR2010的发酵产物中可能存在不同组分的代谢产物. 本研究后期将进一步分离纯化得到次生代谢产物的单体化合物并分析其抑菌活性,为开发利用白及内生菌资源和筛选活性化合物提供种质资源.

