察尔森水库水质特征及其微生物多样性分析
崔 迪,宋金萍,郑国臣,魏念鹏,邓红娜,谷逊雪
(1.哈尔滨商业大学 药物工程技术研究中心,哈尔滨 150076; 2.哈尔滨商业大学 药学院, 哈尔滨 150076; 3.松辽水资源保护科学研究所, 长春 130000)
河流、湖泊、水库是水环境的重要组成部分,具有水资源调配、控制洪水等作用,其中水库在蓄水、调节径流、发电等方面起着重要作用[1].当前国内外在环境领域关于水库的研究主要集中在水库安全管理、水库容量[2]、新型信息技术软件应用、汛期及泄洪等方面.察尔森水库作为洮儿河干流上唯一一座控制性骨干工程,位于察尔森镇北1.7 km处,是一座综合利用大型水库,察尔森水库地理位置可见图1.察尔森水库自建成运行以来,发挥着巨大的经济和社会效益[3].在防洪方面,通过察尔森水库的调蓄洪水作用,察尔森水库拦蓄洪水多次,科学调度,最大限度地发挥了防洪减灾的作用,确保了下游两省区人民正常的生产生活秩序.此外,察尔森水库还具有发电[4]、鱼业养殖[5]和旅游等重要经济意义.因此察尔森水库水质状况对于周边居民的生活和经济来源有着重要影响.近年来关于察尔森水库的研究,主要集中在水库管理、汛期及洪水调度、库坝加固措施、生态保护和环境影响分析等多个方面,而对于水库的水质与微生物群落变化之间关系尚不可知[6].本研究以察尔森水库水质为研究对象,检测其理化指标并采用高通量测序技术,对察尔森水库水质、底泥细菌群落结构及多样性进行分析,旨在揭示查尔森水库水质与微生物群落变化之间的联系,为查尔森水库水质特征提供借鉴.

图1 察尔森水库地理位置图
高通量测序技术可以通过得到特定的DNA分子片段,更全面地展示微生物群落的组成及分布情况[7],因此在水环境的生物监测中得到广泛应用[8].例如,在生物群落多样性组成及环境因素响等方面做了大量的研究[9-10].开展水库微生物多样性的深入调查和研究,对地球物质循环、能量循环和环境保护等方面起着重要的作用[11].水库水体和底泥中微生物群落分布与水质状况有密切的联系.近年来,学者们对水库微生物群落多样性与水质关系做了的大量的研究.例如水深、有机质、总氮、含总磷量等对沉积物细菌的群落组成存在不同程度的影响,其中总氮和总磷质量浓度对沉积物中微生物群落分布情况影响较大[12].Song等[13]人对东平湖沉积物中的微生物群落进行分析,发现总磷是影响细菌群落的主要因素.
本文采用高通量测序技术检测察尔森水库东、西入口及出口位点的微生物群落结构组成情况,结合察尔森水库丰水期的水质状况,深入探究察尔森水库水质特征变化与微生物群落结构之间的关系,进一步挖掘察尔森水库微生物的构成对水库环境生态系统的影响和作用,为察尔森水库水体的生态环境保护奠定理论基础.
1 材料与方法
1.1 材料
本实验采集的样品为2019年7~8月份(丰水期)的水样及对应位点的泥样.采样点位见图2.样品编号及采样量见表1所示.样品的采集根据《水质湖泊和水库采样技术指导》(GB/T14581-93)标准要求进行采集[14],使用采泥器采集泥样,然后放在干净的聚乙烯薄膜袋里等待测试.

图2 采样监测点位图

表1 样品编号
1.2 方法
1.2.1 察尔森水库丰水期水质检测
察尔森水库丰水期水质指标选取高锰酸盐指数、化学需氧量(COD)、总磷(TP)、总氮(TN)、砷(As)共9项具有代表性的水质指标用于评估察尔森水库的水质状况.以上指标的测定均参照《水和废水监测分析方法》(第四版)[15]进行检测分析.
1.2.2 察尔森水库微生物群落结构分析
分别取察尔森水库丰水期的东、西入口和出口底泥.底泥样品在离心机上以5 000 r/min的转速离心10 min后于-80 ℃冰箱中冻存.水样取1 000 mL在玻璃抽滤器上经0.22 μm的纤维滤膜进行抽滤,抽滤后将滤膜取下,装入离心管中,于-80℃冰箱中冻存[16].样品交由上海美吉生物医药科技有限公司进行高通量测序.测序流程如下:1)DNA抽提;2)PCR扩增及产物定量;3)利用Illumina MiSeq平台进行高通量测序,测序获得数据用于进行察尔森水库的微生物群落结构分析.
2 结果与讨论
2.1 察尔森水库丰水期水质检测结果
2.1.1 丰水期COD变化情况
察尔森水库丰水期三个位点的COD质量浓度结果如图3所示,三个采样位点的COD质量浓度均较高.当COD质量浓度高于10 mg/L可确定水体发生富营养化[17].整体来看,从DHN_1到出口COD呈现下降趋势.三个位点的COD平均值变化情况为9.32 mg/L(DHN_1)>7.9 mg/L(DHN_2)>7.81 mg/L(DHN_3).DHN_1处的COD质量浓度在丰水期内先上升后下降,其中8月1日的COD质量浓度最高(11.43 mg/L),可判断水体已经发生富营养化,七月初时质量浓度最低7.62 mg/L.DHN_2和DHN_3的COD平均值相差不大,但变化趋势存在一定差异.DHN_2的COD水平在七月初时是5.64 mg/L,但在7月15日时COD质量浓度增加了4.07 mg/L,之后在丰水期内一直高于6.5 mg/L.水库DHN_3的COD质量浓度波动较小,质量浓度范围在5.99 ~9.06 mg/L.从COD质量浓度水平来看,三个采样点位中COD质量浓度均高于5.64 mg/L,平均质量浓度均接近10 mg/L,其中东入口的水体污染程度最大.

图3 水库中COD质量浓度
水质监测结果的平均值见表2,3个点位中水温、pH、DO、As、Zn的监测值相差不大,因此推测这些指标可能不是导致水库富营养化的主要原因.水体中饱和溶解氧质量浓度为10 mg/L,由表2可知三个点位溶解氧质量浓度均较低[18].丰水期水库温度较高,水温较高时,微生物活性较高.有研究表明,温度和溶解氧存在一定的线性关系,温度越高则溶解氧质量浓度越低[19].高锰酸盐指数的变化情况与COD变化趋势一致,DHN_1>DHN_3>DHN_2.
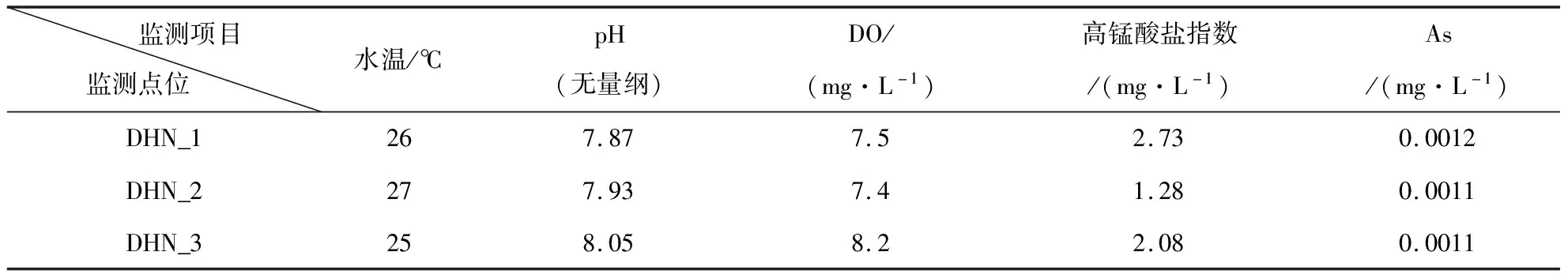
表2 水质指标均值
2.1.2 丰水期TN变化情况
根据图4可判断,察尔森水库存在水体富营养化的情况.TN质量浓度高于1.5 mg/L时可认为水体已发生富营养化[20].整体来看,从DHN_1到DHN_3的TN呈现先上升后下降的趋势,在三个位点的TN平均值变化情况为5.45 mg/L(DHN_2)>2.21 mg/L(DHN_1)> 2.03mg/L(DHN_3).DHN_2的TN质量浓度明显高于DHN_1和DHN_3,三个采样点质量浓度均高于1.5 mg/L,也就是说从TN来看三个采样点都存在富营养化情况.在整个丰水期中,DHN_1中的TN波动较小,质量浓度水平保持在1.68 ~2.83 mg/L的范围内.在7月中旬TN质量浓度达到最高2.83 mg/L,然后逐渐降低.DHN_2的TN质量浓度整体呈现较高水平,最低质量浓度为4.98 mg/L,仍高出DHN_1和DHN_3的平均值两倍左右,这说明DHN_2富营养化程度最为严重.从察尔森水库地理位置分析,导致DHN_2的TN质量浓度最高的原因可能是由于吸入口附近存在农村生活污水的排放.

图4 水库中总氮质量浓度
2.1.3 丰水期TP变化情况
图5结果显示了三个采样点TP质量浓度在丰水期的变化情况.TP质量浓度高于0.1 mg/L可认为水体发生富营养化.整体来看,从DHN_1到DHN_3的TP呈现先上升然后急剧降低的趋势,在三个位点的TP平均值变化情况为0.63 mg/L(DHN_2)> 0.46 mg/L(DHN_1)>0.05 mg/L(DHN_3).从TP质量浓度水平来看,三个采样点中DHN_1和DHN_2的平均TP质量浓度高于0.1 mg/L,存在富营养化情况.在整个丰水期中,出口的TP质量浓度维持在较低水平.DHN_1和DHN_2的TP质量浓度都呈现七月初较低然后上升的趋势.DHN_1的TP质量浓度在8月中旬达到最高(0.61 mg/L),DHN_2的TP质量浓度也是在8月中旬达到最高(0.86 mg/L).综合TP和TN两种指标的的平均质量浓度来看,DHN_2的富营养化程度高,DHN_1的面呈中营养状态.

图5 水库中总磷质量浓度
2.2 察尔森水库微生物群落结构分析
根据 OTU 聚类分析结果,可以对 OTU 进行微生物多样性指数(Shannon、Simpson、Chao1 和 Ace指数)分析[21].如表3,其中:Shannon、Ace和Chao1三项指数值越大,表示物种的多样性越高.Simpson指数值越小,表示的物种多样性越高.

表3 样品多样性指数统计
对于表层水体中DHN_2Shannon、ace、chao指数较大,simpson指数较小,故DHN_2的生物多样性最高;对于底泥中DHN_5生物多样性最高.对比水质特征参数,与水温有相似的变化趋势,随着水温的逐渐升高,微生物的丰度也在增加,两者之间趋势呈正相关,随其他水质参数变化不明显.
Venn图是用来表示多个样本中独有的和共有的OTU数目的一种有效方法[22].不同的图代表不同的样本,重叠部分的数字代表多个分组中共有的物种数目,非重叠部分的数字代表对应分组所特有的物种数目[23];由图6可知,表层水质中3个点位共有的OUT数为258,共有OUT数为1 191,共有的OUT数占总数的21.67%.DHN_1、DHN_2两个点位共有OUT说为179,是重叠微生物较多的两个点位,两个点位具有相同功能的OUT数目很大.底泥微生物中3个点位共有的OUT数为702,共有OUT数为3 050,共有的OUT数占总数的23.02%.DHN_2、DHN_3两个点位共有OUT说为840,是重叠微生物较多的两个点位,两个点位具有相同功能的OUT数目很大,样本微生物组成较相似.
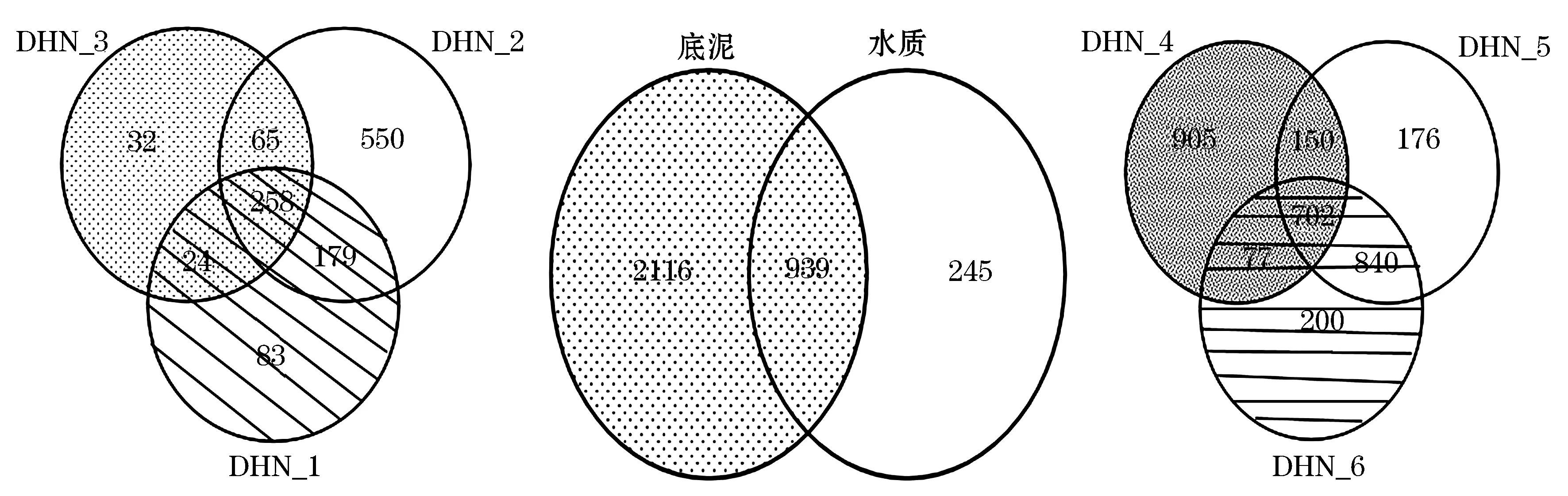
图6 样本分布Venn图
PCA分析,即主成分分析,是一种对数据进行简化分析的技术,不同形状的点代表不同分组的样本,两样本点越接近,表明两样本物种组成越相似[24].根据图7分析可知,水质样本DHN_1、DHN_2、DHN_3的物种组成相似度低,泥样本DHN_4、DHN_5、DHN_6的物种组成相似度较高.通过PCA分析研究对水质及底泥样本细菌群落组成差异.结果表明,水质及底泥样本微生物组成有明显差异,PC1轴和PC2轴对结果的解释度分别为53.55%和33.43%.

图7 主成分分析图
2.3 微生物群落结构解析
图8是属水平上的微生物群落的分布情况.6个样品在属水平下的微生物组成具有较高的多样性,共有714个属组成.表层水体(属水平)共有465个属组成;水库底泥共有652个属组成.由图8可知,水体和底泥中的优势菌属明显不同.在表层水体中丰度较高的菌属是:hgcl-clade、黄杆菌属(Flavbacterium)、CL500-29-marine-grup、Limnohabitans、红育菌属(Rhodoferax)、极地单胞菌属(Polaromonas)、Pseudarcicella、Emticicia.在底泥中丰度较高的菌属是:鞘氨醇单胞菌属(Sphingomonas)、norank_o__Acidobacteriales、黄杆菌属(Flavbacterium)、芽孢杆状菌(Bacillus)、norank_c__Subgroup_6、norank_o__Gaiellales、马赛菌属(Massilia)、norank_c__KD4-96、大豆根瘤菌属(Bradyrhizobium)、Candidatus_Solibacter.
水体中的微生物多样性分析结果如图8显示,水体中丰度较高的菌属在三个样本中分布情况明显不同.hgcl-clade在DHN_1和DHN_2、DHN_3中的丰度分别为12.6%、11.4%、29.7%,黄杆菌属(Flavbacterium)在DHN_1和DHN_2、DHN_3中的丰度分别为5.5%、14.9%、12.3%.CL500-29-marine-grup在DHN_1和DHN_2、DHN_3中的丰度分别为5.2%、3.3%、9.6%.Limnohabitans在DHN_1和DHN_2、DHN_3中的丰度分别为3.9%、6.4%、4.8%.由此推测优势菌群的分布是引起DHN_1、DHN_2及DHN_3差异性较大的主要原因.在DHN_1中不动杆菌属(Acinetbcter)的丰度最高,占41.3%,在DHN_2和DHN_3中不动杆菌属(Acinetbcter)的丰度极低,不足1%.不动杆菌(Acinetbcter)广泛分布在水体和土壤中,有研究表明其在好氧条件下具有脱氮除磷的作用[25].黄杆菌属(Flavbacterium)也是典型的好氧菌[26].周石磊等人的研究表明Limnohabitans是与氮循环相关的β变形菌门[27].王鹏等研究发现赣江水库中丰度最高的菌属为hgcl_clade(16.39%),其次为CL500-29_marine_group(8.48%)[28],在察尔森水库表层水体样品中也同样发现了与赣江水库相同的菌属:hgcl_clade、CL500-29_marine_group.
底泥中的微生物多样性分析结果如图8显示,在三个采样点的底泥中微生物群落存在较大差异.黄杆菌属(Flavbacterium)DHN_4和DHN_5、DHN_6中的丰度分别为0.1%、2.1%、9.2%;norank_c_Subgroup_6在DHN_4和DHN_5、DHN_6中的丰度分别为6.6%、2.3%、1.7%;鞘氨醇单胞菌属(Sphingomonas)在DHN_4和DHN_5、DHN_6中的丰度分别为2.1%、8.0%、3.2%;norank_c_KD4-96在DHN_4和DHN_5、DHN_6中的丰度分别为3.1%、2.5%、1.6%;norank_o_Gaiellales在DHN_4和DHN_5、DHN_6中的丰度分别为1.5%、4.0%、3.3%.有相关研究表明这几个菌属是土壤中常见的菌属[29-30].经有关研究重庆三峡库区两种不同类型消落带土壤中均存在大量异养氨氧化细菌.在计数的同时成功分离得到了一大批具有硝化活性的异养菌株.从中选择活性较强且稳定的菌株E作为供试菌株进行了后续研究.经鉴定供试菌株E为鞘氨醇单胞菌属(Sphingomonas)中的菌株(Sphingomonassp.),鞘氨醇单胞菌属(Sphingomonas)具有代谢多种碳源的能力,是常见的对氮素有一定转化作用的菌属[31].在三个底泥样本中,DHN_2的鞘氨醇单胞菌属(Sphingomonas)含量最高,因此推测,DHN_2的鞘氨醇单胞菌属(Sphingomonas)对氮素有一定的转化作用.
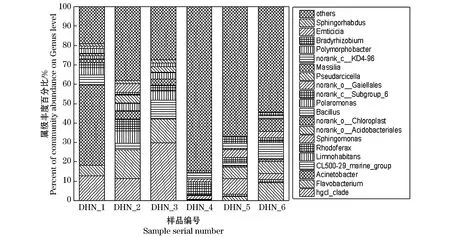
图8 属水平下的细菌群落组成
3 结 论
1)察尔森水库存在富营养化现象.DHN_1、DHN_2、DHN_3的水质状况在COD等多项指标上相差不大,但三处的TN、TP质量浓度均超出Ⅲ类标准,其中DHN_2的TN、TP质量浓度最高.
2)察尔森水库DHN_1、DHN_2、DHN_3的水体优势微生物菌属是:hgcl-clade、黄杆菌属(Flavbacterium)、CL500-29-marine-grup、Limnohabitans、红育菌属(Rhodoferax)、极地单胞菌属(Polaromonas)、Pseudarcicella、Emticicia.其中hgcl-clade菌属丰度最高,在DHN_1、DHN_2、DHN_3含量占12.6%、11.4%、29.7%.察尔森水库DHN_4、DHN_5、DHN_6的底泥优势微生物菌属是:鞘氨醇单胞菌属(Sphingomonas)、norank_o_Acidobacteriales、黄杆菌属(Flavbacterium)、芽孢杆状菌(Bacillus)、norank_c_Subgroup_6、norank_o_Gaiellales、马赛菌属(Massilia)、norank_c_KD4-96、大豆根瘤菌属(Bradyrhizobium),其中鞘氨醇单胞菌属(Sphingomonas)菌属丰度最高,在DHN_4、DHN_5、DHN_6含量占2.1%、8.0%、3.2%.
3)微生物多样性结果表明,环境因子氮、磷与微生物多样性之间具有显著的正相关性,DHN_2与DHN_3更相近,说明DHN_1对水库整体影响较小.

