辣蓼黄酮乙酸乙酯部分干预LPS诱导RAW264.7炎症反应机制
刘梦倩,陶俊宇,胡雯月,韦英益,胡庭俊
(1.广西大学动物科学技术学院,广西南宁 530005;2.广西医科大学基础医学院,广西南宁 530021;3.上海交通大学生命科学技术学院,上海 200030)
辣蓼黄酮是中草药辣蓼的一种有效成分。研究表明,辣蓼黄酮能降低LPS诱导的内毒素血症对小鼠造成的多脏器损伤[1-2]。辣蓼黄酮能降低脂多糖(LPS)诱导的RAW264.7炎性因子分泌[3]。过量的LPS可激活单核巨噬细胞,并通过细胞内的丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPKs)和核转录因子(nuclear factor-κB,NF-κB)两条信号转导通路活化多种炎性因子[4]。在炎症反应中,激活的NF-κB会引起一氧化氮合酶(iNOS)、环氧合酶2型(COX-2)以及肿瘤坏死因子α(TNF-α)等多种炎症因子的表达[5-6]。同时,MAPKs家族参与细胞生长、细胞分化、细胞死亡和免疫反应等多种生理活动的p38、ERK与JNK也会被炎症因子激活[7]。研究表明,JNK可保护细胞不受TNF-α诱导的凋亡,对细胞凋亡起着重要的调节作用[8]。活化的JNK可以使c-Jun的ser63和ser73位点发生磷酸化,从而合成诱生型iNOS和TNF-α的特异性转录激活因子AP-1。AMPK是炎性调节因子,其催化亚基AMPKα1在脂肪组织和巨噬细胞中有着较高的表达量,活化的AMPKα1可以抑制巨噬细胞的炎性[9]。本研究旨在通过构建体外炎症模型,测定炎症相关蛋白和磷酸化水平,探究辣蓼黄酮乙酸乙酯部分(FEA)对LPS诱导的RAW264.7炎症反应的调节机制。
1 材料与方法
1.1 材料
1.1.1 主要试剂 脂多糖,Sigma公司产品;iNOS(D6B6S)兔抗单克隆抗体、COX2(D5H5)兔抗单克隆抗体、MAPK family antibody sampler kit 试剂盒、Phospho-MAPK family antibody sampler kit 试剂盒、AMPKα(D5A2)兔抗单克隆抗体、Phospho- AMPKα(Three172)(40H9)兔抗单克隆抗体、c-Jun(60A8)兔抗单克隆抗体、Phospho-c-Jun(Ser73)兔抗单克隆抗体、β-Actin(13E5)兔抗单克隆抗体、GADPH(14C10)兔抗单克隆抗体、辣根过氧化物酶连接的抗兔IgG,美国Cell Signaling Technology公司产品;complete tablets EDTA-free蛋白酶抑制剂、phosSTOP磷酸酶抑制剂,瑞士罗氏公司产品;BCA蛋白定量试剂盒、10×TBST、Western抗体稀释液、蛋白膜再生液、丽春红染色试剂、考马斯亮蓝染液,北京康为世纪生物科技有限公司产品。
1.1.2 主要仪器 二氧化碳培养箱(C150),德国BINDER公司产品;细胞超声破碎仪(JY92-ⅡD),宁波新芝生物科技股份有限公司产品;纯水仪(CD-UPT-1),成都纯越科技有限公司产品;微量离心机(TYPE1-14),SIGMA公司产品;超声波清洗机(DTDN),宁波新芝生物科技有限公司产品;倒置显微镜(TS100),Nikon公司产品;摇床(TS-100C),上海天呈公司产品;垂直电泳槽(Mini-Protein Tetra System),BIO-RAD公司产品;蛋白半干转系统(TRANS-BLOT SD),Bio-Rad公司产品;蛋白成像系统(Chemi Doc MP),BIO-RAD公司产品。
1.2 方法
1.2.1 药品制备 辣蓼黄酮乙酸乙酯部分(FEA),广西大学动物科学技术学院药理实验室采用酶解-超声偶联法提取后的滤液,经过石油醚、氯仿、乙酸乙酯萃取,收集乙酸乙酯部分,经XDA-8大孔吸附树脂分离纯化,得辣蓼黄酮乙酸乙酯部分 (FEA)。将得到的FEA通过高效液相色谱法(HPLC)测定其中芦丁、槲皮素和槲皮苷的含量。再以芦丁为参比物,采用紫外分光光度法测定了所得FEA中总黄酮的含量。
1.2.2 细胞处理与分组 将处于对数生长期的RAW264.7消化后轻轻吹打至单个细胞,调节浓度至2×105个/mL,每孔100 μL加至96孔板中,用100 mL/L FBS的DMEM维持培养液培养过夜。弃去上清,空白对照组加入维持培养基,模型组加入含LPS终浓度为1.0 μg/mL的维持培养基,药物处理组加入含40 μg/mL、80 μg/mL FEA的维持培养基与细胞孵育2 h、4 h之后弃去上清,再加入含LPS终浓度为1.0 μg/mL的维持培养基,2 h(测MAPK、AMPKα或c-Jun及其磷酸化)或24 h(测iNOS与COX-2)时收集细胞样品。
1.2.3 蛋白样品制备 按1.2.2所述处理细胞后,用预冷的PBS洗1次,轻轻吹下收集于EP管中,2 000 r/min离心5 min,弃去上清,加入RIPA(1∶1)细胞裂解液、蛋白酶抑制剂(1∶100)和磷酸酶抑制剂(1∶1 000)冰上裂解20 min,用超声破碎仪超声处理样品,防止样品黏稠,分装后-80℃保存。使用前用蛋白测定试剂盒测定各样本蛋白浓度,使浓度保持一致,加入2×Loading buffer。EP管加封口膜,沸水浴煮沸5 min,4℃、12 000 r/min离心5 min,取上清待测。
1.2.4 iNOS与COX-2的检测 按1.2.2所述处理细胞并按1.2.3所述制备蛋白样,上样50 μg蛋白。iNOS蛋白使用80 g/L的SDS-PAGE胶分离1.5 h,并在3 mA/cm2的恒流状态下半干转75 min;COX-2蛋白用100 g/L的SDS-PAGE胶分离1 h,并在1.5 mA/cm2的恒流状态下半干转1 h。用BSA在37℃下封闭1 h。一抗4℃孵育过夜,PBST洗3次,37℃下二抗孵育1 h,PBST洗3次,显影。
1.2.5 AMPKα与磷酸化AMPKα的检测 按1.2.2所述处理细胞并按1.2.3所述制备蛋白样,上样50 μg蛋白。使用100 g/L的SDS-PAGE胶分离1 h,并在1.5 mA/cm2的恒流状态下半干转45 min。用BSA 37℃下封闭1 h。一抗4℃孵育过夜,PBST洗3次,37℃下二抗孵育1 h,PBST洗3次,显影。
1.2.6 MAPK家族ERK、JNK、p38及其相应蛋白磷酸化的检测 按1.2.2所述处理细胞并按1.2.3所述制备蛋白样,上样50 μg蛋白。ERK与p-ERK蛋白用100 g/L的SDS-PAGE胶分离1 h,并在1.5 mA/cm2的恒流状态下半干转35 min;SAPK/JNK与p-SAPK/JNK用100 g/L的SDS-PAGE胶分离1.5 h,并在1.5 mA/cm2的恒流状态下半干转40 min;P38与p-P38用120 g/L的SDS-PAGE胶分离45 min,并在1.5 mA/cm2的恒流状态下半干转30 min;用BSA 37℃下封闭1 h。一抗4℃孵育过夜,PBST洗3次,37℃下二抗孵育1 h,PBST洗3次,显影。
1.2.7 c-Jun与磷酸化c-Jun的检测 按1.2.2所述处理细胞并按1.2.3所述制备蛋白样,上样50 μg蛋白。c-Jun与p-c-Jun用100 g/L的SDS-PAGE胶分离1 h,并在1.5 mA/cm2的恒流状态下半干转35 min。用BSA 37℃下封闭1 h。一抗4℃孵育过夜,PBST洗3次,37℃下二抗孵育1 h,PBST洗3次,显影。
2 结果
2.1 iNOS蛋白的表达
由图1可知,与空白对照组相比,LPS刺激24 h后的模型组的iNOS蛋白表达水平均极显著升高;而用40 μg/mL、80 μg/mL的FEA预处理RAW264.7 2 h和4 h后均能极显著降低iNOS蛋白的表达。表明FEA预处理RAW264.7能极显著抑制LPS诱导的RAW264.7中iNOS蛋白的表达。
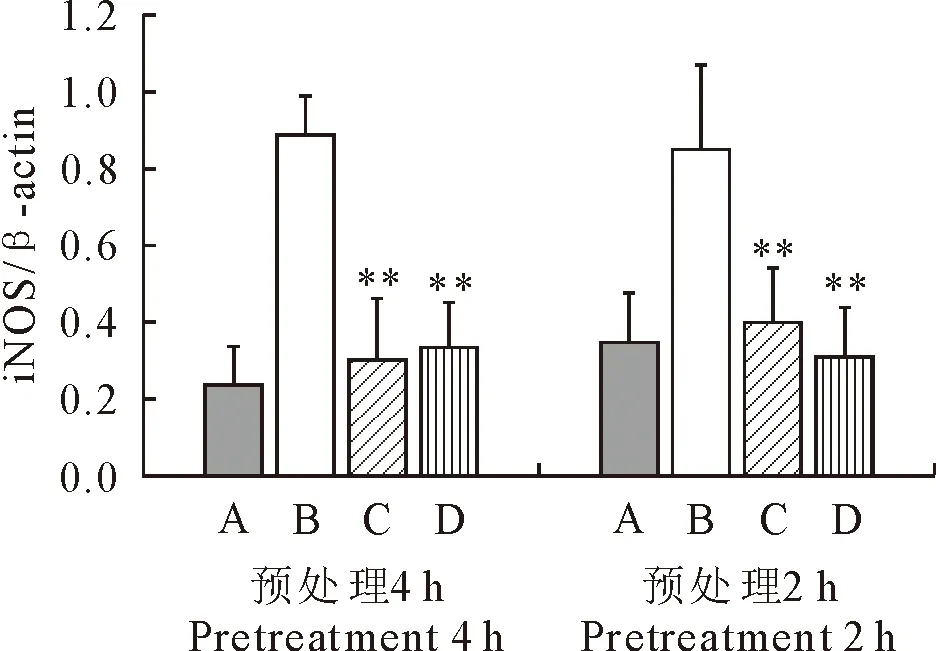
A.空白对照组;B.LPS模型组;C.40 μg/mL FEA处理组;D.80 μg/mL FEA处理组;*表示与LPS模型组相比,差异显著(P<0.05),**表示与LPS模型组相比,差异极显著(P<0.01)
2.2 COX-2蛋白的表达
由图2可知,与空白组相比,LPS刺激24 h后,模型组的COX-2蛋白表达水平均极显著升高;用80 μg/mL的FEA预处理RAW264.7 2 h和4 h后均能显著降低COX-2蛋白的表达水平。表明用80 μg/mL的FEA预处理后能显著抑制LPS诱导的RAW264.7中COX-2蛋白的表达。
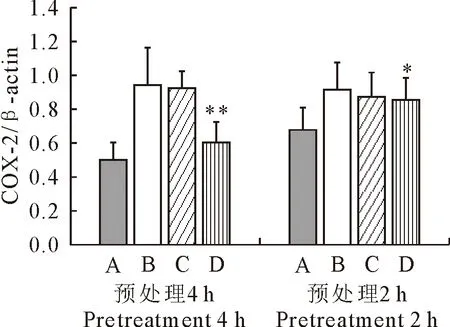
A.空白对照组;B.LPS模型组;C.40 μg/mL FEA处理组;D.80 μg/mL FEA处理组;*表示与LPS模型组相比,差异显著(P<0.05),**表示与LPS模型组相比,差异极显著(P<0.01)
2.3 磷酸化AMPK的表达
由图3可知,FEA预处理RAW264.72 h后,LPS组与空白组相比p-AMPKα/AMPKα的蛋白表达比值无显著差异;FEA处理组与LPS组相比,80 μg/mL的FEA能显著增加p-AMPKα/AMPKα的比值。FEA预处理RAW264.74 h后,LPS组与空白组相比,p-AMPKα/AMPKα的蛋白表达比值显著降低,FEA处理组与LPS组相比,40 μg/mL和80 μg/mL 的FEA能极显著增加p-AMPKα/AMPKα的比值。表明FEA预处理能显著增加LPS诱导的RAW264.7中磷酸化AMPK的表达水平。
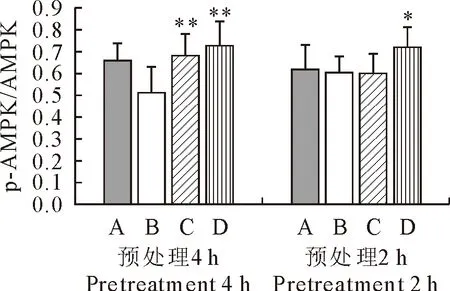
A.空白对照组;B.LPS模型组;C.40 μg/mL FEA处理组;D.80 μg/mL FEA处理组;*表示与LPS模型组相比,差异显著(P<0.05),**表示与LPS模型组相比,差异极显著(P<0.01)
2.4 磷酸化ERK的表达
由图4可知,与空白组相比,LPS刺激2 h后模型组的p-ERK/ERK水平均极显著升高。分别用40 μg/mL和80 μg/mL的FEA预处理RAW264.7 2 h后能极显著抑制p-ERK/ERK水平。用80 μg/mL的FEA预处理RAW264.7 4 h后,极显著增加了p-ERK/ERK水平。表明FEA预处理2 h能极显著抑制LPS诱导的RAW264.7中磷酸化ERK的表达。

A.空白对照组;B.LPS模型组;C.40 μg/mL FEA处理组;D.80 μg/mL FEA处理组;*表示与LPS模型组相比,差异显著(P<0.05),**表示与LPS模型组相比,差异极显著(P<0.01)
2.5 磷酸化P38的表达
由图5可知,与空白组相比,LPS刺激2 h后,模型组的p-P38/P38水平有所升高,但差异不显著。分别用40 μg/mL和80 μg/mL的FEA预处理RAW264.7 2 h后增加了p-p38/p38水平,但差异仍然不显著。分别用40 μg/mL和80 μg/mL的FEA预处理RAW264.7 4 h后,能极显著降低p-p38/p38水平。表明FEA预处理RAW264.7 4 h后,能极显著抑制LPS诱导的细胞内磷酸化P38的表达。

A.空白对照组;B.LPS模型组;C.40 μg/mL FEA处理组;D.80 μg/mL FEA处理组;*表示与LPS模型组相比,差异显著(P<0.05),**表示与LPS模型组相比,差异极显著(P<0.01)
2.6 磷酸化JNK的表达
由图6可知,与空白组相比,LPS刺激2 h后模型组p-JNK/JNK水平极显著的升高,而用80 μg/mL的FEA预处理RAW264.7 2 h和4 h后均能极显著抑制p-JNK/JNK水平。表明80 μg/mL FEA预处理后极显著抑制了LPS诱导的RAW264.7中磷酸化JNK的表达。
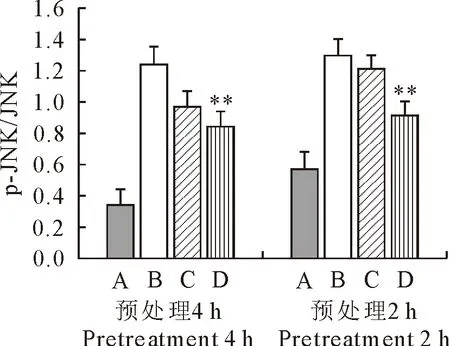
A.空白对照组;B.LPS模型组;C.40 μg/mL FEA处理组;D.80 μg/mL FEA处理组;*表示与LPS模型组相比,差异显著(P<0.05),**表示与LPS模型组相比,差异极显著(P<0.01)
2.7 磷酸化c-Jun的表达
由图7可知,与空白组相比,LPS刺激下2 h后模型组c-Jun磷酸化水平均极显著升高,用80 μg/mL的FEA预处理RAW264.7 2 h后能降低磷酸化c-Jun的表达水平,但差异不显著;用80 μg/mL的FEA预处理RAW264.7 4 h后能极显著抑制磷酸化c-Jun的表达水平。表明80 μg/mL的FEA预处理4 h后极显著抑制了LPS诱导的RAW264.7中磷酸化c-Jun的表达。
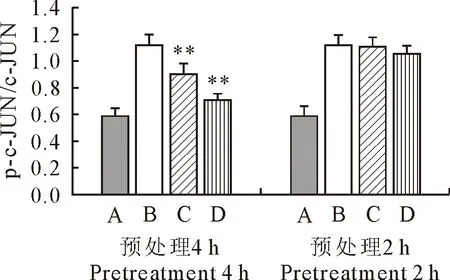
A.空白对照组;B.LPS模型组;C.40 μg/mL FEA处理组;D.80 μg/mL FEA处理组;*表示与LPS模型组相比,差异显著(P<0.05),**表示与LPS模型组相比,差异极显著(P<0.01)
3 讨论
辣蓼是我国分布较广的一种传统中草药,具有祛风利湿,散淤止痛,解毒消肿等功效。辣蓼全草的主要成分为鞣质、黄酮类和挥发油,其中总黄酮部分是辣蓼发挥抗氧化、抗炎和抗病毒作用的主要活性成分[10-12]。近年来有关辣蓼黄酮生物活性的研究较多,周淑棉等[13]为探究辣蓼黄酮正丁醇部分(FNB)体外抗猪繁殖与呼吸综合征病毒(PPRSV)的效果,采用不同浓度的FNB作用于PPRSV毒株感染的Marc-145细胞后发现,使用FNB处理后的药物组细胞存活率显著高于病毒组细胞,结果说明不同浓度的FNB可以抑制PPRSV的大量繁殖,从而提高Marc-145细胞的存活率,显示出抗猪繁殖与呼吸综合征病毒的作用。赵雅媚等[14]为探究总黄酮体外抗氧化活性,采用热回流提取辣蓼总黄酮测定其对DPPH和羟基自由基的清除率后发现,辣蓼黄酮的浓度越高对DPPH和羟基自由基的清除率越高,证明辣蓼黄酮的抗氧化特性。辣蓼黄酮的抗炎效果也是近年来讨论的焦点,由于目前临床上治疗炎症的药物对肾脏的损害很大,而辣蓼属于天然药物,在治疗疾病时相较于人工合成的西药副作用小,使用起来也更加安全[15-16]。前期已证实辣蓼黄酮正丁醇部分和乙酸乙酯部分具有良好的抗炎效果[3],而有关于辣蓼黄酮乙酸乙酯部分抑制炎症反应分子机制的研究尚未见报道。
有研究表明[17],人与小鼠的神经元细胞中,激活腺苷酸激活蛋白激酶(AMPK)有助于提高抗炎药物的作用,因此激活AMPK被认定为炎症进程被抑制的标志之一。炎症相关试验中常以LPS诱导RAW264.7构建炎症模型,通过测定炎症反应中相关蛋白的表达水平推断该炎症反应中的分子机制。有研究表明,当LPS刺激RAW264.7构建炎症模型后,LPS会激活MAPK通路中的p38、ERK与JNK。这3个MAPK亚基的激活导致iNOS和COX-2蛋白的高表达[18]。再者p38、ERK与JNK的激活直接或间接的使Elk-1,c-Jun以及ATF-1磷酸化[19]。活化的JNK分子会磷酸化c-Jun的ser63和ser73位点并激活c-Jun[20]。通过LPS刺激RAW264.7构建炎症模型,测定细胞内iNOS、COX-2蛋白表达和相关蛋白磷酸化水平即可判断该炎症反应可能的分子机制。
本试验为探究辣蓼黄酮乙酸乙酯部分(FEA)对炎性反应干预的分子机制,采用LPS诱导RAW264.7构建炎症模型,测定细胞内iNOS和COX-2的表达水平,以及AMPK、ERK、P38、JNK、c-Jun及其相应蛋白磷酸化水平,从而推断可能的干预机制。结果表明,在一定给药剂量或是孵育时间的情况下,FEA预处理均能抑制LPS诱导的p38、ERK与JNK的磷酸化,从而减缓细胞的炎症反应。其中80 μg/mL的FEA预处理抑制LPS诱导的JNK的磷酸化效果更好,FEA预处理孵育2 h能抑制LPS诱导的ERK磷酸化效果更好。试验还表明,FEA不仅能抑制MAPK家族JNK的磷酸化,还能抑制JNK的反应底物c-Jun的磷酸化,这也许是FEA抗炎活性的主要作用靶点之一。
综上所述,辣蓼黄酮乙酸乙酯部分(FEA)对LPS诱导的RAW264.7具有抗炎作用,其作用机制可能与抑制细胞内iNOS与COX-2蛋白的高表达、抑制MAPKs信号通路p38、ERK与JNK的磷酸化和增加磷酸化AMPK的表达水平有关。

