穿膜肽与抗猪流行性腹泻病毒膜蛋白单域抗体融合表达和入胞活性分析
李 丽,张辛铭,尹双辉,张涛涛,杨顺利,薛慧文
(1.甘肃农业大学动物医学院,甘肃兰州 730070;2.中国农业科学院兰州兽医研究所/家畜疫病病原生物学国家重点实验室,甘肃兰州 730046;3.石家庄市兽用生物制品供应站,河北石家庄 050027)
猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV) 属于尼多病毒目(Nidovirales)、冠状病毒科(Coronaviridae)、冠状病毒属(Coronavirus)成员,是引起猪流行性腹泻(Poreine epidemic diarrhea,PED)的病原。PED是一种急性接触性传染病,病猪的主要特征为腹泻、呕吐和脱水,对哺乳仔猪具有较高致死率。流行病学调查表明,PEDV已经遍及全球,给养猪业造成巨大损失[1-2]。膜蛋白(M)在PEDV结构蛋白中含量最多,在补体共同作用下能够诱导机体产生中和抗体。M蛋白编码基因与其它冠状病毒的M基因有较低的相似性,但是在不同PEDV毒株间具有较高的相似性。因此,M蛋白是PEDV检测以及病原成像等研究的理想靶标蛋白。
驼科和软骨鱼等动物体内存在着一种天然缺失轻链、仅有重链的抗体,称之为重链抗体(heavy chain antibodies,HCAbs)[3]。这类抗体仅通过重链可变区形成的结构来特异性识别和结合抗原,故称此可变区结构片段为单域抗体(single domain antibody,sdAb)。sdAb是目前可以得到的具有完整功能的最小抗体分子,分子质量仅15 ku,是单克隆抗体分子质量的1/3,又称为纳米抗体(nanobody)。sdAb具有结构简单易于基因工程改造,容易重组表达、高水溶性、耐高温和极端pH等独特性质[4-5]。此外,sdAb具有较强的组织渗透性,甚至能通过血脑屏障[6-7],在肿瘤成像、肿瘤治疗和小分子抗体治疗药物研发等领域具有广阔应用前景[8-11]。本实验室前期筛选到了M蛋白特异性sdAb,并证实其具有较好的PEDV结合活性,在PEDV检测和分离方面具有较好的应用价值。然而,由于sdAb不具有自主进入动物细胞的特性,限制了其在治疗性抗体研发以及PEDV成像示踪方面的应用。
细胞穿膜肽(cell penetrating peptides,CPPs)也称为蛋白质转导结构域,是一类含有约5~30个氨基酸的短肽,自身具有跨膜转运功能,能够携带核酸、蛋白质等生物大分子进入细胞发挥功能,且没有细胞毒性。TAT短肽(transactivator)是人类免疫缺陷病毒1型(HIV-1)的反式激活因子,是最早被报道的CPPs[12]。目前,TAT短肽已经被用作向细胞内递送包括小分子核酸(DNA、RNA和siRNA)、多肽、蛋白质、病毒、成像剂、药物以及各种纳米颗粒等的有效工具。
本研究将TAT穿膜肽与抗PEDV膜蛋白M的特异性sdAb进行融合表达,获得带有TAT短肽的重组sdAb(TAT-sdAb)。用ELISA方法检测TAT-sdAb与M蛋白的结合活性,通过免疫荧光技术分析TAT-sdAb进入Vero细胞的特性,并对TAT-sdAb与细胞内的PEDV进行共定位。本研究获得的具有穿膜活性和抗原结合活性的重组TAT-sdAb,为PEDV感染的活细胞检测和示踪提供了材料基础,为治疗性sdAb的研发提供了参考。
1 材料与方法
1.1 材料
1.1.1 主要试剂 限制性内切酶BamHⅠ和XholⅠ,英国NEB公司产品;胶回收试剂盒、质粒提取试剂盒和大肠埃希氏菌感受态细胞,中国全式金生物公司产品;0.45 μm滤膜,美国Millipore公司产品;异丙基-β-d-硫代半乳糖苷(IPTG),上海生工生物工程有限公司产品;His-tag纯化树脂,德国Qiagen公司产品;多聚甲醛固定液,中国索莱宝生物公司产品;HRP和FITC标记抗His-tag抗体,TRITC标记抗鼠抗体,美国Abcam公司产品;DMEM培养基,美国Hyclone公司产品;胎牛血清,中国四季青公司产品;细胞培养瓶、激光共聚焦显微镜观察实验用培养皿(24 mm),美国Corning公司产品;pET-32a表达载体、PEDV核蛋白单克隆抗体、膜蛋白特异性sdAb和重组表达的PEDV M蛋白,中国农业科学院兰州兽医研究所猪禽消化道感染和黏膜免疫研究创新团队实验室保存;其他常规试剂为国产分析纯。
1.1.2 主要仪器 CO2细胞培养箱(HERAcell vios 160i),Thermo Fisher Scientific公司产品;蛋白电泳仪(PowerPac)和酶标仪(iMark),Bio-Rad公司产品;超声波破碎仪(SCIENTZ-950E),宁波新芝生物科技股份有限公司产品;激光共聚焦显微镜(TCS SP8X),Leica公司产品。
1.2 方法
1.2.1 PEDV特异性单域抗体与穿膜肽的融合表达及与M蛋白结合活性分析 将TAT穿膜肽基因与实验室保存的抗PEDV M蛋白的特异性单域抗体sdAb-Mc30(MH550666)[13]基因,通过引物延伸方法融合,并利用BamHⅠ和XholⅠ酶切位点克隆到pET-32a表达载体,连接产物转化到大肠埃希氏菌(DH5α)感受态细胞,挑选阳性克隆并进行测序分析,阳性质粒命名为32a-TAT-sdAb,转化到大肠埃希氏菌BL21(DE3)感受态细胞中,过夜培养后,挑取单菌落接种到新鲜Lysogeny broth(LB)培养基(含100 μg/mL ampicillin),37℃振荡培养过夜,次日按照体积比1%接种量,将菌转接至新鲜LB培养基(含100 μg/mL ampicillin)中,振摇至OD 600 nm值约为0.6~0.8,加入终浓度分别为0.001 moL/L、0.002 moL/L、 0.005 moL/L和0.01 moL/L的IPTG,25℃诱导12 h后,8 000 r/min离心收集菌体。用120 g/L聚丙烯酰胺凝胶电泳(SDS-PAGE)分析。
确定目的蛋白表达以及最佳的IPTG诱导浓度后,大量诱导重组表达菌,收集菌体。用Tris-HCl缓冲液(pH8.0)重悬重组菌,置冰上用超声仪进行细胞裂解,然后12 000 r/min、4℃离心10 min,收集上清。上清液用0.45 μm滤膜过滤并加入到装有His蛋白纯化树脂(Ni-NTA agarose resin)的亲和层析柱,按操作说明进行目的蛋白纯化。获得的蛋白样品进行SDS-PAGE电泳分析,然后用透析袋更换溶解缓冲液为磷酸盐缓冲液(PBS,pH 8.0),用Nanodrop 2000超微量分光光度计测浓度后,分装,-80℃保存。
参照已报道的ELISA方法[13],稀释重组TAT-sdAb和sdAb至终浓度分别为10 μg/mL、5 μg/mL、2.5 μg/mL、1.25 μg/mL、0.63 μg/mL、0.32 μg/mL、0.16 μg/mL和0 μg/mL,检测不同浓度TAT-sdAb与M蛋白的结合活性。
1.2.2 TAT-sdAb穿膜活性分析 利用间接免疫荧光方法(IFA)分析TAT介导sdAb穿膜进入细胞的过程。Vero细胞用DMEM培养基传代培养(含10%胎牛血清、100 IU/mL青霉素和100 μg/mL链霉素),在37℃、5% CO2条件下培养。将细胞传代至激光共聚焦显微镜观察用培养皿(24 mm),培养至70%~80%细胞汇合,用无血清DMEM培养基洗3次,加入1 mL的DMEM,同时加入TAT-sdAb至终浓度为50 μg/mL,在37℃、5% CO2共孵育3 h;弃掉培养液,PBS洗5次,40 g/L多聚甲醛室温固定10 min,1 mL/L Triton X100的PBS透膜10 min。固定后的细胞与FITC标记的抗His-tag抗体(1∶3 000稀释)室温孵育1 h,DAPI染核5 min,最后用PBS洗5次,激光共聚焦显微镜下观察。
1.2.3 TAT-sdAb的最适使用剂量分析 将Vero细胞传代至激光共聚焦显微镜观察用培养皿培养至70%~80%细胞汇合,用无血清DMEM培养基洗3次,然后加入1 mL的DMEM,并分别加入TAT-sdAb至终浓度为0 μg/mL、1 μg/mL、10 μg/mL、50 μg/mL和100 μg/mL,设置相同浓度的sdAb为试验对照,在37℃、5% CO2条件下培养3 h。细胞洗涤并固定,与FITC标记的抗His-tag抗体以及DAPI染料孵育,PBS洗涤,激光共聚焦显微镜下观察。
1.2.4 TAT-sdAb的最适作用时间分析 将Vero细胞传代至共聚焦显微镜观察实验用培养皿,培养至70%~80%细胞汇合,分别加入TAT-sdAb至终浓度为50 μg/mL,在37℃、5% CO2,分别培养0 h、0.5 h、1 h、3 h和5 h;设置不加TAT-sdAb的空白细胞对照。细胞洗涤并固定,与FITC标记的抗His-tag抗体以及DAPI染料孵育,PBS洗涤,激光共聚焦显微镜下观察。
1.2.5 TAT-sdAb与PEDV胞内共定位 将Vero细胞传代至激光共聚焦显微镜观察用培养皿接种0.5 MOI的PEDV疫苗株(CV777),培养12 h,用无血清DMEM培养基洗3次,加入1 mL的DMEM,同时加入TAT-sdAb至终浓度为50 μg/mL,继续培养3 h。随后洗涤并固定细胞,分别与FITC标记的抗His-tag抗体、抗PEDV核蛋白单克隆抗体、TRITC标记抗鼠二抗以及DAPI染料孵育,PBS洗涤,激光共聚焦显微镜下观察。
2 结果
2.1 TAT-sdAb的表达、纯化及结合活性分析
将PEDV特异性sdAb与TAT融合,构建表达载体32a-TAT-sdAb,并转化到大肠埃希氏菌感受态细胞(DE3)。加入不同终浓度IPTG诱导,SDS-PAGE鉴定发现,诱导组均能观察到大小约为35 ku的特异性条带,与预测目标蛋白大小相符;利用His-tag蛋白纯化树脂进行纯化,可获得特异性的蛋白条带(图1);ELISA试验证实不同稀释度的TAT-sdAb与sdAb具有相似的M蛋白结合活性,表明融合TAT并未影响sdAb的抗原结合活性(图2)。

M.蛋白分子质量标准;1~4.空白质粒对照;5~8.0.001 moL/L、0.002 moL/L、0.005 moL/L和0.01 moL/L IPTG诱导条件下表达菌,白色箭头所指为目的条带;9 .目的蛋白纯化。

图2 ELISA方法分析TAT-sdAb的抗原结合活性分析
2.2 TAT-sdAb穿膜活性分析
为了验证TAT能否有效介导sdAb进入细胞,分别向Vero细胞中加入TAT-sdAb和sdAb共孵育,利用IFA方法通过激光共聚焦显微镜观察细胞内TAT-sdAb和sdAb的分布特征。结果观察到在TAT-sdAb共孵育Vero细胞的胞质中有明显的荧光,而与sdAb共孵育的对照细胞内未观察到明显的荧光。结果表明融合TAT短肽,使TAT-sdAb具备了穿透细胞膜进入Vero细胞的活性(图3)。
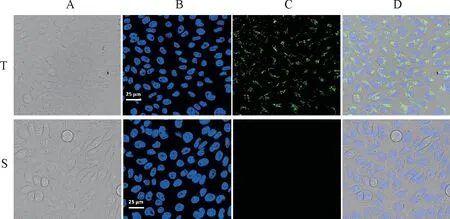
A.白光观察的细胞;B.360 nm观察的细胞;C.488 nm观察的细胞;D.合并观察的细胞; T.TAT-sdAb处理组; S.sdAb处理组
2.3 TAT-sdAb的最适使用剂量分析
为了确定TAT-sdAb穿膜的最佳使用剂量,将不同量的TAT-sdAb与Vero细胞共孵育,IFA方法检测细胞内TAT-sdAb的变化(图4)。结果发现,随着TAT-sdAb蛋白量的增加,Vero细胞内的荧光分布范围逐渐变大,荧光强度也随之增加,在使用浓度为50 μg/mL和100 μg/mL时荧光较为明显,而sdAb对照组则未见明显荧光。结果说明TAT-sdAb穿膜进入Vero细胞的活性和效率与使用剂量成正相关,要达到理想的穿膜效果,使用浓度应大于50 μg/mL。
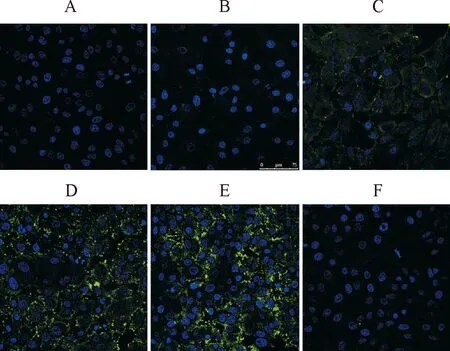
A.0 μg TAT-sdAb;B.1 μg TAT-sdAb;C.10 μg TAT-sdAb;
2.4 TAT-sdAb的最适作用时间分析
为了确定TAT-sdAb穿膜的最适孵育时间,将其与Vero细胞共孵育,IFA检测TAT-sdAb在细胞内的变化(图5)。结果发现,随着TAT-sdAb与细胞共孵育时间的延长,细胞内荧光点的分布范围逐渐变大,荧光强度增加;当第3 h时,荧光强度尤为明显。结果说明TAT-sdAb穿膜进入Vero细胞的活性和效率与作用时间成正相关,要达到理想的穿膜效果,作用时间应大于3 h。

A.空白对照;B.0 h;C.0.5 h;D.1 h;E.3 h;F.5 h
2.5 TAT-sdAb与PEDV在细胞内共定位
为了验证TAT-sdAb进入细胞后能否识别和结合PEDV,将TAT-sdAb与PEDV感染的Vero细胞孵育,用IFA方法进行共定位分析。结果发现TAT-sdAb(绿色荧光)进入细胞后,与胞内的PEDV(红色荧光)分布基本一致,在细胞膜和细胞质发生荧光重叠(图6)。结果表明TAT-sdAb进入细胞后能识别胞内的PEDV。
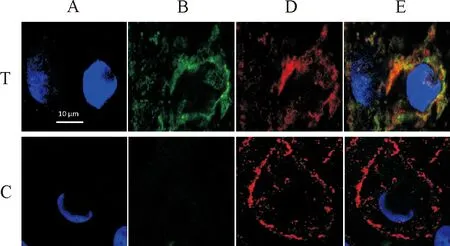
A.360 nm观察的细胞;B.488 nm观察的细胞;D.549 nm观察的细胞;E.合并观察的细胞; T.TAT-sdAb处理组; C.对照组
3 讨论
PEDV是威胁养猪业的重大病原,其传播的广泛性和对新生仔猪近100%的致死率,给我国养猪业造成了巨大的损失。本研究小组已经利用筛选到的PEDV膜蛋白特异性单域抗体(sdAb-Mcs),建立了PEDV检测和分离的方法[13]。为了进一步提高sdAb的研究适用性,本研究尝试构建带有穿膜肽的sdAb,旨在获得具有自主进入细胞活性的sdAb,从而拓宽sdAb的潜在应用。
sdAb是具备抗原结合能力的最小抗体,与传统抗体相比,sdAb还具有可溶性高、稳定性好、亲和力高、组织穿透力强以及容易大量生产等优点。在生物成像、胞内特定抗原示踪与检测、药物投递以及作为治疗性抗体等方面具有巨大应用潜力[14-16]。然而,在活细胞内特定抗原示踪成像、药物投递以及胞内病原治疗性抗体等应用中,通常需要sdAb具备较高的组织和细胞穿透活性。细胞穿膜肽(CPPs)是能够自主穿过细胞膜进入细胞的一类短肽,有介导sdAb进入细胞的巨大潜力。已有研究证实CPPs可通过内吞和直接穿透等机制运载蛋白质和核酸等生物大分子、成像剂、药物以及各种纳米颗粒进入细胞内发挥其效应功能[17-19]。CPPs具有生物相容性佳、对细胞造成的毒性小以及能与生物活性蛋白直接融合重组表达等优点,因此成为以胞内分子为靶标的药物递送技术发展的重要工具。TAT短肽是一类已经被广泛应用的富含碱性氨基酸的CPPs,具有强烈的穿透细胞膜能力[12]。鉴于此,本研究结合sdAb分子质量小、易于基因工程改造特性以及TAT短肽能穿过哺乳动物细胞膜特性,将sdAb基因与TAT短肽融合表达,成功获得能在大肠埃希氏菌中(E.coli)可溶性表达的重组TAT-sdAb蛋白。对TAT-sdAb的M蛋白结合活性分析表明,融合TAT并未影响sdAb的抗原结合活性。此外,每升LB培养液可获得超过5 mg的重组TAT-sdAb抗体(结果未展示),成本低廉,易于制备,能满足后续的各种应用需求。
研究发现,将蛋白质(如乙二醛酶蛋白和Smar蛋白等)与细胞穿膜肽TAT融合表达后,TAT能够以时间和剂量依赖的方式将这些蛋白质递送进入细胞中[20-21]。也有研究证实,将治疗性抗体与TAT融合,成功将治疗性抗体递送到细胞内[22]。本研究将TAT-sdAb与Vero细胞共孵育后,发现TAT-sdAb能够进入到Vero细胞内,其入胞效率与使用剂量和作用时间成正相关,这也与以前的研究报道相一致。对细胞内PEDV与TAT-sdAb共定位分析发现,进入细胞的TAT-sdAb与PEDV呈共定位分布,表明重组TAT-sdAb进入细胞后能识别胞内的PEDV病原。因此,TAT-sdAb有望成为PEDV感染细胞动态示踪研究中的有力工具。同时,TAT穿膜肽成功介导有病原结合活性的sdAb有效进入细胞,为具有特定活性小分子蛋白的细胞内传递提供更多数据参考。
总之,本研究将TAT穿膜肽与PEDV特异性sdAb进行了融合表达,获得了具有抗原结合活性的重组TAT-sdAb;进一步分析证实TAT-sdAb能够自主进入Vero细胞,并能识别细胞内的PEDV,为PEDV感染动态过程可视化研究提供了有力工具,同时也为治疗性单域抗体的细胞内递药提供更多参考。

