指纹图谱结合一测多评法评价艾纳香药材质量
宝艳儒,冯贻东,曾伟珍,叶文才,冯汉林*
(1.暨南大学药学院,广州510632;2.深圳海王医药科技研究院有限公司,深圳518057)
艾纳香为菊科植物艾纳香 (Blumea balsamifera)的干燥地上部分,主要分布于我国广西、贵州、广东、云南等省,是提取艾片的主要植物来源。艾纳香性辛、苦,温,具有温中活血、祛风除湿、消炎镇痛之功效[1]。现代化学及药理学研究表明艾纳香主要含有黄酮、萜类、以及皂苷类成分,具有保肝[2]、抗氧化[3,4]、抗癌等药理活性[5,6]。 研究表明黄酮类成分是艾纳香中含量较高的一类成分,不同季节的黔产艾纳香药材中总黄酮含量可达4%~10%。艾纳香黄酮类成分具有丰富的药理活性,如抗肿瘤、保肝护肝、抗氧化、抗酪氨酸激酶等生物活性[7]。但目前黄酮类含量的测定主要集中在对总黄酮或单一组分的测定[8-11]。多指标评价虽然能全面的表征药材质量,但存在的对照品用量大,部分对照品价格昂贵或不易获得等缺点。鉴于此,本实验首次采用一测多评法(QAMS)对艾纳香药材中7种黄酮类成分进行含量测定,同时通过建立艾纳香药材的HPLC指纹图谱,以期为艾纳香药材的综合质量评定提供参考。
1 仪器与材料
1.1 仪器
Agilent 1260 series高效液相色谱仪,配有二极管阵列(DAD)检测器,四元泵溶剂洗脱系统,柱温箱,自动进样器,十万分之一电子天平(METTLER TOLEDO仪器有限公司);数显数控超声波清洗器(型号:KQ-500DE,昆山市超声仪器有限公司);乙腈(色谱纯级,Fisher Scientific公司);水为纯净水(自制);其余试剂为分析纯。
1.2 材料
金丝桃苷对照品(批号111521-201004;纯度93.9%);槲皮素对照品(批号100081-200907;纯度99.1%)购自中国食品药品检定研究院;3-甲氧基槲皮素 (批号191128;纯度99.68%)、怪柳黄素 (批号200123;纯度98.21%)、艾纳香素(批号101216;纯度98.46%)、鼠李素(批号200116;纯度98.05%)均购自成都植标化纯生物科技有限公司,艾纳香甲素为实验室自制(3,3',5,7-tetrahydroxy-4'-methoxyflavanone),通过1H-NMR和13C-NMR等方法确定其结构,并利用面积归一化法计算得到其质量分数大于98%;其他试剂为分析纯。12批艾纳香药材分别采购于贵州、云南、广西,经谭道鹏博士鉴定为艾纳香Blumea balsamifera,样品标本保存于深圳海王医药科技研究院有限公司研发中心标本室,样品详细信息见表1。
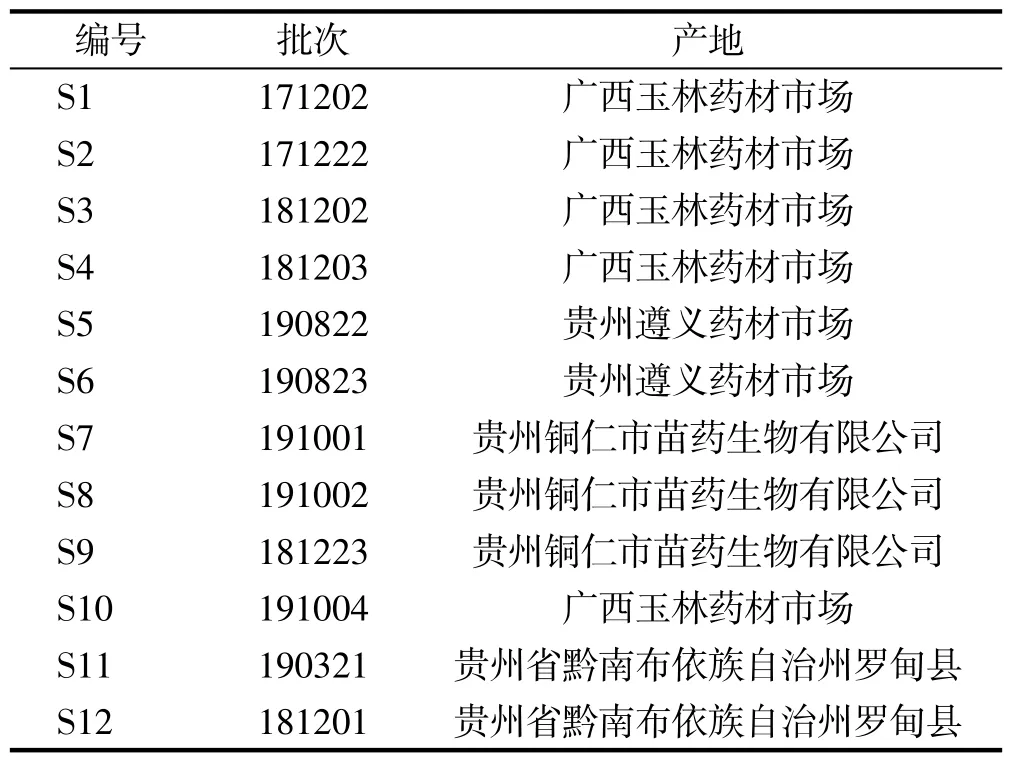
表1 样品信息Tab.1 Information of samples
2 方法与结果
2.1 对照品溶液的制备
精密称取各对照品适量,分别置于容量瓶中,加甲醇超声使溶解,配制成浓度为1mg/ml的对照品储备液,分别精密吸对照品储备液适量,置同一25 mL容量瓶中,加甲醇定容至刻度,依次制成浓度为21.32、21.16、20.40、20.32、17.84、10.32、19.32、11.25μg/ml 的混合对照品溶液,备用。
2.2 供试品溶液的制备
精密称定艾纳香药材1.0 g,置50 mL量瓶中,加入3/4体积甲醇,超声处理(功率250W,频率3kHz)30min,取出,放冷,用甲醇定容,摇匀,滤过,取续滤液过0.45μm滤膜,即得。
2.3 色谱条件
色谱柱:依利特C18(4.6×250mm,5μm);流动相为乙腈(B)-0.2%甲酸(A),梯度洗脱 (0~10min,16%B;10~15min,16~19%B;15~20min,19~25%B;20~30min,25%B;30~45min,25~28%B;45~55min,28%B;55~70min,28~40%B;70~80min,40~90%B);流速:0.8mL/min;检测波长:271 nm;柱温:30C;进样量:10μL。理论塔板数按艾纳香甲素计算≥5000。在此条件下,艾纳香中7种化学成分与相邻峰的分离度均>1.5,结果见图1。
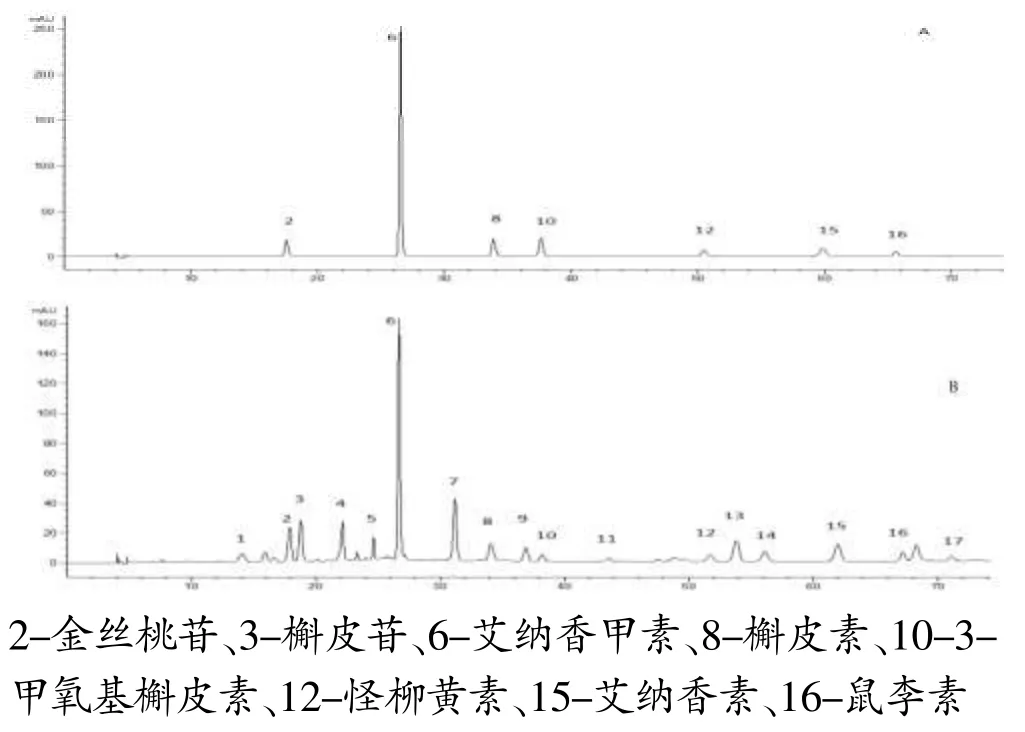
图1 混合对照品(A)和艾纳香提取物(B)溶液色谱图Fig.1 Chromatograms of mixed standards(A)and extract solution of Blumea balsamifera(B)
2.4 指纹图谱方法学验证
精密吸取“2.2”项下供试品溶液10μL连续进样6次,再取同一供试品溶液,分别在溶液制备后0、8、12、24h进样分析,再精密称取同一样品粗粉1.0 g,按2.2项下方法同时制备6份供试品溶液后进样测定,上述实验均分别在271 nm波长下检测,以艾纳香甲素为参照(S),计算其他共有峰相对保留时间及相对峰面积的RSD值。结果显示,艾纳香甲素等7种黄酮类成分的相对保留时间的RSD值均小于0.86%,共有峰相对峰面积的RSD值均小于3%,表明仪器精密度、供试品溶液稳定性以及样品处理方法的重复性均良好。
2.5 指纹图谱的建立
2.5.1 共有模式的建立及部分共有峰的指认
将12批艾纳香提取物的色谱数据导入“中药色谱指纹图谱相似度评价系统(2012版)”软件,以S2为参照谱,使用中位数进行自动匹配,加以多点校正,生成了指纹图谱共有模式,标定出17个共有峰。通过与混合对照品的保留时间及紫外吸收光谱图比对,对其中7个共有峰进行了指认,分别为金丝桃苷、艾纳香甲素、槲皮素、3-甲氧基槲皮素、怪柳黄素、艾纳香素、鼠李素,详见图1。
2.5.2 艾纳香指纹图谱的相似度评价
以共有模式作为对照指纹图谱,对12批样品指纹图谱进行相似度评价,结果12批样品与对照图谱间的相似度分别为0.999、0.999、0.994、0.993、0.990、0.982、0.971、0.968、0.969、0.961、0.982、0.989, 均大于0.960,表明所建立的指纹图谱相似度良好,可用于艾纳香药材的质量评价,样品叠加图见图2。
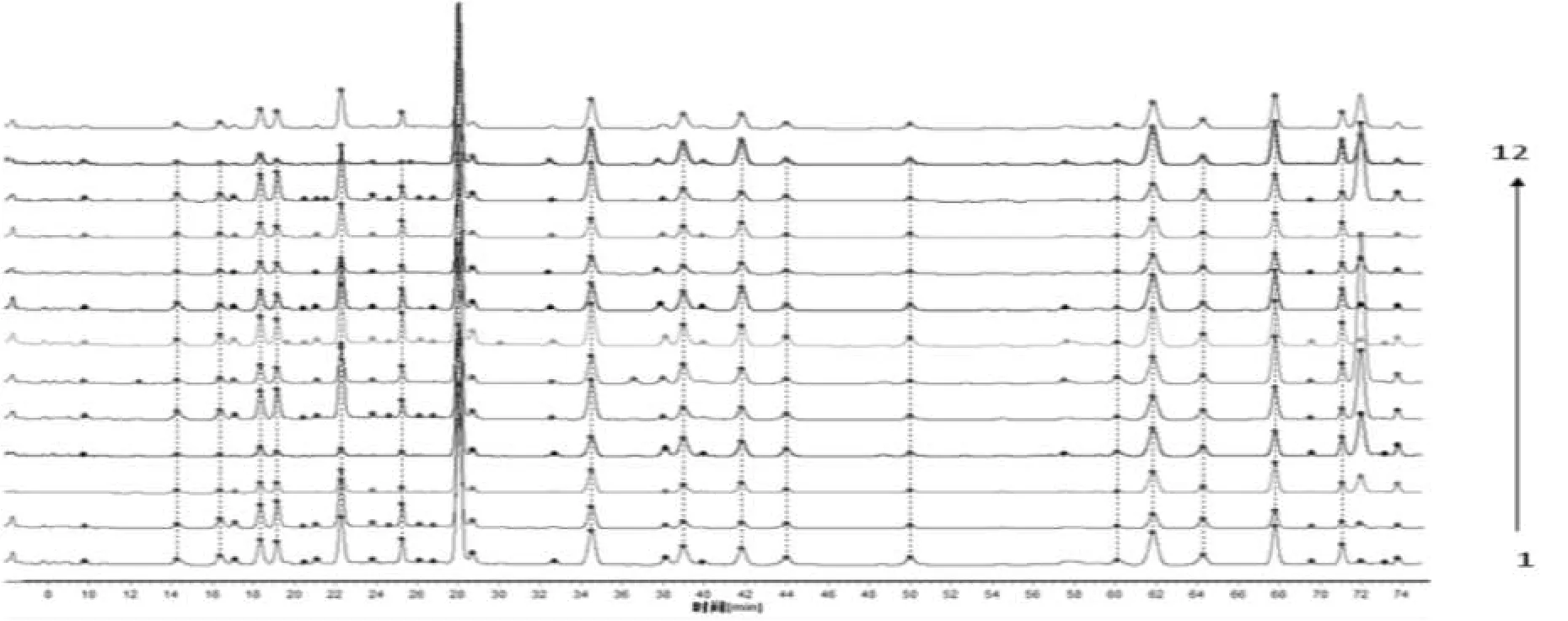
图2 12批艾纳香药材HPLC叠加图Fig.2 Overlapping chromatograms of 12 batches of samples
2.5.3 聚类分析
分别以艾纳香指纹图谱中标定的共有峰的峰面积为变量,采用SPSS 22.0数据统计软件,首先对所有数据进行标准化,聚类方法采用欧氏距离,结果见图3。根据聚类分析结果,可将艾纳香药材大致分为4类,第I类包括S5、S6、S11、S12;第II类包括S7、S8、S9,第III类包括S1、S2、S3、S4,;第IV类仅包括S10,样品的分类基本与产地一致。而样品10与其它均不同,可能是由于样品的为其它产地混进品种,或在加存放加工过程产生差异,还需进一步考察。
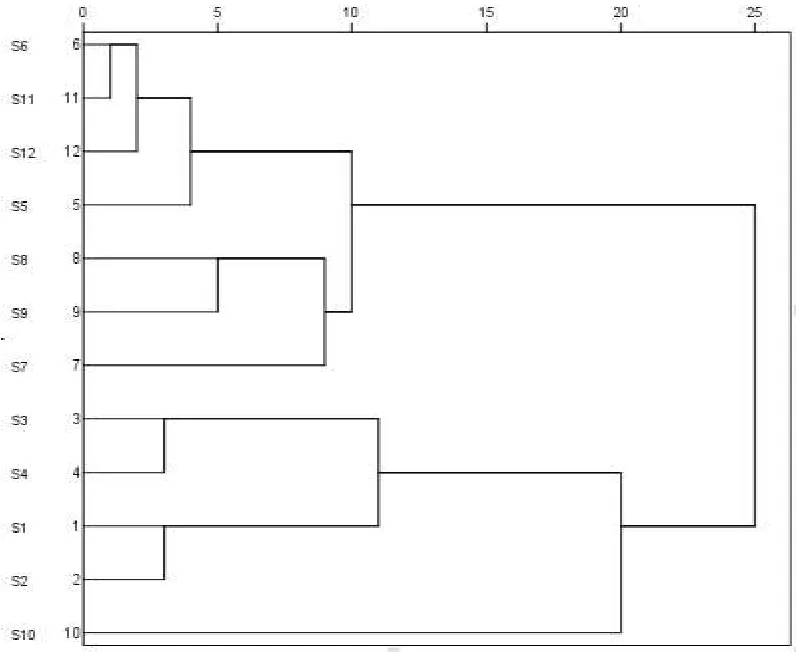
图3 聚类分析树状图Fig.3 Dendrogram of clustering analysis
2.5.4 主成分分析
将12批样品17个共有峰的峰面积导入SPSS 20.0软件,数据经标准化后进行主成分分析,主成分个数提取原则是提取主成分对应的特征值大于1的前4个主成分,其累积贡献率达到89.39%,包括了大部分信息。其中前4个主成分特征值分别为8.064、4.079、2.019、1.034,方差贡献率分别为47.435%、23.997%、11.874%、6.083%。以17个共有峰的峰面积为变量,导入SICMA-P 15软件,绘制主成分得分图,详见图4。根据得分图,12批艾纳香样品可分为四类,与聚类分析结果基本一致。
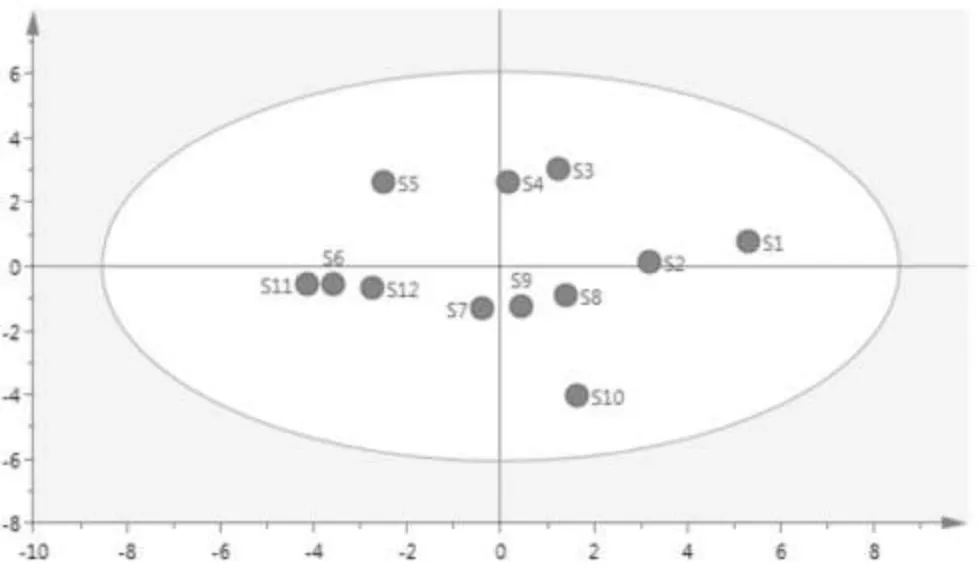
图4 12艾纳香样品指纹图谱主成分分析得分图Fig.4 Principal components analysis scores plot
2.6 一测多评法测定7个黄酮的含量
2.6.1 线性关系考察
取混合对照品储备液适量,逐级稀释得到系列浓度的混合对照品溶液,按照“2.3”项下的色谱条件进行测定。以对照品的质量浓度为横坐标(X),以峰面积为纵坐标(Y)进行线性分析,结果见表2。从回归方程可知,7种对照品在一定质量浓度范围内呈现出较好的线性关系。
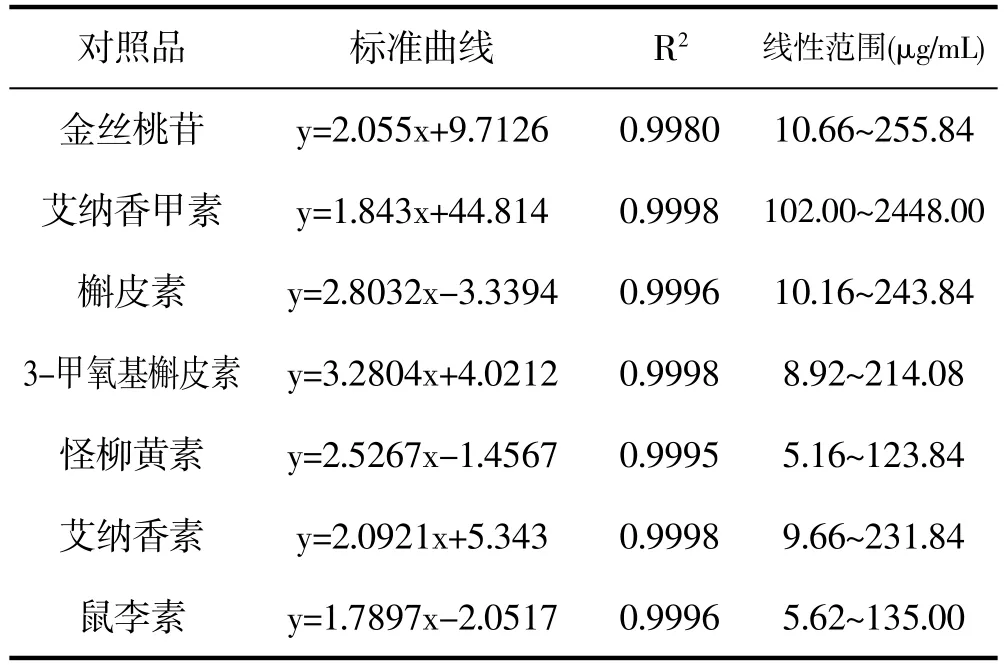
表2 对照品线性回归方程、相关系数线性范围Tab.2 Linear regression equation,correlation coefficient,linear range of 7 compounds.
2.6.2 精密度试验
取同一份艾纳香供试品溶液,按照“2.3”项色谱方法连续进样6次,测定峰面积。结果显示7个成分峰面积的RSD分别为1.53%、1.00%、1.78%、1.24%、0.86%,1.11%和1.05%,表明该方法精密度良好。
2.6.3 重复性试验
取同一批艾纳香药材,按照“2.2”项的方法平行配制6份供试品溶液,按照“2.3”项色谱条件进行测定,测得供试品溶液的RSD分别为0.37%、0.35%、0.54%、0.42%、1.07%、2.58%和1.58%。结果表明,上述7个化合物的重复性较好。
2.6.4 稳定性试验
精密吸取艾纳香供试品溶液,按照“2.2”项的方法配制供试品溶液,按照“2.3”项的色谱条件在放置0、8、24h后进行测定。峰面积的RSD分别为0.36%、0.23%、0.43%、0.04%、1.46%、0.43%和0.47%,表明供试品溶液在24 h内基本稳定。
2.6.5 加样回收率试验
精密称取艾纳香药材6份,每份0.5 g,分别加入各对照品适量,按照“2.2”项下方法制备供试品溶液,按“2.3”项下的色谱条件进样,计算加样回收率,结果的平均回收率分别为:103.85%,93.36%,95.03%,101.61%,102.43%,98.63%,99.59%,RSD分 别 为1.06%,0.79%,2.02%,3.01%,2.78%,2.64%和2.88%。结果见表3。
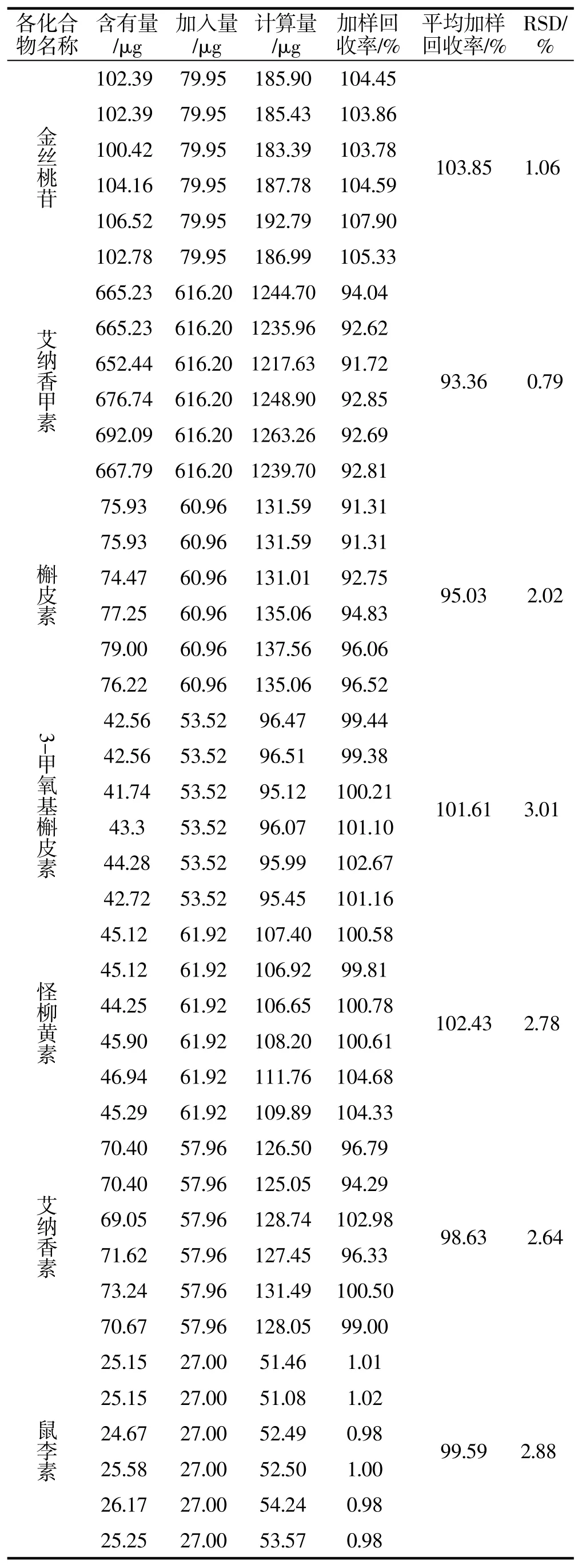
表3 艾纳香中7种黄酮类成分加样回收率实验结果Tab.3 Results of recovery test of seven compounds in Blumea balsamifera
2.7 相对校正因子
2.7.1 相对校正因子的计算
参照文献,本实验采用多点校正法计算相对较正因子,即以多个质量浓度点计算所得的相对校正因子的平均值作为含量计算用相对校正因子(fi/s)。具体公式为fi/s=fi/fs=(Ai×Cs)/(As×Ci)(式中As为内参物峰面积,Cs为内参物浓度,Ai为待测组分峰面积,Ci为待测组分浓度)。取混合对照品溶液,依次进样4、6、8、10、12、14L,按照“2.3”项下色谱条件平行进样测定,记录色谱峰峰面积。以艾纳香甲素为内参物,分别计算金丝桃苷、槲皮素、3-甲氧基槲皮素苷、怪柳黄素、艾纳香素和鼠李素对于艾纳香甲素的相对校正因子,结果见表4。
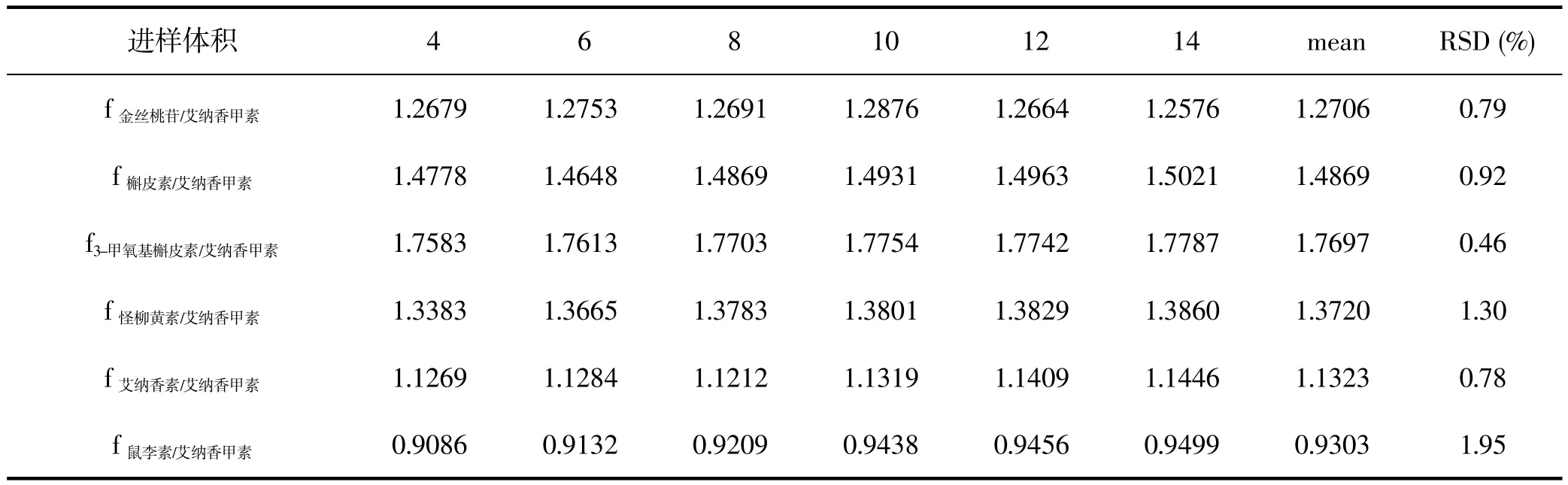
表4 槲皮素等6种黄酮类成分与艾纳香甲素的相对校正因子Tab.4 Relative correction factors(RCF)of six compounds
2.7.2 不同流速对相对校正因子的影响
本实验分别考察了不同流速(0.7、0.8、0.9 m L/min)对f的影响,结果各f的RSD值依次为0.28%、0.78%、0.03%、0.72%、0.27%和0.92%,表明不同流速对各成分的f无显著影响。
2.7.3 不同柱温对相对较正因子的影响
本实验分别考察了不同柱温(25、30、35℃)对f的影响,结果各f的RSD值依次为1.13%、2.09%、0.43%、0.69%、0.36%和4.48%,表明不同流速对各成分的f无显著影响。
2.7.4 不同仪器、色谱柱对相对较正因子的影响
分别考察不同的高效液相色谱仪(agilent1260,agilent1100),不同色谱柱(依利特C18,250 mm×4.6 mm,5μm;费罗门C18,250 mm×4.6 mm,5μm; 安捷伦C18,250 mm×4.6 mm,5μm)对各f的影响,结果各的RSD值依次为1.17%,3.30%,4.22%,3.89%,2.16%,3.70%。表明不同仪器、不同色谱柱对各成分的f无显著影响,结果见表5。
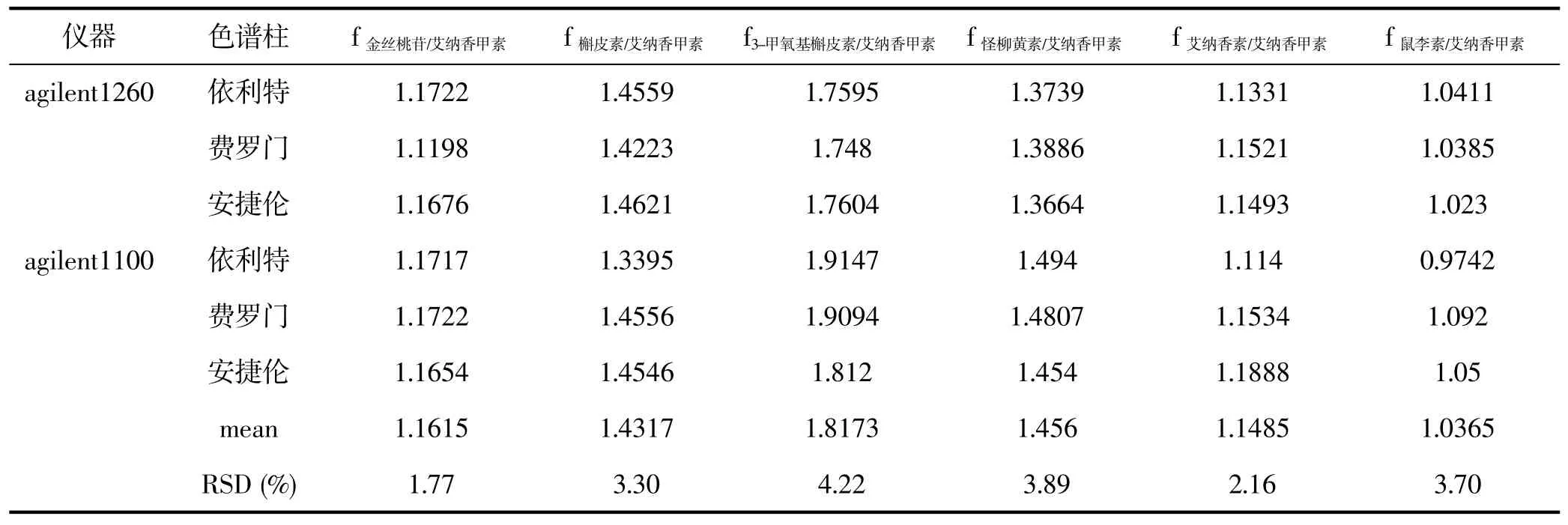
表5 不同仪器及色谱柱测得的相对校正因子Tab.5 RCF tested by different factors
2.7.5 待测成分色谱峰的定位
对待测成分色谱峰准确定位是一测多评的前提,文献通常所用方法为相对保留时间定位或保留时间差值定位[12]。但试验前期发现,在不同型号高效液相色谱仪上,各成分的保留时间差的波动比较大,RSD均>10.0%,但在同一仪器不同色谱柱上的相对保留时间的的波动相对较小,所以本实验选择用相对保留时间法进行峰定位,结合对照品确定各成分位置。结果见表6。
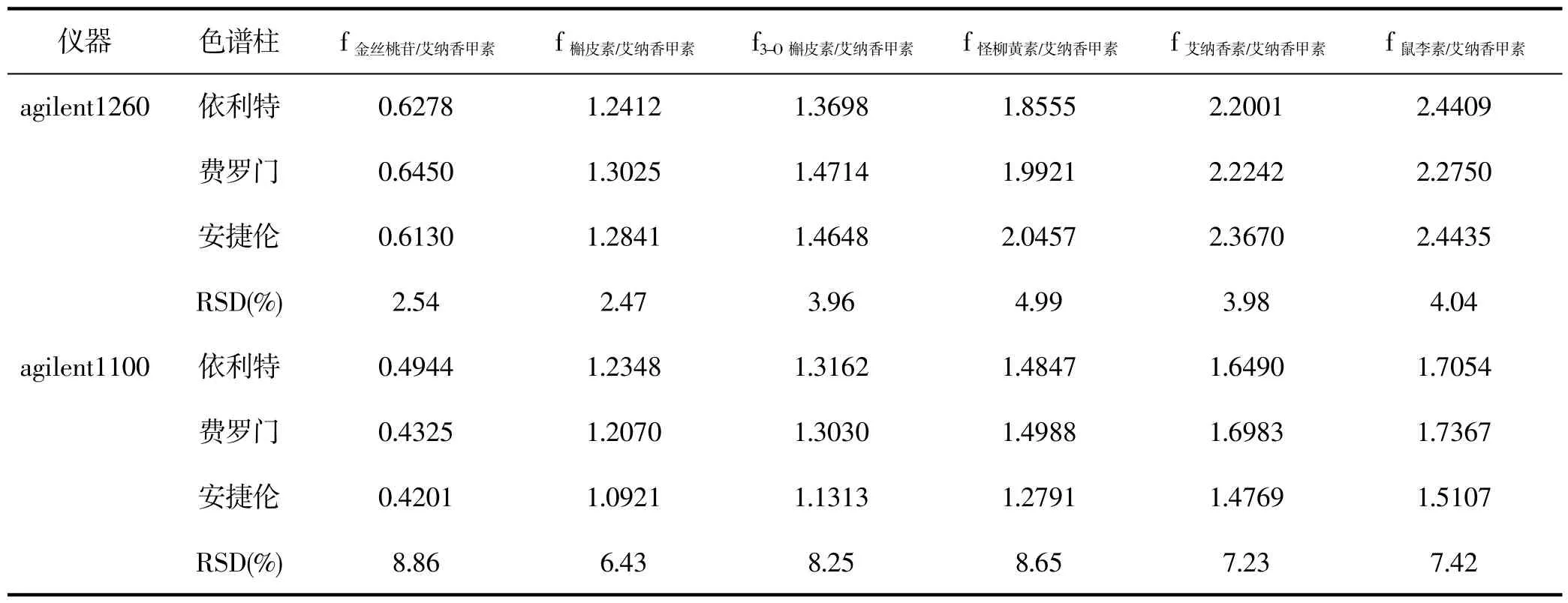
表6 不同仪器和色谱柱测得的相对保留时间Tab.6 Relative retention time tested by different instruments and columns
2.8 一测多评法(QAMS)与外标法测定结果比较
精密称取12批艾纳香药材1.0 g,分别按“2.2”项下方法制备样品溶液,按照“2.3”项下色谱条件进样测定,分别采用外标法(ESM)和QAMS法计算其含量,结果见表6。采用SPSS 20.0软件对2种方法与其平均值进行分析比较,t检验结果均为P>0.05,表明2种方法计算结果无显著性差异,说明所建立的一测多评法是可行的。
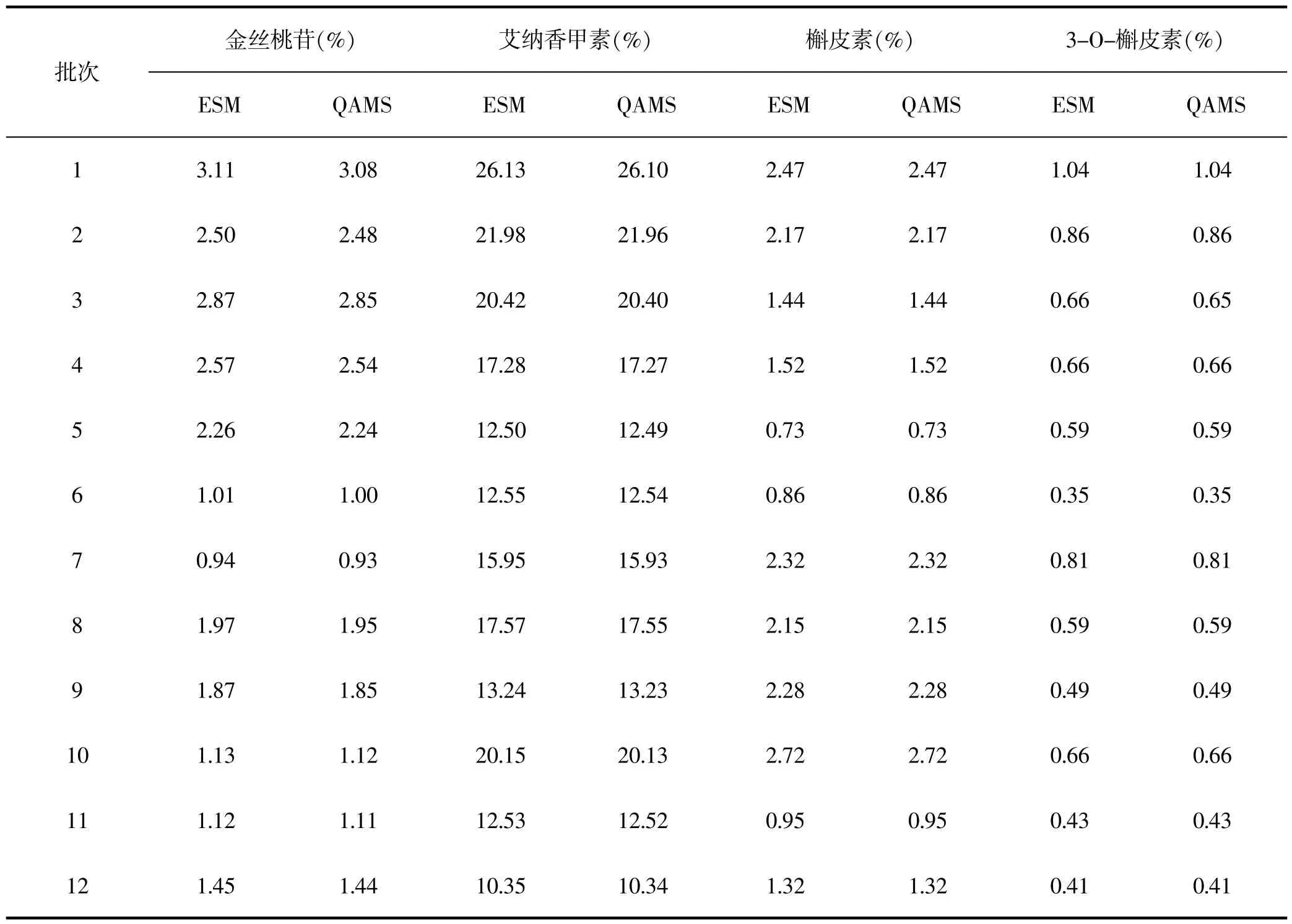
表7 ESM和QAMS 2种方法计算所得含量比较(n=2)Table 7 Content determined by ESM and QAMS methods(n=2)

批次 怪柳黄素(%) 艾纳香素(%) 鼠李素(%)ESM QAMS ESM QAMS ESM QAMS 1 0.58 0.58 5.76 5.70 2.79 2.76 2 0.71 0.71 4.97 4.92 2.53 2.50 3 0.37 0.37 4.21 4.16 1.33 1.31 4 0.48 0.48 3.45 3.41 1.12 1.11 5 0.28 0.28 2.28 2.26 0.80 0.80 6 0.16 0.16 3.89 3.85 1.15 1.13 7 0.60 0.60 3.25 3.21 2.47 2.44 8 0.37 0.37 5.05 4.99 2.54 2.51 9 0.96 0.97 5.90 5.84 2.44 2.41 10 0.55 0.55 5.67 5.61 2.99 2.95 11 0.30 0.31 2.58 2.55 1.26 1.24 12 0.32 0.32 3.08 3.05 1.82 1.80
3 讨论
色谱条件的确定:本实验首先考察了甲醇-水和乙腈-水两种系统,确定该样品在乙腈环境下分离度更好,接下来又分别对乙腈-0.4%磷酸水溶液、乙腈-0.2%甲酸水溶液体系进行考察,最后通过比较化合物个数、出峰时间、分离度以及峰型最终确定乙腈-0.2%甲酸水溶液为最佳流动相组成。分别对7个黄酮化合物的紫外光谱进行扫描分析,确定其最大吸收波长主要集中在250~290nm之间,最后结合峰数目,峰形、分离度、对称因子等参数,确定271nm为最终波长。本文所选对照品均为艾纳香中含量较高且能够购买的样品,7个对照品所占峰面积接近艾纳香药材总峰面积的70%,且为艾纳香中的主要代表类黄酮成分,能有效地表征艾纳香药材质量。
本实验在建立HPLC指纹图谱的同时,确定了17个共有峰,并对其中7个黄酮类化合物进行了指认。同时通过与外标法比较,确定所建立的一测多评法方法方便准确。与现有文献相比,本文首次对艾纳香中黄酮类成分进行了一测多评的分析,同时还建立了以黄酮类物质为主的指纹图谱,所以本文对艾纳香黄酮类物质的深入研究提供了质量方面的基础。黄酮类成分为艾纳香药材中的重要组成部分,且具有较好的药理活性,深圳海王医药科技研究院有限公司以艾纳香总黄酮为主要药效成分的艾心酮片目前已获得临床批件,正在进行II临床。而物质基础是药理活性的有效保障,单一成分不能科学全面的反应药材的质量,本文以艾纳香甲素为内标,通过同时测定7种黄酮类成分,能更有效的评价艾纳香药材的质量,且该方法准确性较好,简单可行,有效地节约检测成本,可实现对艾纳香的质量评价。

