蛭龙活血通瘀胶囊对颈动脉粥样硬化模型兔血脂代谢及MMP-2、MMP-9的影响
韩 梅,杨思进,江 燕,刘孟楠
(西南医科大学附属中医医院心脑病科,四川泸州 646000)
以颈动脉粥样硬化(carotid atherosclerosis,CAS)为特征的颈内动脉血管壁内的变化可导致斑块易损,进而引发颈动脉相关性脑血管缺血性事件的发生,简称动脉粥样硬化性脑梗死(atherosclerotic cere⁃bral infarction,ACI)[1]。其高发病率、高死亡率及高致残率仍是导致世界人口死亡的主要原因之一[2]。因此,早发现和早治疗颈动脉粥样硬化,维持颈内动脉斑块稳定,可减少ACI的发生。蛭龙活血通瘀胶囊为本院杨思进教授研制而成的纯中药院内制剂(专利号:200810147774.1)。前期研究已证实,该中药复方制剂对缺血性中风及相关疾病的防治具有显著疗效,其作用机制可能与降低血脂、抑制炎性反应等有关[3-4]。本研究拟通过观察蛭龙活血通瘀胶囊对颈动脉粥样硬化实验兔血脂水平以及基质金属蛋白酶-2(matrix metalloproteinase-2,MMP-2)、基质金属蛋白酶-9(matrix metalloproteinase-9,MMP-9)的表达作用,以揭示蛭龙活血通瘀胶囊对CAS 的干预作用及对ACI的防治作用。
1 材料与方法
1.1 实验动物
健康雌雄各半新西兰大白兔50 只,体重(2.0±0.4)kg,清洁级,半月龄。由西南医科大学动物实验中心提供,实验动物许可证号SYXK(川)2018-065。
1.2 实验药物
蛭龙活血通瘀胶囊是由黄芪、水蛭、地龙、桂枝、大血藤等中药研制而成的纯中药复方胶囊制剂,0.4 g×36粒/瓶,由西南医科大学附属中医医院制剂室提供(批准文号:川药字Z20070528);阿托伐他汀钙片(阿乐),规格20 mg∕片,由北京嘉林药业股份有限公司提供(国药准字H20093819);速眠新Ⅱ注射液(盐酸赛拉嗪注射液),由敦化市圣达动物药品有限公司提供(批准文号:兽药字(2010)070031582);硫酸庆大霉素注射液,由华中药业股份有限公司提供(批准文号:国药准字H42021503)。
1.3 试剂、仪器与饲料
兔实验所需试剂盒均购买于上海碧云天生物技术有限公司。全自动生化仪(贝克曼库尔特公司),Western Blotting 系统(Bio-Rad 公司),Tanon 6600 发光成像工作站(Tanon公司)等。高脂饲料由普通饲料96%、胆固醇2%、猪油2%配制而成[5],由成都达硕实验动物有限公司提供[许可证编号SCXK(川)2014-028]。
1.4 分组、造模与给药
将50只新西兰大白兔适应性喂养1周后按随机数字表法随机分为5 组,即正常对照组(Control)、模型组(Model)、蛭龙活血通瘀胶囊组(ZL)、阿托伐他汀钙片组(Atorvastatin)、蛭龙活血通瘀胶囊+阿托伐他汀钙片混合用药组(ZL+Atorvastatin),每组各10只。除正常组普通饲料喂养外,其余四组均采用高脂饲料喂养1周后依托经典颈动脉内膜空气干燥术加速造模。
术前12 h 禁食不禁水,通过肌肉注射速眠新注射液(1.5 mL/kg)麻醉实验兔,待麻醉完全后,将实验兔固定于手术台上,颈部备皮后消毒,沿颈部中线作纵行切口,于甲状软骨上方水平逐层钝性分离,暴露右侧颈总动脉,小心分离出约2 cm 长的颈总动脉段,并用微血管夹夹住血管两端以阻断血流。然后用4.5号头皮针从阻断的颈动脉近心端穿刺入血管,并于该段颈总动脉远心端穿刺形成一个小孔,以便空气可以通过该孔逸出。将盐水注入血管中,以冲洗掉残留在动脉管腔中的血液。然后用无菌医用氮气以120 mL/min的恒定速率流经动脉,共10 min。停止输气后将准备好的生理盐水引入动脉,以清除管腔残留的空气。取下微血管夹恢复管腔血流,用无菌棉签轻轻按压穿刺部位止血,约10 min。总操作时间约为30 min。缝合皮肤伤口,将动物分开饲养。
所有实验程序均按照《中国实验动物管理条例》的规定和一般建议进行,并尽一切努力使所用动物遭受的痛苦最小化。术后肌肉注射庆大霉素(5 mg/kg/d,持续3 d),以预防感染的发生,术后继续高脂饮食喂养1 周开始给药[6-7]。蛭龙活血通瘀胶囊组予以蛭龙活血通瘀胶囊3.12 g 生药/kg/d 灌胃(成人用量为4.8 g/d,体重按60 kg计算,换算为动物高剂量,为成人用量6 倍[8],因胶囊剂不便于实验兔服用,故本实验按生药给药)。阿托伐他汀钙片组予以阿托伐他汀钙片0.51 mg∕kg∕d灌胃(按临床20 mg∕d折算,兔等效剂量为临床成人用量的3倍[8]。因片剂不便于实验兔服用,故本实验研磨成粉状给药)。混合用药组予以3.12 g 生药/kg/d+0.51 mg/kg/d 灌胃给药,在整个实验过程中,正常组和模型组不进行药物干预,每组每只都配合予以等量4 mL∕kg生理盐水灌胃给药。所有实验兔每日每只进食饲料150 g,单笼喂饲,饮水不限。所有实验兔于给药4 周末分别采取血清及颈动脉标本进行相关指标检测。
1.5 观察指标
1.5.1 血脂测定 各组实验动物于给药4 周末清晨空腹心脏穿刺采血,静置离心取血清,使用全自动生化分析仪分别测定血清中总胆固醇(total cholester⁃ol,TC)、甘油三酯(triglyceride,TG)、低密度脂蛋白胆固醇(low density lipoprotein cholesterin,LDL-C)、高密度脂蛋白胆固醇(high density lipoprotein cholester⁃ol,HDL-C)的浓度。
1.5.2 颈动脉组织病理观察 于实验给药4 周末留取血标本后以空气栓塞法处死动物后收集颈动脉组织标本,取材时,大体观察各血管节段病变情况后,尽可能长的剪取局部颈总动脉,取上半部分放入预先备好的4%多聚甲醛溶液中4 ℃过夜固定并石蜡包埋,采用HE 染色制作成病理切片,分别在× 100和×400 普通光学显微镜下观察颈动脉组织病理学改变。下半部分颈总动脉迅速装入干净无菌的冻存管并立即放入液氮保存,用以Western Blot检测。
1.5.3 Western Blot 法检测颈动脉组织中MMP-2、MMP-9的蛋白表达情况 取颈动脉组织,每100 mg加入预冷组织裂解液1 mL,匀浆机进行匀浆后离心取上清液,严格按照BCA蛋白定量试剂盒说明书检测蛋白浓度。充分混合的上清加5×loading buffer后于沸水中煮沸变性10 min,于-20 ℃冰箱保存备用。将变性好的组织样品冰上溶解后开始上样(根据计算好的蛋白定量,用移液枪上样,预染蛋白Maker和样品)。SDS-PAGE 电泳后使用半干法转膜至PDVF膜,用5%脱脂奶粉室温下摇床上摇动封闭1 h,洗去封闭液,洗膜2 次,每次5 min。分别加已稀释一抗MMP-2(1∶1 000)、MMP-9(1∶1 000),4 ℃孵育过夜,回收已稀释的一抗,用TBST 洗膜3 次,每次5 min;加入稀释好的二抗常温孵育1 h,TBST 洗膜3 次,每次10 min。将PVDF 膜倒扣在100 μL A 液和100 μL B 液混合化学发光试剂中约5 min 后,便可在Tanon 6600 发光成像工作站进行信号检测,保存好扫描文件,用Image Pro Plus 6.0 分析软件计算分析所保存图片上的每个特异性条带灰度值。
1.6 统计学方法
采用Graphpad prism 8.0.1 软件统计分析,计量资料以均值±标准差()表示,多样本均数比较采用单因素方差分析(one-way AN0VA),两两比较采用LSD法,以P<0.05为有统计学意义。
2 结果
2.1 各组实验兔给药后血脂水平比较
实验给药4 周末穿刺心脏采集血清标本,每组各随机选取7 例标本进行血脂检测。如表1 所示:与Control 相比,Model 组血脂水平均明显升高,差异具有统计学意义(P<0.05),表明CAS 模型建立成功;各用药组实验兔经药物干预后,血脂水平均有不同程度降低,与Model组相比,各用药组HDL-C未见明显差异。
表1 各组实验兔血清中TG、TCH〇L、HDLC、LDLC水平(,n=7)
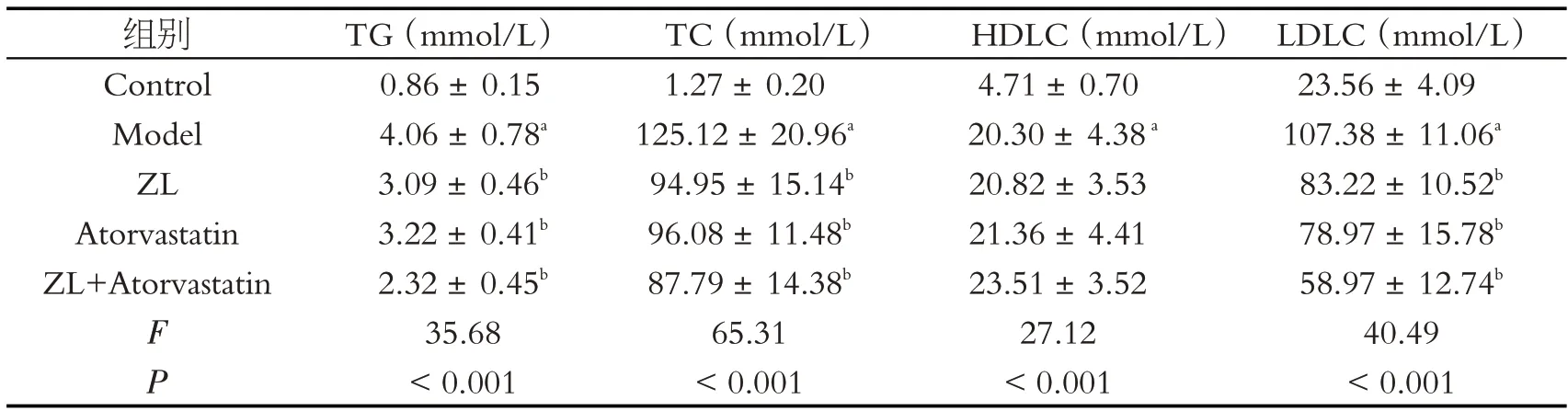
表1 各组实验兔血清中TG、TCH〇L、HDLC、LDLC水平(,n=7)
注:与Control组相比,aP<0.05;与Model组相比,bP<0.05
2.2 各组实验兔颈动脉病理切片图
实验给药4 周末处死所有动物,分别采集各组颈动脉标本制作病理切片,在普通光学显微镜(×100和×400)下观察各组病理学改变,结果如图1:正常组实验兔颈动脉内膜光滑完整,管壁各层结构清晰,未见炎性细胞浸润及颈动脉粥样硬化斑块形成。模型组与正常对照组比较,模型组兔颈动脉内膜增生严重,管腔内可见明显的斑块形成,斑块内可见薄层的纤维帽及脂质核心,大量泡沫细胞聚集,中外膜不规则增厚,符合CAS病理学改变。蛭龙活血通瘀胶囊治疗组及阿托伐他汀治疗组与模型组相比,内膜增厚程度明显减轻,少量薄斑块,且斑块内泡沫细胞明显减少;蛭龙活血通瘀胶囊和阿托伐他汀钙片联合用药组可见内皮细胞形态尚完整,部分炎性细胞浸润,未见明显泡沫细胞沉积及斑块形成,与模型组相比病理改善程度较明显,且优于单药物组。
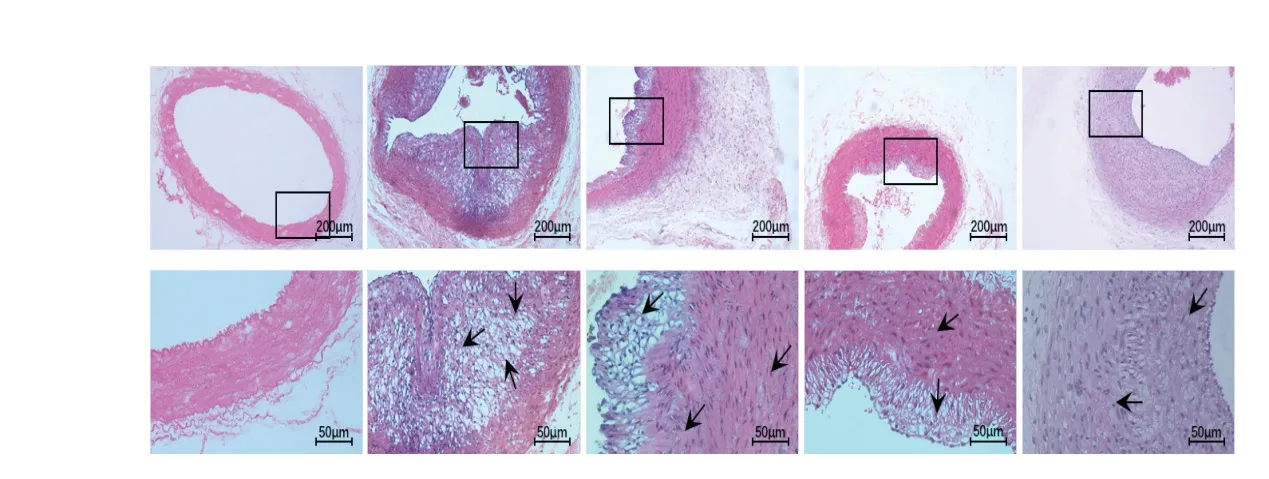
图1 各组实验兔颈动脉标本HE染色(x 100,x 400)
2.3 各组实验兔给药后颈动脉组织中MMP-2、MMP-9 含量比较
每组各随机选取3 例颈动脉组织标本,采用Western Blot 法分别测定各组标本中MMP-2 和MMP-9的蛋白表达情况。结果如表2所示:与正常组相比,模型组MMP-2、MMP-9蛋白表达明显增加,差异具有统计学意义(P<0.05);经蛭龙活血通瘀胶囊或阿托伐他汀钙片单独干预后,与模型组相比,MMP-2 蛋白水平有所下降,差异具有统计学意义(P<0.05);MMP-9 蛋白水平在蛭龙活血通瘀胶囊组显著降低(P<0.05),而在阿托伐他汀钙片组无显著变化;但当中西药物组联合干预后,上述两种蛋白变化趋势均较单药物组更为明显。
表2 各组实验兔Foxp3、MMP-2、MMP-9蛋白情况(,n=3)
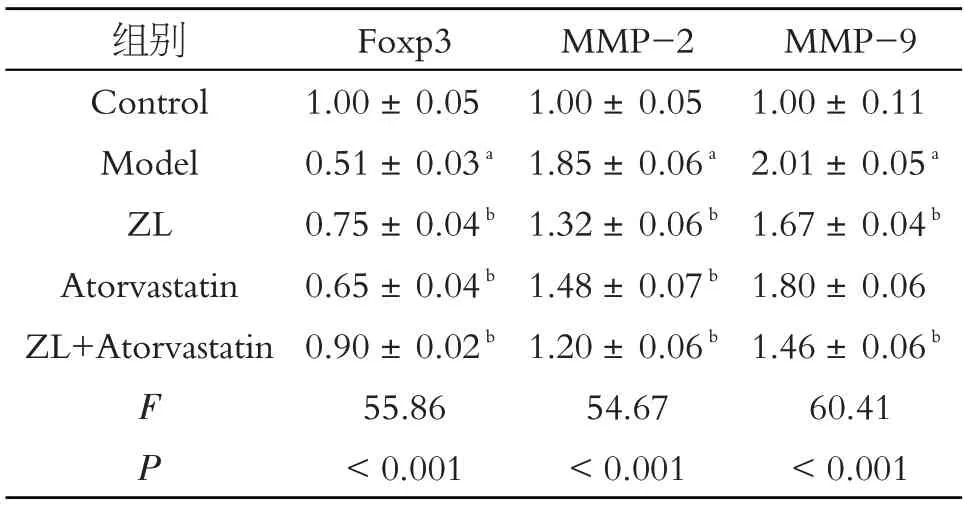
表2 各组实验兔Foxp3、MMP-2、MMP-9蛋白情况(,n=3)
注:与Control组相比,aP<0.05;与Model组相比,bP<0.05
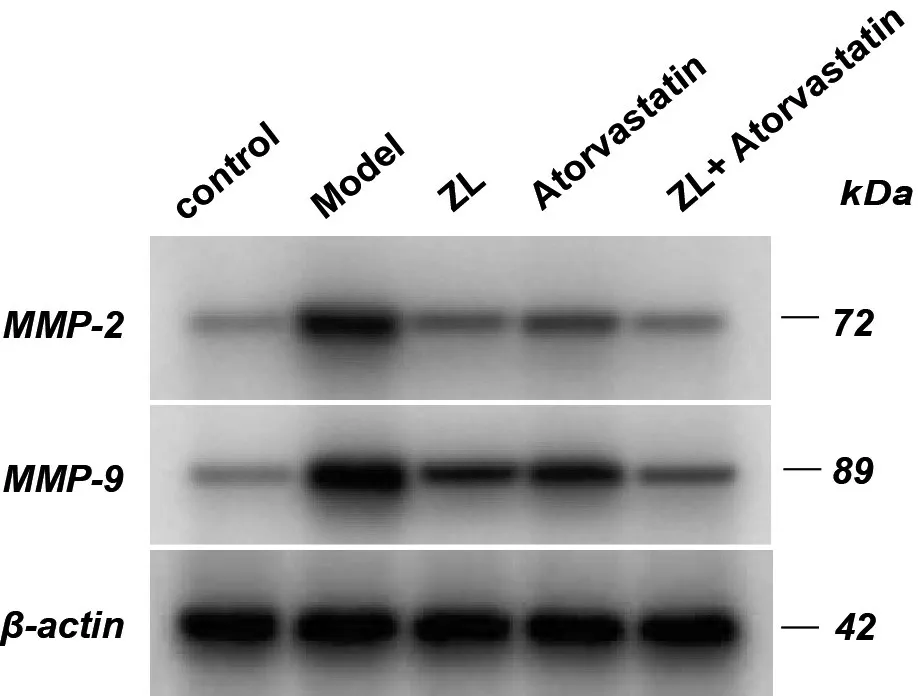
图2 各组实验兔颈动脉组织相关蛋白含量表达
3 讨论
动脉粥样硬化(atherosclerosis,AS)是动脉硬化中最常见的血管疾病,因其动脉内膜积聚的脂质外观呈黄色粥样而得名[9]。颈动脉粥样硬化(carotid ath⁃erosclerosis,CAS)是动脉粥样硬化在颈动脉的表现,被称为全身动脉粥样硬化的观察“窗口”[10]。大量研究表明,动脉粥样硬化是由低密度脂蛋白在动脉血管管壁中积累引起的炎性疾病,炎症的激活在动脉粥样硬化的发病机理中起着重要作用,并贯穿始终[11]。人体内炎症反应的增强不仅有助于动脉粥样斑块的形成,而且在动脉斑块失稳中起着至关重要的作用,是将慢性动脉粥样硬化性疾病转变为急性血栓栓塞性疾病的关键因素[12]。血脂异常是动脉粥样硬化的基本危险因素[13],相关脂质谱(即TC,TG,HDL-C,LDL-C)与颈动脉粥样硬化斑块的形成和发展具有显著关系[14]。据研究发现,新西兰大白兔在进食高脂饲料后,易形成高胆固醇血症,并在上述基础上产生自发性病变,促进动脉粥样硬化斑块的形成,已被广泛用于动脉粥样硬化研究的动物模型制备[5,15]。空气干燥术这种利用干燥的气流直接风吹血管内膜的方法,易造成内膜增生明显,血管狭窄程度加重,且内皮细胞的修复与内膜的增殖过程更接近颈动脉疾病的生理过程,稳定性好[6-7]。为了尽快促成动脉粥样硬化模型的形成,本实验采用高脂饲料饮食和颈动脉内膜空气干燥术相结合的方法制备CAS 模型。基质金属蛋白酶(matrix metalloproteinases,MMPs)是蛋白水解酶的一个大家族,已被证明在形态发生,伤口愈合,组织修复和重塑中起重要作用[16]。驻留在血管壁和动脉粥样硬化斑块中的血管细胞尤其是泡沫细胞及巨噬细胞是蛋白酶的丰富来源,并不断在不稳定斑块中聚集,从而引起血管细胞外基质的降解,破坏动脉粥样硬化斑块纤维帽,增加斑块不稳定性甚至导致斑块破裂[17]。明胶酶(MMP-2,MMP-9)是MMPs亚家族成员,可有效裂解变性的胶原蛋白及溶血素,具有广泛的特异性,在调节血管平滑肌细胞的迁移和增殖中以及在纤维帽的维持上起着重要作用[18]。研究表明,动脉粥样硬化斑块中大量促炎分子反应的增强,可导致MMP-2、MMP-9表达活性的增加,在许多经过测试的MMPs 中,MMP-2、MMP-9 的蛋白水平和活性与发生高危颈内动脉狭窄及其脑血管事件密切相关[19]。
本实验研究发现,模型对照组较正常组各组血脂水平均显著升高,病理观察可见典型的动脉粥样硬化斑块及泡沫细胞浸润,MMP-2 和MMP-9 相关蛋白的表达活性均显著增加,说明炎症反应参与了CAS的形成,建造动脉粥样硬化模型成功;经各药物组干预后,各组血脂水平均有不同程度改善,泡沫细胞及炎性细胞聚集减少,MMP-2 与MMP-9 相关蛋白的表达活性都有不同程度下降,其中中西混合药物组干预后变化更为显著,且未见明显斑块形成。说明蛭龙活血通瘀胶囊及阿托伐他汀钙片可在一定程度上通过改善血脂、减轻局部血管炎性反应,抑制或减少相关基质金属蛋白酶的表达,稳定易损斑块,从而起到对CAS的保护作用。
颈动脉粥样硬化属于现代医学的病理学病名,中医学中并没有以颈动脉粥样硬化命名疾病的记载,因其病位在血管脉络,所以可将其纳入“脉痹”的范畴。颈动脉粥样硬化性疾病临床常见的证型以虚为主,实证则以痰瘀为主,提示本病属于本虚标实虚实夹杂之症,其病机核心为“痰瘀互结,阻滞经络,气血不通”[20]。因此,在遵循扶正祛邪总的治疗原则上,当以益气活血、涤痰驱瘀为核心[21]。蛭龙活血通瘀胶囊[22]是本院杨思进教授经过30 余年的不断摸索,在“益气祛风通络法”指导下,并创新性引入开通玄府的配伍方法,以“重用补气,辅以化痰祛瘀通络,佐以风药”为配伍原则研制而成的纯中药院内制剂。该药主要由黄芪、水蛭、地龙、大血藤、桂枝等中药研制而成。方中黄芪以“益气”为根本,其主要有效成分为黄芪多糖及皂苷类等。药理研究[23]发现,黄芪多糖不仅具有降血脂作用,而且能通过相关途径抑制炎症免疫反应而起到抗AS作用;黄芪总皂苷和总黄酮能降低全血及血浆黏度、改善血瘀型大鼠血液流变指数,增加动脉血流量而起到防治AS 作用[24]。尉希清等[25]通过体内及体外实验研究发现,黄芪甲苷通过下调PDGF-BB 的表达,减少平滑肌细胞增殖、迁移,防止内膜过度增生,从而起到对动脉血管的保护作用。水蛭中的活性物质主要为蛋白质和多肽类大分子,诸多的基础和临床研究发现,其提取物及相关复方制剂均表现出具有抑制脂质浸润、保护血管内皮、抑制炎症反应等多作用功效,能多靶点影响动脉粥样硬化进程[26]。地龙性味寒、咸归肾、肺、肝经,能通经活络、平肝熄风,现代研究发现地龙及其有效成分具有抗炎镇痛、降脂、抑制血小板聚集等作用,能有效改善脑卒中患者的血管功能[27-28]。有研究发现,以上3味药物配伍使用具有明显的抗体内血栓形成作用,通过某一途径增加血浆NO 含量,并且能通过降低MDA水平,从而减轻自由基对缺血性脑组织的损伤[29]。大血藤化学成分多样,药理作用广泛,据古籍记载,其有“行血,治气块”之功效。现代研究发现,大血藤提取物具有抑制相关炎症反应,改善心肌缺血,提高各组织器官的血流灌注量,并能降低组织粘连等功效[30]。组方中桂枝能通阳化气,即温通心阳,推动血行的作用,常被称为治心病之要药,现代药理研究亦表明,桂枝具有明显降脂、解热镇痛、抗凝血、清除自由基、抗氧化减少组织缺血再灌注损伤等作用[31]。同时,“玄府为络脉之门户”,“玄府郁闭为百病之根”,“离经之血皆为瘀血”。本病属本虚标实虚实夹杂之症,实证中心环节是“瘀阻”“闭塞”。方中地龙、大血藤、桂枝配伍为其“治血先治风,风去血自通”提供了理论依据。由此可见,蛭龙活血通瘀胶囊组方原则在遵循中医学整体观念基础上,统筹兼顾、标本兼治。共同发挥出鼓舞阳气、益气祛风、通络开玄、畅达三焦的作用。从而起到稳定易损斑块,防治动脉粥样硬化的功效。
4 结论
本研究通过高脂饲料喂养加颈动脉内膜空气干燥术的方法构建兔颈动脉粥样硬化模型。分别观察蛭龙活血通瘀胶囊、阿托伐他汀钙片及蛭龙活血通瘀胶囊和阿托伐他汀钙片混合用药对实验兔血脂的影响及相关病理改变,并通过对相关基质金属蛋白酶的观察,蛭龙活血通瘀胶囊可在一定程度上改善颈动脉粥样硬化血脂水平,抑制或减轻MMP-2、MMP-9 的表达,稳定易损斑块,从而起到保护颈动脉粥样硬化的作用,有较高的临床应用及推广价值。

