不同虫态猕猴桃小蠹虫体内共生细菌多样性分析
张玉婷,黄昭贤,张景荣,卓 明,周良强
(1 内江职业技术学院,四川内江,641100;2 四川省自然资源科学研究院,成都,610015;3 四川省植物工程研究院,成都,611730)
昆虫体内定殖着大量的细菌。在协同进化过程中,这些细菌与昆虫构建了多种多样的共生关系,并在昆虫的营养、生殖以及免疫等方面发挥着重要的作用[1]。如布赫纳氏菌(Buchnera)能为宿主蚜虫提供必需的氨基酸、维生素B等营养物质[2],立克次氏体菌(Rickettsia) 调控宿主昆虫的生殖[3],Regiellainsecticolan能显著增强豌豆蚜对虫疫霉菌的抗感染能力[4],点蜂缘蝽体内的伯克氏菌(Burkholderia)具有解毒功能,能帮助宿主降解化学农药“杀螟松”等[5]。同时,宿主昆虫的食性和其寄主植物的不同反过来也影响着共生细菌的群落结构和多样性。
昆虫体内的生境会随着昆虫的生长发育而变化,进而引起体内细菌种类和数量的变化。由于昆虫体内很多细菌对生境要求苛刻,不可体外培养,因此,依赖于对细菌分离培养,对其形态和生理生化等特征进行检测鉴定的传统方法,在细菌的种类和数量上均存在明显的局限和不足。随着高通量测序平台的不断发展,基于16S rDNA的选择性扩增和第2代测序,已成为微生物群落结构和多样性研究的主要方法。
小蠹虫是鞘翅目(Coleoptera) 象甲科(Curculionidae) 小蠹亚科(Scolytinae) 昆虫的总称[6],是严重为害林木的一类钻蛀性害虫,防治困难。近年来,在猕猴桃上也发现了小蠹虫为害,引起植株枝叶萎蔫甚至全株枯死[7-8]。目前,学术界对小蠹虫的生物学特性和防治研究较多,而对其体内菌群结构及不同虫态体内菌群之间的差异鲜有报道[9],共生菌群在猕猴桃小蠹虫生长发育过程中的变化情况尚不清楚。为此,本试验以为害猕猴桃的壮材小蠹TerminalinusHopkins为研究对象,对不同虫态体内细菌进行16S rDNA高通量测序,分析其群落结构和多样性,为深入研究小蠹虫内共生菌与宿主的共生机制奠定基础。
1 材料与方法
1.1 样品采集
试虫采集于四川省彭州市通济镇黄村(N 31°10′18.06″,E 103°48′16.4″)的“红阳”猕猴桃枝条,从带有小蠹虫新蛀虫孔的猕猴桃枝条中取出小蠹虫71头。其中,30头成虫浸泡于75%酒精,用于形态种属鉴定,其余的41头不同虫态的小蠹虫,即幼虫、蛹、新成虫各9头,老成虫14头,用于体内共生细菌研究。先后采用75%酒精和2%NaClO对试虫体面进行消毒,再用无菌水漂洗去除样品体面细菌。
1.2 DNA的提取与测序
使用细菌DNA提取试剂盒(Solarbio)提取各样本DNA。用高保真酶和带Barcode的特异性引物(515F和806R)对16S V4区进行PCR扩增。PCR产物经电泳检测后,再进行等量混样和纯化。采用Ion Plus Fragment Library Kit 48 rxns 建库试剂盒(Thermo fisher公司)构建文库,委托诺禾致源公司使用Thermo fisher的Ion S5TMXL测序平台测序。
1.3 测序结果分析
1.3.1 测序数据处理
使用Cutadapt[10]去除reads的低质量部分,截去Barcode和引物序列,拼接得到原始数据(Raw reads),再经质检、去除其嵌合体、过滤等处理得到有效数据(Clean Reads)[11]。
1.3.2 OTU聚类和物种注释
利用Uparse 软件[12]以97%的一致性为标准,对有效数据(Clean Reads)进行操作分类单元(Operational Taxonomic Units,OTUs) 聚类。用Mothur法和SSUrRNA数据库[13]注释OTUs序列,进而分析样本在不同分类阶元的群落组成。
1.3.3 样品复杂度分析
使用Qiime软件(Version 1.9.1)计算Shannon,ACE,Goods-coverage 指数。
2 结果与分析
2.1 序列拼接与组装
对猕猴桃小蠹虫体内细菌16S rDNA-V4区高通量测序数据进行处理后,得到原始系列273 917条,经优化、拼接处理后得到可用于后续分析的260 414条有效数据(Clean reads)。在97%相似度下,对有效数据进行OTU聚类,得到808个OTUs。数据处理过程中各步骤得到的序列统计结果见表 1。

表1 猕猴桃小蠹虫内共生细菌测序信息
2.2 多样性指数分析
分别采用Ace指数和Shannon指数衡量群落丰富度和多样性。Ace指数值越大则表示群落的丰富度越高;Shannon指数值越高,则表明群落的多样性越高[14]。用Good’s coverage指数反映测序深度,其值越接近1,则表明测序深度基本覆盖检测样品的所有物种。在本研究中,各样品的测序深度均在0.999以上,表明该测序结果能准确反映出各样品所含共生菌的物质信息。
一般而言,在97%以上的相似性下聚类而成的OTU,通常被认为是源自于同一个种(Species Boundary)的序列。本研究以97%的相似性为阈值,对各试虫的Ace指数和Shannon指数进行了分析(见表2)。由结果可知,蛹期细菌的Shannon 和Ace 指数值均大于其他虫态的指数,表明在猕猴桃小蠹虫的4种虫态中,蛹内共生菌的多样性和丰富度均最高,其次为老成虫,新成虫内生菌的多样性和丰富度最低。

表2 不同虫态猕猴桃小蠹虫共生细菌多样性分析
2.3 菌群结构分析
根据KRONA[15]的注释结果,在不同分类水平上,选取丰度最高的10个物种进行菌群结构分析。
在门分类水平上,注释到变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)、绿弯菌门(chloroflexi)、蓝细菌门(Cyanobacteria)、软壁菌门(Tenericutes) 等14个门,其中,变形菌门为4种虫态的优势菌门,其丰度高达62.97%~98.21%。蛹和老成虫体内菌群多样性较高,相比其他虫态,二者的变形菌门的细菌丰度有所下降,而厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)和拟杆菌门(Bacteroidetes)的丰度大幅上升,这3类菌群分别占蛹和老成虫菌群数量的36.24%与27.23%,而幼虫与新成虫的相应体内菌仅占总量的1.60%与1.85%(见表3)。

表3 在门分类水平的猕猴桃小蠹虫共生细菌菌群相对丰度 /%
在纲水平上,共注释到γ-变形菌纲(Gammaproteobacteria)、α-变形菌纲(Alphaproteobacteria)、梭菌纲(Clostridia)、拟杆菌纲(Bacteroidia)、鞘脂杆菌纲(Sphingobacteriia)、ε-变形细菌纲(Epsilonproteobacteria)等26个纲。4种虫态小蠹虫体内细菌的优势菌群差别较大,幼虫和蛹的优势菌群为γ-变形菌,次优势菌群为α-变形菌;在成虫时期,α-变形菌为优势菌纲,γ-变形菌为次优势菌纲(见表4)。
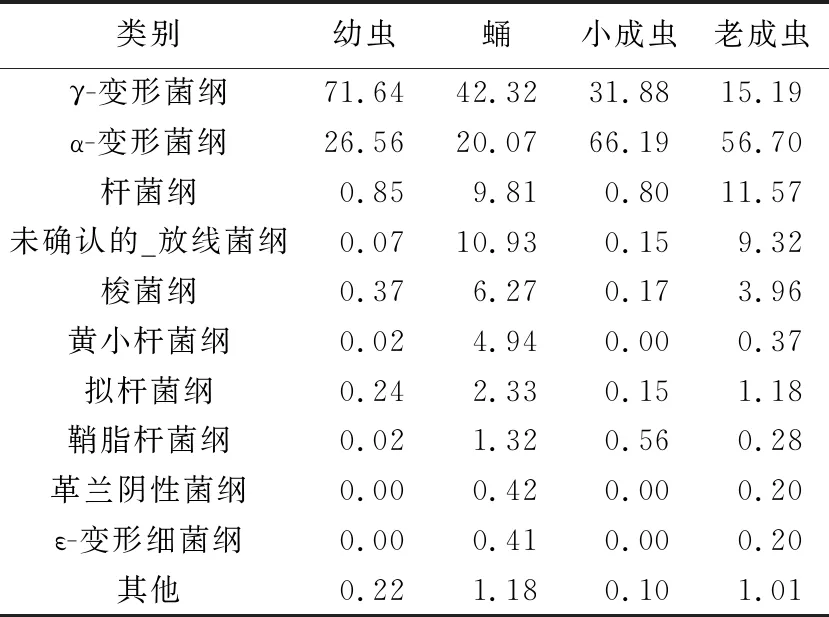
表4 在纲分类水平的猕猴桃小蠹虫共生细菌菌群相对丰度 /%
在目水平上,共注释到肠杆菌目(Enterobacterales)、棒状杆菌目(Corynebacteriales)、立克次氏体目(Rickettsiales)、芽孢杆菌目(Bacillales)、假单胞菌目(Pseudomonadales)、梭菌目(Clostridiales)、黄杆菌目(Flavobacteriales)、乳杆菌目(Lactobacillales)等48个目。由表5可知,在小蠹虫的幼虫和蛹期的优势菌目为肠杆菌目(Enterobacterales,28.71%~71.08%),在成虫期优势菌目为立克次氏体目(Rickettsiales,55.84%~66.08%)。

表5 在目分类水平的猕猴桃小蠹虫共生细菌菌群相对丰度 /%
在科水平上,共注释到肠杆菌科(Enterobacteriaceae)、立克次体科(Rickettsiaceae)、乳杆菌科(Lactobacillaceae)、李斯特菌科(Listeriaceae)、莫拉菌科(Moraxellaceae)、瘤胃菌科(Ruminococcaceae)、黄单胞菌科(Xanthomonadaceae)等76个科。由表6可知,幼虫的优势菌科为肠杆菌科(Enterobacteriaceae,71.08%),立克次体科(Rickettsiaceae,17.83%)为次优势菌科。蛹的优势菌科为肠杆菌科(Enterobacteriaceae,28.71%)、诺卡氏菌科(Nocardiaceae,10.23%)和无形体科(Anaplasmataceae,10.17%),未注释的微生物丰度为14.29%。新成虫的优势菌科为立克次体科(Rickettsiaceae,41.38%)、肠杆菌科(Enterobacteriaceae,27.76%)和无形体科(Anaplasmataceae,24.70%)。老成虫期的优势菌群为立克次体科(Rickettsiaceae),其丰度高达48.71%。
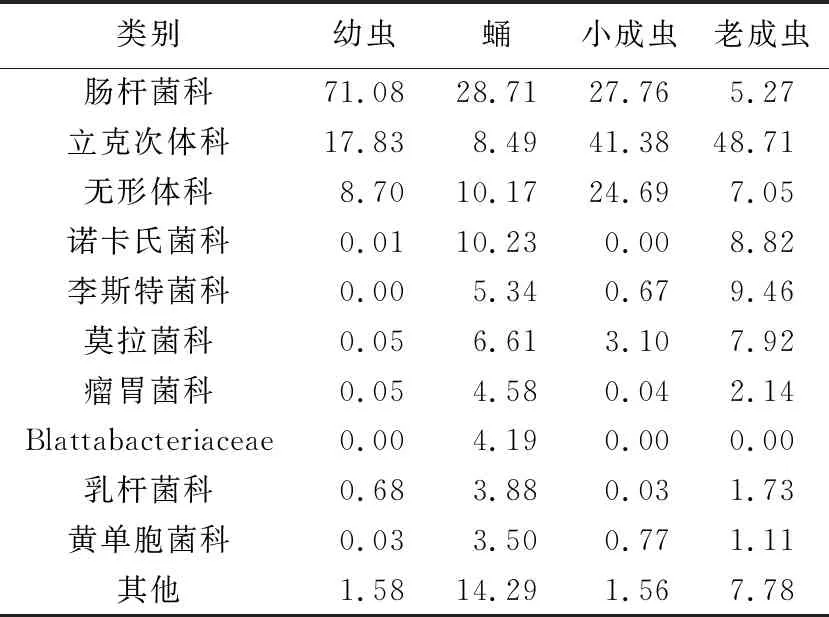
表6 在科分类水平的猕猴桃小蠹虫共生细菌菌群相对丰度 /%
在属水平上,注释了133个属,主要有立克次体属(Rickettsia)、沃尔巴克氏菌(Wolbachia)、Sodalis、红球菌(Rhodococcus)、假单胞菌属(Pseudomonas)等。幼虫体内未鉴定到属水平的细菌数量占总数的68.04%,在已鉴定的体内菌群中,优势属为立克次体属(Rickettsia,17.83%),其次为沃尔巴克氏菌Wolbachia(8.70%)和Sodalis(4.67%),而这3个属的菌群在新成虫体内丰度较高,分别为41.38%、24.70%和23.00%。蛹期有46.29%的菌未鉴定到属水平,其菌群优势属为立克次体属(Rickettsia)、沃尔巴克氏菌(Wolbachia)和红球菌(Rhodococcus),其丰度分别为8.49%、10.17%和10.23%。而在老成虫体内菌群中,立克次体属(Rickettsia)相对丰度最高,为48.71%,其次是利斯特菌(Listeria)和红球菌(Rhodococcus),其丰度分别为9.46%和8.82%(见表7)。

表7 在属分类水平的猕猴桃小蠹虫共生细菌菌群相对丰度 /%
2.4 不同虫态内生菌群落之间的差异性
对OTUs进行聚类分析,绘制猕猴桃4种虫态小蠹虫共生菌的韦恩图,得到各虫态共有和特有的OTUs。聚类分析结果看出,4种虫态共有的OUTs为91个,占各样本OUTs总数的38.24%~59.87%。幼虫、蛹、新成虫和老成虫特有的OUTs分别为8个、23个、9个和13个,分别占各样本OUTs总数的5.26%~9.66%,表明猕猴桃小蠹虫在不同发育阶段其体内共生菌的组成存在较大差异(见图1)。
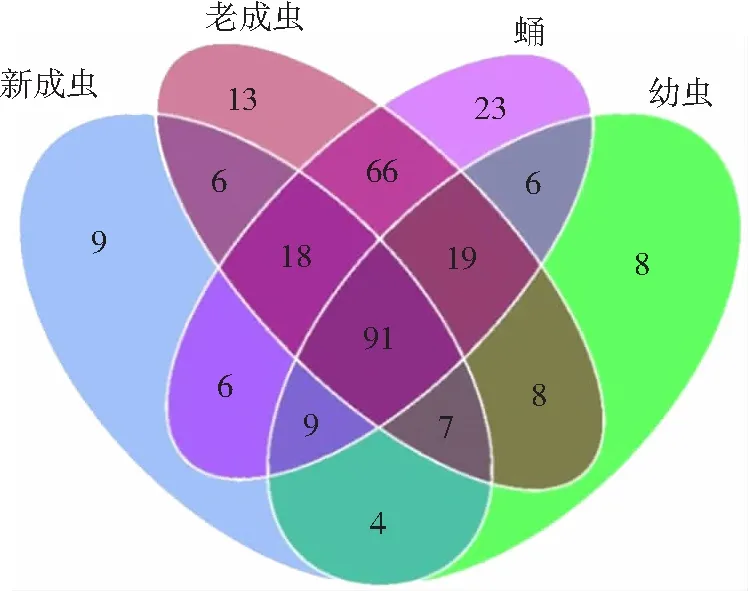
图1 猕猴桃小蠹虫不同虫态内生菌群韦恩
3 结论与讨论
本研究采用16S rDNA高通量测序法,首次对不同发育阶段猕猴桃小蠹虫体内共生细菌的组成和变化进行了分析,发现猕猴桃小蠹虫从幼虫到老成虫的发育过程中,其体内共生细菌的丰富度和多样性发生了较大的变化,幼虫和新成虫体内菌的丰度和多样性较低,而蛹和老成虫的则较高,物种数达到幼虫及新成虫的1.5倍以上。
在小蠹虫4种虫态中,变形菌门始终占据了单一菌门的最高比例,该门所占比例高达62.97%~98.10%,为绝对优势菌门。隶属于立克次体科(Rickettsiaceae)的立克次体属(Rickettsia)和沃尔巴克氏菌(Wolbachia)为成虫的优势菌群,推测立克次体属(Rickettsia)和沃尔巴克氏菌(Wolbachia)与成熟期的猕猴桃小蠹虫形成了较稳定的共生关系。胡霞在研究华山松大小蠹肠道微生物群落多样性时,发现肠杆菌科的柠檬酸杆菌(Citrobacter)在不同发育时期的华山松大小蠹中较为一致[16]。本研究中猕猴桃小蠹虫与华山松大小蠹的肠道优势菌群存在较大差异,这可能与昆虫种类及食性等有关。
Rickettsia是一种细胞内寄生的原核细胞型微生物。以往的研究发现Rickettsia有多种功能,有的为宿主昆虫的营养共生菌[17],有的能提高宿主昆虫耐高温[18]以及抵御天敌的能力[19]。此外,Hendry 等观察到甘薯粉虱在取食感染了丁香假单胞菌(Pseudomonassyringae)的植物后,该菌在其体内繁殖而导致粉虱死亡率显著增加;而当粉虱携带Rickettsia菌后,由丁香假单胞菌导致的死亡率则显著降低,表明Rickettsia菌能显著增强粉虱对丁香假单胞菌的抵御能力[20]。目前,学术界普遍认为猕猴桃溃疡病是由丁香假单孢细菌变种(Pseudomonassyringaepv.Actinidiae,Psa)引起[21]。由于在猕猴桃溃疡病枝条中普遍发现小蠹虫[7-8],黄昭贤提出该病害与小蠹虫有关,由虫-伤-菌共同作用导致了猕猴桃溃疡病规模持续发生[8]。Rickettsia是猕猴桃小蠹虫体内的优势菌,它是否因携带了该菌后增强了对Psa的抵御能力,还需进一步研究。

