首发症状为反复喘息发作的原发性纤毛运动障碍2例并文献复习
张玉玲,荣杰鑫,郝晓飞,李瑞君
(内蒙古自治区儿童医院,内蒙古自治区妇幼保健院,内蒙古呼和浩特 010020)
原发性纤毛运动障碍(primary ciliary dyskinesia,PCD)是由于纤毛超微结构、功能异常,导致纤毛运动、清除功能异常及在胚胎发育期可能发生的器官偏侧性改变,生后逐渐出现含纤毛组织功能障碍的一组常染色体隐性遗传病,包括Kartagener综合征、纤毛不动综合征、纤毛运动方向缺陷,是儿童反复呼吸道感染的病因之一[1-2]。现通过分析我院儿内科诊断的2例原发性纤毛运动障碍患儿的临床资料及最新文献复习,以提高儿科医师对PCD的认识。
1 一般资料
患儿1,女,12岁,于2018年2月主因“咳嗽1个月,加重伴喘息1周”就诊于内蒙古妇幼保健院,患儿为第1胎第1产,足月顺产,出生体质量3 kg,生时无窒息,发育正常,患儿2~3岁有湿疹史,2014年11月吸入粉尘后喘息,住院治疗好转后出院,后在当地一家三级甲等医院诊断“哮喘”并按医嘱治疗,患儿近4年每年均有3~4次咳嗽、咳喘发作,每次均需抗感染治疗后可缓解。生长发育史正常,家族及本人无明确过敏史。入院查体:体温36. 5 ℃,脉搏144次/分,呼吸35次/分,血压105/87 mm Hg,口周鼻根部无发绀(吸氧下),唇红,咽充血,呼吸促,三凹征(+),双肺呼吸音粗,满布喘鸣音、水泡音。辅助检查:胸部CT示两肺炎症,右肺中叶内侧段部分实变,两肺下叶及右肺中叶小气道病变不除外,见图1。鼻窦CT示副鼻窦炎,左侧上颌窦囊肿。气管镜检查:气管、支气管内膜炎症,两下肺较多分泌物。呼出气一氧化氮(FeNO)(鼻、口腔)24 bbp。电镜下活检:送检组织黏膜覆单层柱状上皮,基底膜局灶裸露,部分区域被覆不完整假复层纤毛柱状上皮,排列紊乱、稀疏,横断面微管呈9+2,部分纤毛见空泡状突起及二联体及三联体纤毛,见图2。基因检测发现1个突变点,未明确基因表型关系。患者诊断为PCD、肺部感染,予以抗感染、祛痰等治疗后好转出院。
患儿2,男,8岁。因“反复咳嗽、咳喘3年,加重3 d”入院,患儿5岁以后因间断咳嗽、咳喘、流涕,偶有发热、气促、间断多次就诊诊断为哮喘合并肺内感染,予以抗炎、平喘治疗有效。3 d前患儿咳嗽、喘息症状加重伴有呼吸困难入我院,无特殊家族史。入院后血常规:白细胞(WBC)计数17.21×109/L,中性粒细胞百分比(N%)75%,C反应蛋白、降钙素原均正常,分化簇(CD)系列、免疫球蛋白及补体未见异常。痰培养:肺炎链球菌,结核菌素(PPD)试验(72 h)阴性。肺功能:中、重度阻塞性通气功能障碍,舒张实验阴性。肺CT示两肺可见斑片状渗出,双下肺支气管腔扩张、壁增厚。鼻窦CT示双上颌窦炎。支气管镜检查示气管、支气管内膜炎症,左肺下叶大量分泌物。纤毛活检电镜下示纤毛稀疏、参差不齐,部分纤毛9+2微管结构异常,外周微管和(或)部分中央微管减少,纤毛外膜缺失,局部见炎症细胞浸润。家长拒做基因检测。出院诊断:PCD、肺部感染,予抗感染治疗10 d及气管镜下灌洗,症状缓解,肺CT斑片阴影基本吸收,出院并长期门诊随诊。
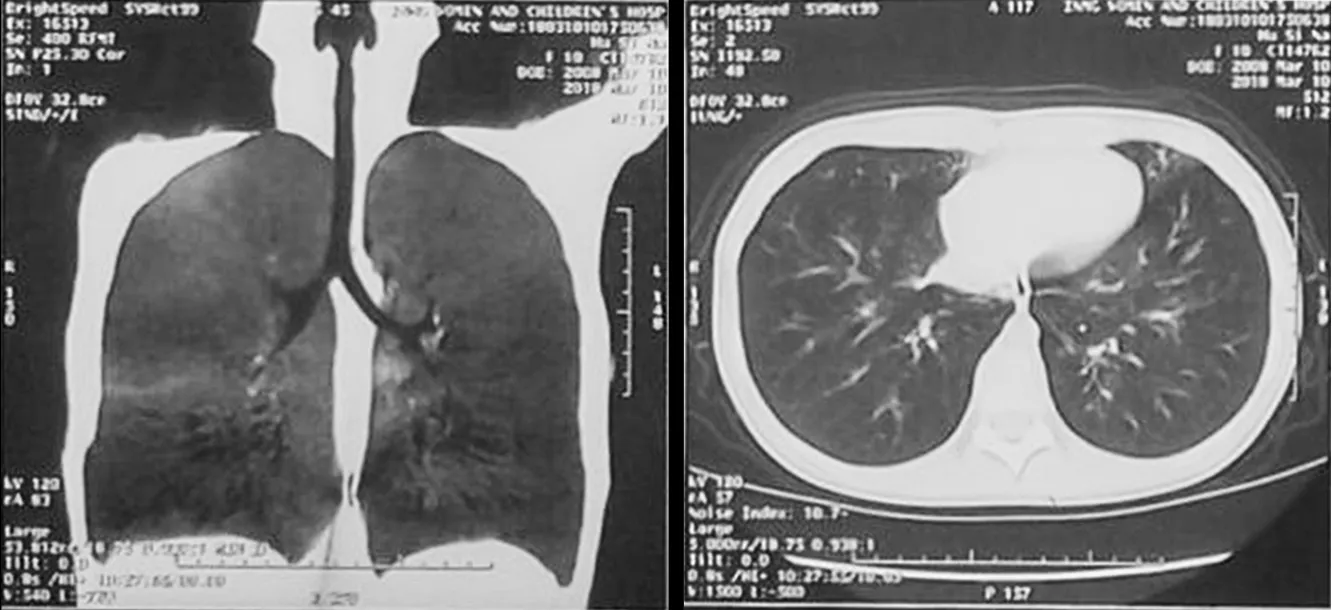
图1 患儿1胸部CT
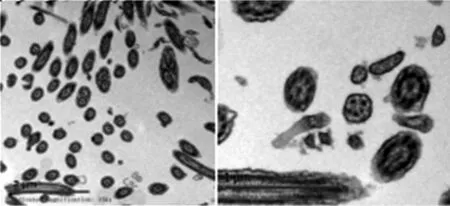
图2 患儿1电镜检查
2 讨论
1937年由Kartagener先后报道了11例有支气管扩张、鼻窦炎、内脏转位三联征患者,后此病被正式命名为Kartagener symdrome[3],约50%PCD患者可合并内脏转位,合并先天性心脏病的比例为6%[4],一般发病年龄多在学龄期及以后,发病率无明显性别差异,有遗传倾向。国外报道人群发病率为1/60 000~1/30 000,低于实际发病率,与该病易误诊、漏诊有关,国内相关流行病学报道较少[5-7]。近亲结婚发病率高达20%~30%。
纤毛是细胞重要附属结构,纤毛的核心结构为纤毛轴丝。根据纤毛运动性、中心微管形状可将人体纤毛分为9+2运动型、9+2不动型、9+0运动型、9+0不动型。9+2运动型在人体最多见,分布于气道黏膜、室管膜、输卵管、精子鞭毛等处,结构为9对外周微管环绕1对中央微管,由ATP酶连接的外周微管内动力臂、外动力臂,负责纤毛的运动;纤毛方向由负责内动力臂与中央微管连接的辐射臂移动角度的变化控制[6]。因此,纤毛超微结构缺陷、数量减少或纤毛运动障碍是导致PCD根本原因。
患者存在内脏转位结合病史易引起医师对PCD的重视,但无内脏转位时,该病诊断较为困难。结合文献,PCD的发病年龄为新生儿至成年,以学龄前至青年多见,对于大龄儿童患者不典型哮喘或不能用哮喘解释病情时,以及起病于儿童时期,症状随年龄逐渐加重的反复发生肺部感染的患儿均需警惕PCD的可能。本研究中2例患儿均为学龄期患儿,以喘息发作为首发症状,正规的哮喘治疗效果差,故不除外PCD。PCD的诊断文献报道肺影像学检查尤为重要,其特征性表现是好发生于中、下肺叶的支气管扩张,但必须排除囊性纤维化、α-抗胰蛋白酶缺乏症等导致支气管扩张的疾病[8],成年患者肺CT未见支气管扩张几乎可以排除诊断PCD的可能[7]。文中2例患儿结合胸部影像学及支气管镜检查表现为单侧或双侧下肺的病变,与PCD影像学特征改变相近,故近一步支持PCD可能。PCD可供选择的无创性检查中FeNO浓度明显降低对PCD的诊断有重要意义[8],文中第1例患儿FeNO在正常范围,第2例患儿未做检测。结合最新报道,约10%确诊的PCD患者在正常范围内[9]。因此,FeNO正常不能排除PCD可能。肺放射性气溶胶黏膜清除试验(pulmonary radioaerosolmucociliary clearance test,PRMC)在PCD诊断的敏感性及特异性较高[10]。电镜下鼻、支气管黏膜纤毛超微结构(包括纤毛轴、外周微管、中央微管、内动力臂、外动力臂、辐射臂及连接蛋白等)异常或高速数字视频成像实时观察纤毛摆动幅度、频率、运动方向的一致性异常可确诊,2例患儿确诊均通过电镜下支气管黏膜纤毛检测诊断为PCD,因此,电镜下纤毛活检是确诊PCD最可靠的方法。但需注意电镜检查要求病情稳定在相对健康部位取材,同时通过纤毛上皮细胞培养排除炎症所致的继发性纤毛损害[8-9]。PCD为常染色体隐性遗传或X连锁相关的双等位基因突变的遗传性疾病。目前已证实的双等位突变基因有32个,第1例患儿基因检测发现1个突变点,未明确基因表型关系可能与目前仍有约1/3 PCD患者尚未证实突变基因的位置有关[9]。目前通过全外显子测序及2代基因测序达到确诊及发现新的突变基因。
目前无恢复纤毛功能的特异性治疗手段,可借鉴囊性纤维化、支气管扩张的治疗原则,即预防、控制感染,促进分泌物排出,支气管扩张剂缓解喘息及气道梗阻,减少复发,防止肺功能进一步损害[11-12]。目前国内不主张非急性感染患者预防性使用抗生素,主张进行日常生活指导,长期随访预防和减缓支气管扩张的进展及肺功能的恶化[13]。刘娇等[6]报道,PCD患儿应全程接受预防接种,包括百日咳、麻疹、B型流感嗜血杆菌、肺炎链球菌、流感病毒疫苗等防止病原体感染。而霍开明等[14]研究提示,口服益生菌可以调节免疫功能预防小儿反复呼吸道感染,或许能为PCD的诊治拓宽思路。长期使用克林霉素对PCD患者的呼吸系统病变有明显的改善[15],可见对于儿童PCD的治疗目前仍然在探索中,但仍然需要真实、有效的大样本研究来支持观点。肺功能损害的严重程度与纤毛结构异常类型无关,可反映患儿治疗是否恰当,因此,肺功能检查可评估急性感染期治疗效果。局限性支气管扩张或肺不张患者需谨慎行肺叶切除[13],终末肺病患者有成功进行肺移植或心肺移植的报道[15]。
PCD症状、体征存在差异,因此,对于反复出现呼吸道感染症状患儿,尤其下呼吸道感染学龄期后的患儿,不论有无内脏转位,应考虑PCD的可能;结合本研究病例,对于大龄儿童患不典型哮喘或病情不能用哮喘解释时更应考虑PCD可能,应完善相关检查及治疗。
——水芹主要害虫识别与为害症状

