池塘循环流水养殖模式中浮游植物群落结构的空间变化研究
张晓蕾,王 强,张国奇,周 陆,李廷发,张 玉,赵思雅
(1.华东师范大学,上海 201100; 2.上海市松江区水产良种场,上海 201616;3.鲲瑛 (上海) 生物科技有限公司,上海 201613)
池塘养殖是中国一种主要的淡水养殖方式,2018年中国淡水池塘养殖面积为266.7×104hm2,占总淡水养殖面积的51.8%[1]。但随着水产养殖规模的不断扩大,池塘养殖带来的环境问题也日益突出,例如鱼类吃剩的残饵以及鱼类的排泄物分解会使水体中不同形态的氮、磷物质浓度升高[2-3],不仅会影响养殖物种的正常生长及品质,也容易导致养殖周边的水质恶化[4-5]。因此,为了更加合理地利用自然资源,减小对环境的负面影响,实现水产养殖业健康可持续发展,开发环境友好的养殖技术迫在眉睫。池塘循环流水养殖模式 (In-pond raceway system, IPRS) 是基于池塘的集约化生产系统,是一种高产、高效且环保的养殖方式[6]。每个系统根据养殖水体面积确定水槽数量,鱼放养于水槽中,池塘的其余部分用于养殖水体净化[7]。池塘中养殖槽前段的推水增氧设备能将养殖水从养殖区推入净化区,通过净化区中的植物浮床、滤食性鱼类等对养殖水体中的高浓度氮、磷等营养盐进行吸收净化,净化后的水体再次被推入养殖区,不断循环。
浮游植物是IPRS中水生生态系统的重要生物类群,一些浮游植物在生长同化过程会消除水体中的氮元素[8],而蓝藻门的一些浮游植物会利用空气中的氮气,发生固氮过程[9]。浮游植物的分泌物同样会对微生物的群落结构造成影响[10-12]。因此,浮游植物的种类及密度对水体中氮、磷等营养物质的循环具有重要意义。此外,由于浮游植物生命周期短,对环境变化响应迅速[13],常被作为水质健康状况的重要指示生物[14]。
对于IPRS而言,经过净水区后水质能否达到养殖用水要求是该系统成功的关键。目前有关IPRS的研究主要围绕该系统的经济效益及养殖系统的优化[8,15-17],而对池塘循环系统内部净水区的水质及生态特点却少有关注。为进一步了解该系统水体循环过程中生态结构的动态变化,揭示该系统内净水区水质的变化特点,本文研究了生长季草鱼(Ctenopharyngodon idella) 养殖的IPRS中浮游植物的群落结构特征,为优化IPRS提供理论支持和实践指导,进而促进水产养殖业的可持续发展。
1 材料与方法
1.1 养殖系统概况
本文以上海市松江区水产良种场IPRS为研究对象。该系统池塘近正方形,总面积26 680 m2,池深1.8 m。该系统内集聚养殖池规格为长22 m×宽5 m×深1.8 m,共10条,其两端开口,均设有拦鱼网,集聚式养殖池下游连接集污收集池。上游安装曝气推水设备,将养殖区水体推入净化区。净化区共约400 m,通过植物浮床、滤食性鱼类等作用对养殖尾水进行净化处理,水体净化后再次进入养殖区。
试验期间,养殖区的草鱼数量约为3×104尾,质量约 1×105kg,密度约 152 尾·m−3;净化池中鳙 (Aristichthys nobilis) 约900尾,1 500 kg,鲢 (Hypophthalmichthys molitrix) 约 2 300尾,3 000 kg。投喂饵料使用浮性膨化饲料,粗蛋白质量分数在32%以上,以“定位、定时、定量、定质”的原则,每日投饵3次。随温度升高,鱼类摄食能力增强,每日增加投饵至4次。日投饵量视鱼类摄食及活动情况、水温和天气情况而定。随着鱼体的增大,饵料粒径由4 mm×3 mm逐渐增加到10 mm×8 mm。
1.2 样品采集及测定
于2020年7月—9月对该池塘3个采样点进行采样,每次采样时间在上午10:00—11:00,以最大程度减小实验误差。采样位点见图1,位点1位于养殖槽末端,由于大量的残饵以及鱼类的排泄,导致该位点水体中含有大量的氮磷等营养物质;位点2位于净化池中段,位点1与位点2之间设置了植物浮床,通过植物对水体中的营养盐进行吸收,植物浮床同时为微生物提供了适宜生境,硝化细菌、反硝化细菌等的作用有助于降低水体中氮、磷营养盐浓度;位点3位于净化池末段 (即养殖槽前端),为约300 m的开放水体空间。
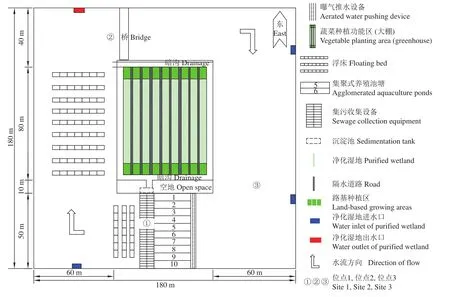
图1 池塘循环流水养殖系统示意图Figure 1 Diagram of in-pond raceway system
1.2.1 水质样品采集及测定 使用容积为2.5 L的采水器分别在每个采样点的水面以下0.5 m取水样1 L,带回实验室测定总氮 (TN)、氨氮、硝酸盐、总磷 (TP)、电导率 (EC)、pH、悬浮物。总氮采用碱性过硫酸钾消解紫外分光光度法测定 (HJ636—2012),总磷采用钼酸铵分光光度法测定 (GB/T 11893—1989),氨氮采用纳氏试剂分光光度法测定 (HJ535—2009),硝酸盐采用紫外分光光度法测定 (HJ/T 346—2007),pH采用便携式pH计测定,电导率采用便携式电导率仪测定,悬浮物采用重量法测定 (GB/T 11901—1989)。
1.2.2 浮游植物样品采集及测定 使用容积为2.5 L的采水器分别在每个采样点的水面以下0.5 m取水样1 L,加入鲁哥试剂对浮游植物进行固定。固定后的浮游植物样品静置沉淀48 h后进行沉淀和浓缩供镜检。在显微镜下对浮游植物固定样品进行种类鉴定及计数。
1.3 数据分析
1.3.1 优势度的计算 Mcnaughton优势度指数(Y):

式中ni为第i个浮游植物种类的个体数量(个);N为浮游植物个体的总数 (个);fi为第i种在研究期间出现的月份频率。本研究将Y>0.02的浮游植物定为优势种[18]。
1.3.2 多样性指数的计算 采用浮游生物的Shannon-Wiener指数 (H')、Pielou均匀度指数 (J')对该系统中浮游生物多样性进行分析评价。各指数的计算公式为:

式中S为总物种数 (个);Pi为浮游生物物种i在总个体中所占的比例,Pi=ni/N;ni物种i的个体数;N为所有种类个体数 (个)。Hmax为H'的最大值,其值等于lnS。
1.3.3 浮游植物群落结构与环境因子的关系分析
运用Canoco 5.0软件对系统内浮游生物优势种丰度与环境因子进行排序分析。首先对浮游生物优势种与环境数据进行lg(x+1) 转换 (不包括pH),使其趋于正态分布。然后进行除趋势对应分析 (detrended correspondence analysis, DCA),以确定其属于单峰型分布或线性分布,根据第一轴长度选择适当的排序方法,若第一长轴小于3则采用基于线性的冗余分析 (Redundancy analysis, RDA),若大于4,则选用典范对应分析 (Canonical correspondence analysis, CCA),若介于3~4,则2种分析方法均可。本文DCA结果显示浮游植物及浮游动物的第一轴长度均小于3,因此选择冗余分析对浮游生物与环境因子的关系进行研究。
2 结果
2.1 水质指标的空间变化情况
水质指标的空间变化情况见表1。试验期间,水温变化介于22.4~32.5 ℃,各位点的温度差异较小;悬浮物位点2最低,位点3最高;位点1至位点3,硝酸盐、氨氮、总氮、总磷、电导率均有所下降;pH在7上下波动,水质偏中性;3个位点的氮磷比约为2.3。
表1 水质指标的空间变化情况Table 1 Spatial changes in water-quality index
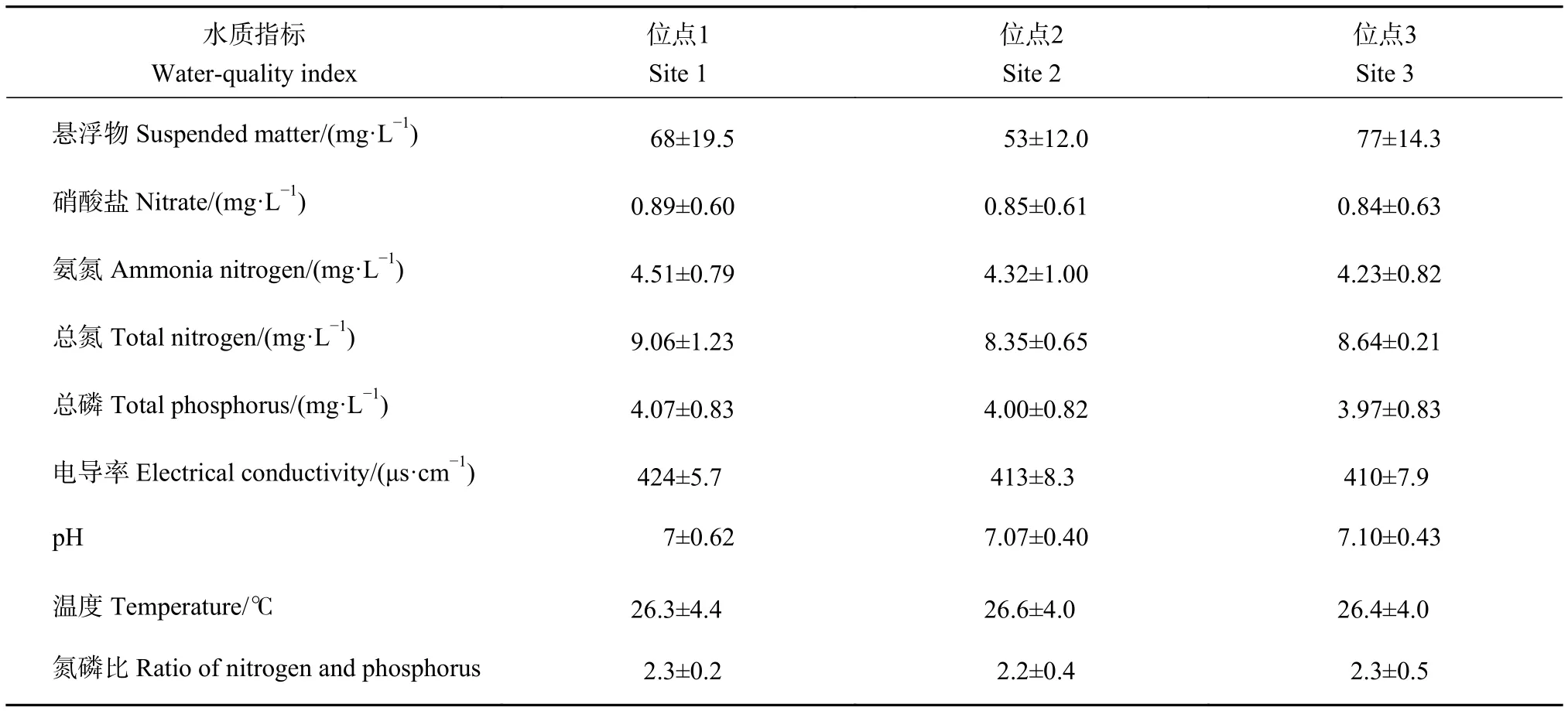
表1 水质指标的空间变化情况Table 1 Spatial changes in water-quality index
位点1 Site 1水质指标Water-quality index位点2 Site 2位点3 Site 3悬浮物 Suspended matter/(mg·L−1) 68±19.5 53±12.0 77±14.3硝酸盐 Nitrate/(mg·L−1) 0.89±0.60 0.85±0.61 0.84±0.63氨氮 Ammonia nitrogen/(mg·L−1) 4.51±0.79 4.32±1.00 4.23±0.82总氮 Total nitrogen/(mg·L−1) 9.06±1.23 8.35±0.65 8.64±0.21总磷 Total phosphorus/(mg·L−1) 4.07±0.83 4.00±0.82 3.97±0.83电导率 Electrical conductivity/(μs·cm−1) 424±5.7 413±8.3 410±7.9 pH 7±0.62 7.07±0.40 7.10±0.43温度 Temperature/℃ 26.3±4.4 26.6±4.0 26.4±4.0氮磷比 Ratio of nitrogen and phosphorus 2.3±0.2 2.2±0.4 2.3±0.5
2.2 浮游植物群落结构的空间变化
2.2.1 种类组成与优势种 试验期间共鉴定出池塘中浮游植物7门99种,分别为硅藻门、绿藻门、蓝藻门、裸藻门、隐藻门、甲藻门、金藻门。其中绿藻门种类数最多 (54种),其次为蓝藻门(18种),再次为硅藻门 (16种),裸藻门、隐藻门、甲藻门、金藻门种类数较少,分别为6种、3种、1种、1种 (图2)。将优势度大于0.02的种类作为优势种,试验期间优势种共16种,其中蓝藻门占比最大 (9种),分别为中华平裂藻 (Merismopediasinica)、银灰平裂藻 (M.glauca)、钝顶螺旋藻 (Spirulinaplatensis)、铜绿微囊藻 (Microcystis aeruginosa)、水华微囊藻 (M.flosaquae)、不定微囊藻 (M.incerta)、小形色球藻 (Chroococcusminor)、点形粘球藻 (Gloeocapsapunctata)、微小平裂藻(M.tenuissima);绿藻门共5种,分别为四角十字藻 (Crucigenia quadrata)、四足十字藻 (C.tetrapedia)、直角十字藻 (C.rectangularis)、四尾栅藻(Scenedesmusquadricauda)、双尾栅藻 (S.bicaudatus);硅藻门共2种,分别为小环藻 (Cyclotellasp.)、模糊直链藻 (Melosiraambigua)。

图2 池塘中浮游植物种类组成百分比Figure 2 Composition of phytoplankton species in ponds
对浮游植物种类组成进行空间分析,位点1至位点3种类数有下降的趋势,位点1共鉴定出71种,位点2鉴定出67种,位点3鉴定出61种,均为绿藻门种类数最多,其次为蓝藻门(表2)。

表2 浮游植物种类数的空间变化Table 2 Spatial changes in number of phytoplankton species
2.2.2 浮游植物密度及生物量 浮游植物的密度、生物量及变化见表3、表4、图3。各月位点2、3的浮游植物密度均高于位点1,位点2较位点1平均增加了65%,位点3较位点1平均增加了44%。8月、9月位点3的浮游植物密度均大于位点1,小于位点2。浮游植物生物量的变化与密度的变化趋势相同,均为位点2和3大于位点1,8月、9月位点3的浮游植物生物量均大于位点1,小于位点2。

表3 浮游植物密度与生物量的空间变化Table 3 Spatial changes of phytoplankton density and biomass

表4 浮游植物主要类群密度的空间变化Table 4 Spatial changes in density of major phytoplankton groups

图3 浮游植物密度与生物量的空间变化Figure 3 Spatial changes of phytoplankton density and biomass
对池塘内不同位点的主要浮游植物种类进行分析。试验期间池塘中浮游植物的密度优势类群均为蓝藻门。位点2的蓝藻、硅藻、绿藻的丰度与生物量均值均高于位点1、3,位点3的绿藻、硅藻的丰度与生物量均值与位点1相近,位点3的蓝藻密度与生物量高于位点1。具体变化见图4。
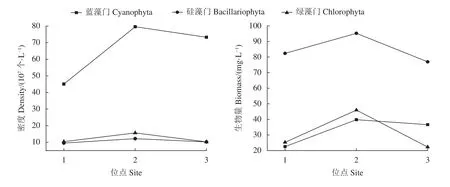
图4 蓝藻、绿藻、硅藻的密度与生物量的空间变化Figure 4 Spatial changes of density and biomass of Cyanophyta, Chlorophyta and Bacillariophyta
对池塘中不同位点的浮游植物的相对密度变化进行分析。试验期间均为蓝藻门的相对密度最大,其次为绿藻门,再次为硅藻门,裸藻门、隐藻门、甲藻门、金藻门的相对密度均较小。从位点1至位点3蓝藻的相对密度不断增加,分别为69.2%、73.8%、78.0%,硅藻及绿藻的相对密度均不断减少,从位点1至位点3绿藻的相对密度分别为16.0%、14.5%、10.9%,硅藻的相对密度分别为14.6%、11.3%、10.9% (图5)。

图5 池塘中浮游植物相对密度的空间变化Figure 5 Spatial changes of relative density of phytoplankton
2.2.3 多样性指数与均匀度 浮游植物的多样性指数与均匀度详见表5,变化情况见图6。总体上位点2的多样性均值与均匀度均大于位点3及位点1。位点1与位点3之间变化波动较大。

表5 浮游植物多样性指数与均匀度指数的空间变化Table 5 Spatial variation of Shannon-Wiener diversity index and Pielou evenness index of phytoplankton
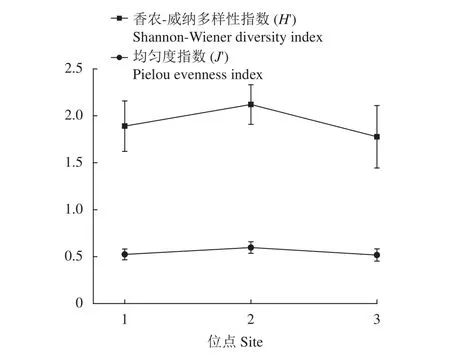
图6 池塘中浮游植物香农-威纳多样性指数与均匀度指数的空间变化Figure 6 Spatial changes of Shannon-Wiener diversity index and Pielou evenness index of phytoplankton
2.3 浮游植物与环境因子的关系分析
在分析浮游植物与环境因子的关系时,选择池塘内的浮游植物优势种以及主要的环境因子。选择的环境因子为温度、总氮、总磷、氨氮、硝酸盐、悬浮物、电导率和pH,共8种,选用的浮游植物优势种共16种。首先分别对浮游植物优势种的密度与主要环境因子进行除趋势对应分析 (DCA),得出第一长轴小于3,因此均采用冗余分析方法(RDA)。冗余分析的排序图结果见图7。

图7 池塘中浮游植物与环境因子的冗余分析排序图蓝色箭头代表选用的浮游植物优势种;ga.小环藻属;gb.模糊直链藻;la.四角十字藻;lb.四足十字藻;lc.直角十字藻;ld.双尾栅藻;le.四尾栅藻;ba.中华平裂藻;bb.银灰平裂藻;bc.钝顶螺旋藻;bd.铜绿微囊藻;be.水华微囊藻;bf.不定微囊藻;bg.小形色球藻;bh.点形粘球藻;bj.微小平裂藻;红色箭头代表环境变量;TP.总磷;Tem.温度;TN.总氮;NO3.硝酸盐;SS.悬浮物;EC.电导率;pH.酸碱度;NH4.氨氮Figure 7 RDA sequencing map of phytoplankton and environmental factors in pondThe blue arrows represent selected phytoplankton dominant species;ga.Cyclotella sp.; gb.M.granulata; la.C.quadrata; lb.C.tetrapedia;lc.C.rectangularis; ld.S.bicaudatus; le.S.quadricauda; ba.M.sinica;bb.M.glauca; bc.S.platensis;bd.M.aeruginosa; be.M.flosaquae;bf.M.incerta; bg.C.minor; bh.G.punctata; bj.M.tenuissima; the red arrows represent environmental factors; TP.Total phosphorus;Tem.Temperature; TN.Total nitrogen; NO3.Nitrate;SS.Suspended substance; EC.Electrical conductivity;pH.Acid-base scale; NH4.Ammonia nitrogen
浮游植物的分析结果显示,轴1可解释浮游植物变化的70.85%,轴1与轴2累计可解释浮游植物变化的82.96%,浮游植物前两轴与环境因子的相关性系数均为1,说明该排序轴能够很好地反映浮游植物丰度变化与环境因子的关系。试验期间蓝藻门的主要优势种中华平裂藻与总磷、温度呈正相关,与硝酸盐呈负相关;不定微囊藻的细胞密度与总磷、温度呈正相关,与硝酸盐、电导率呈显著负相关;硅藻门主要优势种小环藻的密度与硝酸盐呈正相关,与总磷、pH呈负相关。
3 讨论
IPRS中的推水装置以约0.5 m·s−1的速度推水,该装置将密集养殖区中由于鱼类排泄及残饵而富含氮、磷营养盐的养殖污水推入净化区,净化区中的植物浮床能够直接吸收利用水体中的氮、磷营养盐[19],另外植物根系能够为微生物提供更大的生存面积,有利于硝化细菌、反硝化细菌等的生长和繁殖,促进硝化作用、反硝化作用[20],净化区中的鲢、鲫 (Carassius auratus) 同样能够吸收利用水体中的营养盐,从而使得池塘不同位点营养盐等其他环境因子发生变化。而浮游植物对环境因子的响应迅速,且不同浮游植物对环境变化具有不同的响应机制[21],因此会导致不同位点的浮游植物群落结构产生明显差异。
本研究结果显示,IPRS中的推水及净化系统影响了不同位点的浮游植物群落结构。净化区中段及末段浮游植物的密度较养殖区均有显著增加,可能是由于养殖区高密度的鱼类活动导致水体悬浮物增加,从而形成光限制,抑制浮游植物生长;另外悬浮物颗粒还会吸附藻细胞沉降,也会降低水体中浮游植物的密度[22-24]试验期间浮游植物的优势类群为蓝藻门,总体来看净化区中段及末段的蓝藻门丰度与生物量均高于养殖区。许多蓝藻具有固氮能力[25-26],这会导致外源氮负荷增加,而这也是蓝藻在低氮磷比水体中易占优势的重要原因之一。Howarth等[27]研究表明,在富营养化水体中蓝藻固氮对于水体中总氮负荷贡献介于6%~82%。当水体中氮磷比小于13时蓝藻会进行固氮作用,且氮磷比越小,蓝藻的固氮作用越大[9]。在该池塘中不同位点的氮磷比均约为2.3∶1,说明蓝藻的固氮作用会贡献一部分外源氮负荷。净化区的蓝藻生物量均高于养殖区,说明净化区通过蓝藻的固氮作用向水体中输入的氮可能大于养殖区。硅藻、绿藻的密度与生物量均为净化区中段最高。试验期间各月净化区中段浮游植物的多样性指数与均匀度均大于养殖区末段和前段。多样性指数与均匀度越高,说明水体状况越好,因此净化区中段的水体较养殖区前后段的浮游植物群落结构稳定性更高。
由于不同浮游植物具有不同的生理特征,因此适宜其生存的环境也有所差异,环境因子的变化也会对浮游生物的密度产生相应的影响。综合考虑冗余分析的结果,循环池塘流水养殖水体浮游植物密度的变化主要与温度、氮、磷营养盐有关。蓝藻门主要优势种均与温度呈正比,说明蓝藻在温度较高的环境中也能很好生存。有研究表明由于蓝藻适宜在高温环境下生长,耐低光照度和较高的pH,因此容易在夏季成为优势种,且抑制其他种类的生长[28]。冗余分析结果显示,硅藻门的主要优势种均与温度呈负相关,Silva等[29]研究发现硅藻偏好低温环境,喜在18 ℃以下的水体中生存,而本次试验期间平均温度较高,这可能是导致试验期间硅藻丰度远低于蓝藻的原因之一。由于浮游植物能够利用水体中的氮、磷等营养物质,因此水体中的氮、磷营养元素含量会影响浮游植物的群落结构。冗余分析结果表明,蓝藻密度与总磷浓度呈正相关,与硝酸盐浓度呈负相关;硅藻密度与硝酸盐成正相关,与总磷呈负相关。试验期间水体中的氮磷比均约为2.3∶1,为氮营养盐限制,蓝藻能够在较广的氮磷比范围内良好生长[28],这可能是系统内蓝藻丰度占很大优势的另一原因。李卓佳等[30]研究也表明绿藻喜在高氮磷比的水体中生存,而蓝藻能够耐受较低氮磷比的生存环境,但水体中蓝藻丰度过大对养殖水体健康不利[31]。

