盐酸可洛派韦胶囊在HCV感染者中的耐受性和药代动力学分析
娄金凤,张 洪,王 欢,史继峰, 吴秋华,丁艳华,牛俊奇,朱晓雪
1 吉林大学第一医院 a.干部病房八疗区,b.Ⅰ期药物临床试验病房,c.肝胆胰内科,长春 130021;2 北京凯因科技股份有限公司,北京 100176
丙型肝炎是一种由HCV造成的慢性感染性疾病。HCV主要有6种基因型(GT),我国常见的是GT-1b(56.8%)和GT-2a(24.1%)[1]。HCV的直接抗病毒药物(DAA),包括非结构蛋白(NS)3/4A蛋白酶抑制剂、NS5A抑制剂和NS5B聚合酶抑制剂等[2]。
本研究中的盐酸可洛派韦胶囊由北京凯因科技股份有限公司生产并提供,为自主研发的化学1类药,在临床前试验研究中具有良好的抗病毒活性,是一种泛基因型NS5A抑制剂。本试验旨在评价盐酸可洛派韦胶囊在HCV感染受试者单次/多次给药后的耐受性、药代动力学和抗病毒活性学特征。
1 资料与方法
1.1 研究对象 选取2016年11月—2017年1月吉林大学第一医院收治的丙型肝炎患者作为研究对象。主要入选标准:年龄18~65岁,性别不限;BMI在18~28 kg/m2;既往未接受过任何已批准上市或临床研究中用于丙型肝炎抗病毒治疗的DAA;既往6个月未接受过中草药、干扰素、免疫调节剂、胸腺肽或其他免疫刺激因子等抗病毒治疗;HCV RNA≥1×105IU/ml(Roche COBAS Taqman,检测下限为15 IU/ml)和抗HCV阳性;血清ALT≤10倍正常值上限;FibroScan检测值≤17.5 kPa等。主要排除标准:临床显示肝功能失代偿者;肌酐清除率≤ 60 ml/min;合并 HBV、HIV或梅毒感染者;孕妇、哺乳期妇女或研究期间有生育计划者;有临床意义的疾病或疾病史,或可能干扰受试者治疗、耐受性及疗效评价或方案依从性的任何其他医学疾病。
1.2 研究设计 本研究是单中心、随机、双盲、安慰剂对照、剂量增加的多剂量单次/多次给药研究。预设4个剂量(30、60、90、120 mg)及安慰剂组,其中120 mg剂量组是否实施需根据前3个剂量组药代动力学和抗病毒活性检测结果进行判断。30 mg和60 mg剂量组每组10例受试者,其中8例接受试验药物,2例接受安慰剂;90 mg和120 mg剂量组每组8例受试者,其中6例接受试验药物,2例接受安慰剂。不同剂量组的受试者依次入组,受试者连续给药3 d,1 次/d;在 D2 和 D6 进行耐受性评价; D8、D10 进行随访;在前一组耐受性评价为耐受的前提下进行下一组试验,在单次给药耐受的前提下进行多次给药研究。
1.3 安全性和耐受性评估 采用不良事件记录 、临床实验室检查(血常规、血生化、凝血常规和尿常规等)、生命体征(血压、脉搏及体温)、12导联心电图(ECG)、心脏彩超和体格检查等方式评估药物的安全性和耐受性。
1.4 药代动力学评估 首次给药前15 min 内(基线),给药后15 min、30 min、45 min、1 h、2 h、3 h、4 h、6 h、8 h、12 h、24 h;末次给药前15 min 内,给药后 5 min、30 min、45 min、1 h、2 h、3 h、4 h、6 h、8 h、12 h、24 h、36 h、48 h、72 h采集血液样品进行药代动力学研究分析。所有采集的样品经色谱分离后使用LC-MS/MS进行检测。主要药动学参数包括:药物血浆半衰期(t1/2)、达峰时间(Tmax)、最大血药浓度(Cmax)、从首次给药开始外推至无穷大的稳态血浆浓度-时间曲线下面积(AUC0-∞)、药物平均滞留时间(MRT)、口服清除率(CL/F)等药代参数。由每个受试者各时间点的血药浓度分别绘出血浓-时间曲线;采用 WinNonlin 6.4软件分析并计算药代动力学参数。
1.5 抗病毒活性评估 在每组首次给药前15 min内(基线)、首次给药后 2 h、4 h、8 h、24 h、48 h、72 h、96 h、120 h、168 h和216 h采集血液样品进行抗病毒活性研究。用 Roche COBAS Taqman HCV Test试剂盒测定 HCV RNA,定量下限为15 IU/ml。
1.6 耐药相关替代突变(RASs)检测 在首次给药前15 min内(基线)和首次给药后72 h与216 h采集血液样品,采用直接测序法检测NS5A基因的RASs。
1.7 伦理学审查 本研究经吉林大学第一医院伦理委员会批准,批号:2016L04322、2016L04323,并在中国临床试验登记与信息公示平台登记,登记号:CTR20160906。

2 结果
2.1 受试者的人口学资料和基线特征 共入组并随机化受试者36例,其中GT-1b 22例、GT-2a 14例。各组间人口学基线指标基本相当(表1)。所有受试者均按照方案完成试验,无脱落或剔除受试者。
2.2 药代动力学分析
2.2.1 单次给药药代分析 药代动力学参数评价结果显示(表2),单次空腹给药(30、60、90、120 mg)盐酸可洛派韦胶囊,药物吸收迅速,人体内血药浓度和血药暴露量随着剂量的增加而增加(图1)。半衰期基本保持稳定,与剂量的递增无关。
2.2.2 多次给药药代分析 药代动力学参数评价结果显示(表3),盐酸可洛派韦多次给药吸收迅速,人体内血药浓度和血药暴露量随着剂量的增加而增加。半衰期基本保持稳定,与剂量的递增无相关性(图2)。多次给药参数与单次给药参数对比表明,30~120 mg范围内盐酸可洛派韦多次空腹给药在人体内没有明显的蓄积倾向。

图1 受试药物单次给药血药浓度-时间变化曲线
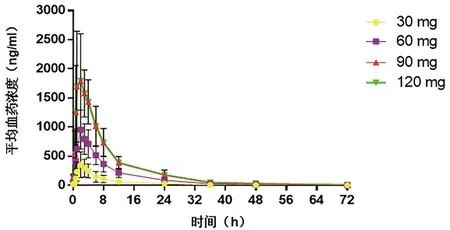
图2 受试药物多次给药血药浓度-时间变化曲线

表1 受试者人口学资料和基线特征
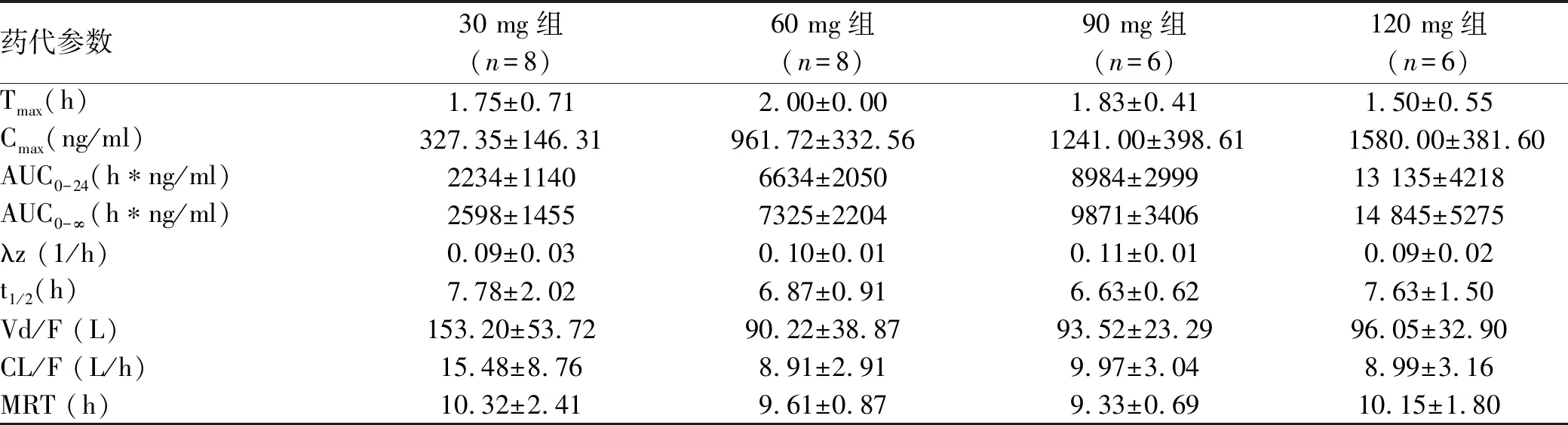
表2 受试药物单次给药药代动力学参数
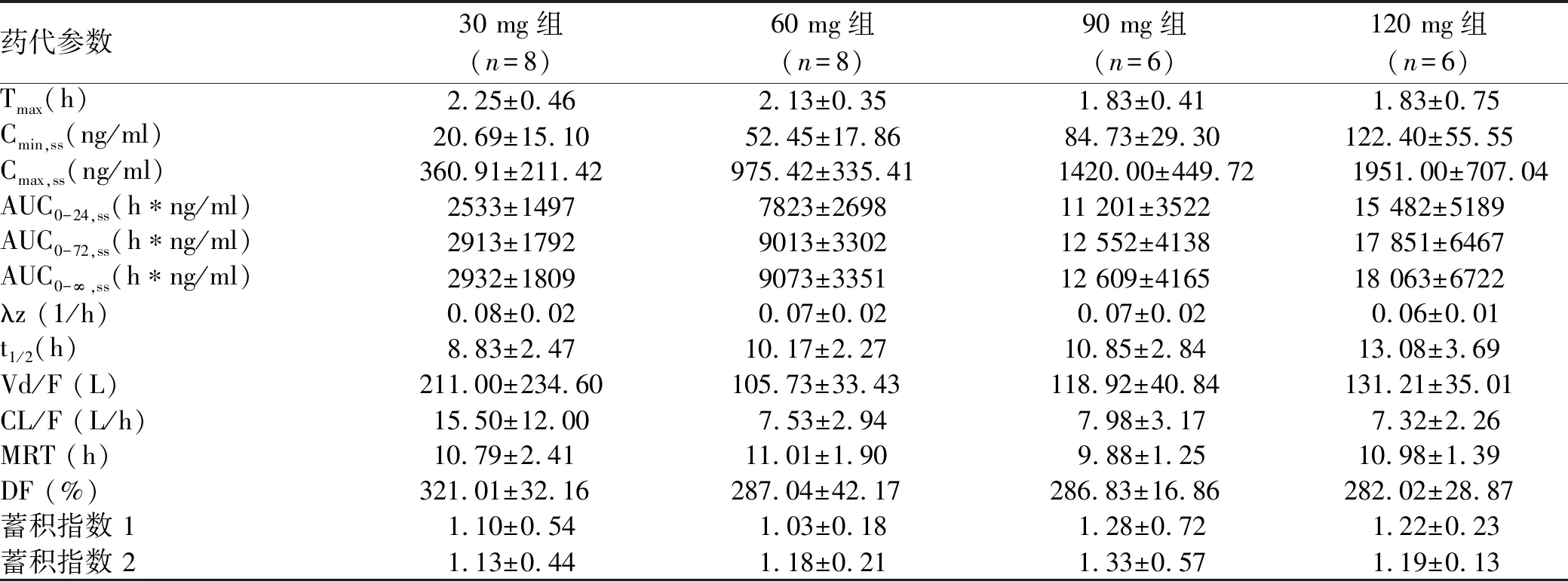
表3 受试药物多次给药药代动力学参数
2.3 抗病毒活性
2.3.1 基因1b型受试者服药后抗病毒活性数据分析 相比于基线,安慰剂组各检测时间点HCV RNA载量无明显变化,各治疗组HCV RNA 载量自给药2 h出现明显下降,并在24 h内下降最快;在48~120 h HCV RNA下降达最大水平;120 h 后,HCV RNA出现反弹。各剂量组间抗病毒活性有统计学意义(F=14.621,P<0.0001),其中,60 mg组(下降最大均值-4.06 log10IU/ml )HCV RNA载量自基线起下降幅度较30 mg组(下降最大均值-2.62 log10IU/mL)更明显(P=0.025),且与90 mg组(下降最大均值-3.92 log10IU/ml)和120 mg组(下降最大均值-4.09 log10IU/ml)相当(P值均>0.05)(图3)。

图3 基因1b型受试者服药后抗病毒活性
2.3.2 基因2a型受试者服药后抗病毒活性数据分析 相比于基线,安慰剂组各检测时间点HCV RNA载量无明显变化。相对于基线,各治疗组HCV RNA载量自给药2 h出现小幅下降,并在8~24 h内下降最快;在8~24 h内HCV RNA下降达最大水平;各治疗组HCV RNA载量自基线起下降最大值为1~1.5 log10IU/ml,组间差异无统计学意义(P值均>0.05)(图4)。
2.4 耐药性分析 36例受试者中,有31例(86.1%)在基线检出NS5A的RASs;其中GT-1b 81.8%(18/22),GT-2a 92.9%(13/14)。GT-1b受试者最常见R30Q(5/22,22.7%),GT-2a受试者最常见L31M(13/14,92.9%)。另外,1例GT-1b受试者基线未检出RASs,在首次给药后72 h和216 h 检出L28L/S。1例GT-2a受试者基线和首次给药后72 h均未检出NS5A RASs,首次给药后216 h检出Y93H和L31L/M/V。
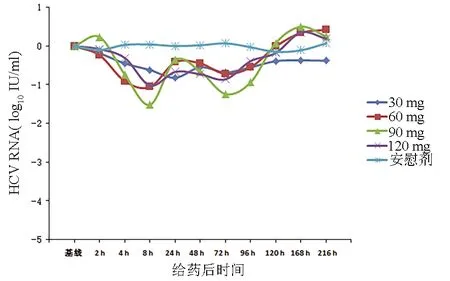
图4 基因2a型受试者服药后抗病毒活性
2.5 安全性评价 36例受试者中共有20例(55.5%)受试者报告了34例次治疗期不良事件,其中与研究用药有关的治疗期不良事件 19例次(包括15例受试者,41.7%)。最常见的(发生率≥10%)治疗期不良事件为各类检查结果,大多数为轻中度,包括ALT、AST升高、胆红素升高、GGT升高、PLT降低,均未经特殊处理后消失。所有剂量组均未发生重要不良事件及严重不良事件(SAE)。各试验组和安慰剂组不良事件和不良反应发生率相当,无明显剂量相关性。各类不良事件发生情况见表4。
3 讨论
本试验旨在研究不同剂量的盐酸可洛派韦胶囊在丙型肝炎患者中,连续短疗程(3 d)给药的耐受性、药代动力学和抗病毒效果,为盐酸可洛派韦胶囊Ⅱ期试验剂量选择提供依据。30~120 mg 剂量范围内,可洛派韦的血药浓度与暴露量随着剂量增加而升高;半衰期基本稳定,与药物递增无相关性。多次与单次相比,盐酸可洛派韦在人体内的吸收速度,血药浓度和暴露量无显著差异,多次给药无明显蓄积倾向。
与安慰剂组相比,盐酸可洛派韦在体内可强效抑制HCV GT-1b复制,受试者口服盐酸可洛派韦胶囊2 h后便可显著降低HCV RNA载量,并在24 h内最为明显;就HCV RNA平均下降水平而言,60 mg组优于30 mg组(P=0.025),且与90和120 mg组相当。盐酸可洛派韦在体内对GT-2a型受试者也有一定抑制作用,且各剂量组最大抑制水平相似。
本试验HCV NS5A的RASs监测数据显示,GT-1b和2a受试者RASs十分常见,尤其是GT-2a受试者。目前已知的、临床意义较大的NS5A RASs主要包括Q30(GT-1a)、L31、Q54(GT-1b)和Y93等[3-4]。本试验显示,GT-1b中最常见的RASs为R30Q,GT-2a为L31M。预存RASs在体内对GT-1b药物敏感性未见明显影响,而普遍存在的L31M在体内可明显降低GT-2a的药物敏感性。
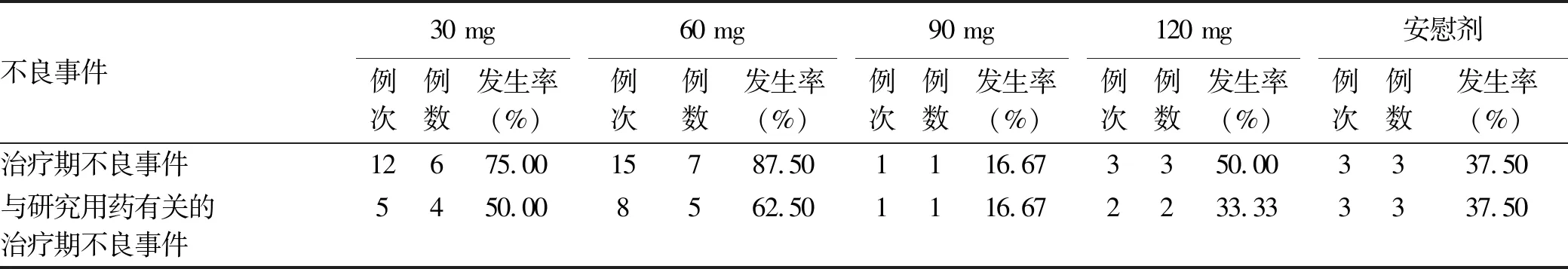
表4 各类不良事件发生情况及比较
随着DAA类抗HCV药物研发的深入,多药联合、更强效、更短疗程的泛基因型抗病毒治疗方案成为了丙型肝炎治疗的主流[5]。本研究中验证了盐酸可洛派韦在HCV感染者中的耐受性和有效性,并获取到药物在患者体内的吸收、分布与消除特性,为后续国产新型NS5A抑制剂联合其他DAA治疗丙型肝炎奠定了基础。
利益冲突声明:本研究不存在研究者、伦理委员会成员、受试者监护人以及与公开研究成果有关的利益冲突。
作者贡献声明:朱晓雪、丁艳华、牛俊奇负责研究设计,拟定写作思路;娄金凤、张洪负责收集数据,资料分析,撰写论文;史继峰负责指导研究,修改文章;王欢、吴秋华参与收集数据,文章修订。

