氯霉素降解菌的分离筛选及降解性能研究
陈茂祥 夏灵恩 毛乐佳 傅文韬 许双燕 郑华宝


摘要 从施用由猪粪堆肥制成的有机肥的土壤中筛选、驯化出一株能以氯霉素为唯一碳源的降解菌。经形态学特征观察及16S rDNA序列分析,初步鉴定该菌株属于假单胞菌属(Pseudomonas sp.),命名为CAP_CXMF。通过控制单一变量探讨菌株的最佳生长条件以及不同外加碳氮源对降解菌降解率的影响。结果表明,在氯霉素初始浓度为300 mg/L、接种量10%、温度20 ℃、转速160 r/min、pH为7时,该菌株对氯霉素的降解率达72.55%,添加一定量的酵母膏和葡萄糖后的降解率分别为73.15%和72.80%。该菌株对氯霉素有良好的降解性能,可以用于治理环境中的氯霉素污染问题,并为生物降解抗生素提供一种新的优势菌株。
关键词 氯霉素;降解菌;分离筛选;降解性能
中图分类号 X172 文献标识码 A 文章编号 0517-6611(2021)09-0061-05
doi:10.3969/j.issn.0517-6611.2021.09.017
Abstract Isolating and screening a highly efficient chloramphenicol-degrading strain with chloramphenicol as the sole carbon source from soil applying organic fertilizer made from pig manure compost. The strain named as CAP_CXMF was initially identified as Pseudomonas sp. by morphological observation and 16S rDNA sequence analysis. The growth and the degradation of CAP were investigated in this research. The results showed that the chloramphenicol degradation rate with the initial concentration of 300 mg/L, the inoculation amount was 10%, the temperature was 20 ℃, the rotation speed was 160 r/min, and the pH was 7, reached 72.55%. The strain had a high degradation efficiency and the degradation rate after adding yeast extract was 73.15%, as well as adding glucose was 72.80%. Due to its good degradation performance, it could be used for the treatment of chloramphenicol antibiotic pollution, providing a new dominant strain for the biological treatment of chloramphenicol.
Key words Chloramphenicol;Degrading strain;Isolation and screening;Degradation property
目前,抗生素的濫用尤其是在畜牧业中的滥用已成为重要的环境问题[1]。2013年,抗生素在畜牧业中的使用量占总使用量的50%以上,已经高于在人类中的使用量[2]。因此,2016年9月G20杭州峰会提出谨慎使用抗生素并考虑抗生素在可负担和可获得性上所面临的挑战和对公共卫生的影响[3]。氯霉素(chloramphenicol,CAP)作为一种广谱抗生素,近年来广泛应用于畜牧业中畜禽的疾病控制和治疗方面[4]。氯霉素在水产、畜牧业中使用后,会随着畜禽粪便的排放以及生产氯霉素类药物废水的排放进入环境,导致大量氯霉素残留在环境中,容易造成环境风险[5]。氯霉素注射进入家畜后容易在其体内残留,之后体内残留有氯霉素的家畜被人类食用,会随之进入人体,残留在人体内的氯霉素会引起人体再生障碍性贫血对人类健康产生极大的威胁[6-7]。因此2002年我国出台法律,禁止氯霉素在食品动物中的使用[8]。但因其广泛高效的抗菌能力、低廉的价格等特点被过量使用,目前环境中的氯霉素残留量问题仍旧不容忽视。高剑容[9]监测了深圳市龙岗区南湾街道辖区内水产品兽药残留量,分析得出该辖区内海水贝类氯霉素残留问题较突出。陈金玉等[10]对广州市市售水产品氯霉素残留情况进行测定分析,得出氯霉素的检出率为2.5%,说明部分水产品仍存在氯霉素污染问题。因此如何处理滥用后残留的氯霉素,已成为当下亟待解决的一个环境问题。
目前常规处理工艺较难去除氯霉素,因此许多学者研究出了多种解决氯霉素问题的方法。王玲丽[11]利用活性炭吸附饮用水中的氯霉素,采用微波(MW)技术再生达到饱和吸附的活性炭,然后利用再生后的活性炭再次吸附水中氯霉素,研究其对氯霉素吸附性能的变化,结果表明,利用片状活性炭当氯霉素初始浓度为1 000 mg/L时,饱和吸附量为24 mg/g,利用MW处理4 min后经5次再生,再生率可达85%以上且性能稳定。有研究通过紫外激活过硫酸盐(UV/PS)去除水中的氯霉素并得到了较好的处理效果[12]。多种处理方法的联用能有效提高处理效率,有研究利用生物阴极还原降解氯霉素[13],得出24 h下生物阴极氯霉素还原效率远高于相同条件下非生物阴极氯霉素还原效率,证明了生物阴极工艺处理氯霉素的可行性。尽管很多高效去除方法被陆续研究得出,但氯霉素本身性质稳定、难降解,单用物理、化学方法难以将其去除,运用复杂的工艺处理又会增加成本不具经济性,而生物自然降解法对环境扰动小投资少,为一种具有广阔前景的处理方法。但因生物处理氯霉素过程中,氯霉素和氯化物对普通生物有较强的抑制作用[14],所以需要一种能耐受并降解氯霉素的菌株,进行高效的生物处理。赵梦君[15]从污泥中分离出一株氯霉素高效降解菌LMS-CY,该菌株能在24 h内100%降解100 mg/L氯霉素,说明自然中存在高效降解氯霉素的菌株,可用于生物处理氯霉素。因此该研究旨在从施用畜禽粪便制成的有机肥的土壤中筛选出能降解氯霉素的高效降解菌,并研究其降解特性,提供一种能高效降解氯霉素的新菌株,为今后制备高效降解氯霉素的菌剂奠定基础。
1 材料与方法
1.1 仪器
Agilent 1260型高效液相色谱仪(HPLC);C18色谱柱(250 mm×4.6 mm,5 μm,Waters,USA);HPX-9032MBE型电恒温培养箱(上海博讯);YXQ-75SⅡ型高压蒸汽灭菌锅(上海博讯);UV-5100型紫外分光光度计(上海元析);THZ-98AB型摇床(上海一恒);DS-5510DTH型超声波清洗机(上海生析);Mini-15K型高速离心机(杭州奥盛);YR-PTB型真空泵(上海亚荣)。
1.2 试剂
LB培养基:蛋白胨10 g、酵母提取物5 g、NaCl 10 g、H2O 1 L,调pH为7.0。配制固体培养基需加琼脂粉16 g。
无机盐培养基:NH4NO3 1 g、KH2PO4 0.5 g、K2HPO4·3H2O 1.5 g、NaCl 1 g、MgSO4·7H2O 0.2 g、H2O 1 L,调pH为7.0。
氯霉素标准品:购自生工生物工程(上海)股份有限公司,純度97%。
1.3 氯霉素降解菌的筛选驯化
1.3.1 菌种来源。
菌种取自浙江省杭州市富阳区有机肥制造厂经一年施肥的菜地土壤。该厂有机肥由猪粪和秸秆制成,存在氯霉素残留,施过该有机肥的土壤长期受氯霉素污染。
1.3.2 菌株驯化、分离和纯化。
取10 g新鲜土壤,加至含50 mg/L氯霉素的100 mL无机盐培养基中,置于150 r/min、30 ℃摇床中振荡培养3 d。从培养得到的菌液中以10%接种量转接至含50 mg/L氯霉素的100 mL无机盐培养基中,在相同条件下继续培养3 d。提高氯霉素浓度至75 mg/L,在相同条件下驯化培养3 d,提高氯霉素浓度至100 mg/L相同条件培养3 d。将培养所得菌液以10-1~10-6的梯度稀释,涂布在含100 mg/L氯霉素的LB固体培养基上,置于30 ℃培养箱中恒温培养2 d。从中挑选出经驯化后长势良好、菌落规则的菌株,分别转接至加入100 mg/L氯霉素的无机盐试管培养基中,30 ℃恒温振荡培养24 h。观察试管中降解菌生长状况,挑取长势良好的试管继续驯化传代培养,得到能高效专一降解氯霉素的菌株,同时将得到的菌株用30%甘油保存至-80 ℃超低温冰箱。同时,取0.1 mL菌液转接至浓度为25 mg/L的氯霉素无机盐试管培养基,150 r/min、30 ℃恒温振荡培养2 d后,取样测定氯霉素浓度。从25 mg/L的氯霉素浓度开始以25 mg/L的梯度逐渐提高氯霉素浓度至100 mg/L,在相同条件下培养,测定各浓度梯度菌株的降解率。经过分离纯化最终得到长势较好的氯霉素菌株,初步认定该菌对氯霉素具有较好的降解能力。
1.4 菌株鉴定
将降解菌涂布到培养基平板上,30 ℃恒温培养24 h后观察菌落形态,挑取对数生长期的菌株,送至浙江省农业科学院测试中心进行电子显微镜观察,对菌株个体形态进一步完善。同时,进行16S rDNA基因序列分析,以细菌总DNA为模版,利用细菌16S rDNA通用引物进行PCR扩增。
PCR扩增反应体系50 μL:模版DNA 1 μL,通用引物27F和1429R各1 μL,2×Taq Buffer Mix 25 μL,DDH2O 22 μL。PCR反应条件:95 ℃时预变性5 min,95 ℃时30 s,57 ℃时30 s,72 ℃时1.5 min共30个循环,最后72 ℃时延伸10 min。将所得序列在NCBI 中进行 BLAST 比对,研究其同源性,选取相近同源性的菌株构建进化树。
1.5 降解菌的降解特性研究
以底物浓度、接种量、温度、转速、pH、外加碳氮源为研究对象,将菌株培养活化后接入到100 mL氯霉素浓度为300 mg/L的无机盐培养基中,在不同培养条件下培养48 h,测定氯霉素浓度。每个处理组设3个重复样,并设空白对照。
1.5.1 初始底物浓度对氯霉素降解率的影响。
以10%接种量接种至底物浓度为10、50、100、200、300、400、500 mg/L的无机盐培养基中,置于150 r/min、30 ℃恒温摇床中振荡培养48 h,测定氯霉素浓度。
1.5.2 接种量对氯霉素降解率的影响。
以2%、4%、6%、8%、10%、12%接种量接种至100 mL氯霉素无机盐培养基中,置于150 r/min、30 ℃恒温振荡培养48 h,测定氯霉素浓度。
1.5.3 温度对氯霉素降解率的影响。
以10%接种量接种至100 mL氯霉素无机盐培养基,置于温度分别为20、30、40、50 ℃的恒温摇床中,150 r/min振荡培养48 h,测定氯霉素浓度。
1.5.4 转速对氯霉素降解率的影响。
在80、120、160、200 r/min的转速条件下,接种量10%的菌液至100 mL氯霉素无机盐培养基,30 ℃恒温培养48 h,测定氯霉素浓度。
1.5.5 pH对氯霉素降解率的影响。
调节100 mL无机盐培养基的pH分别为3、4、5、6、7、8、9,接种量10%的菌液,150 r/min、30 ℃恒温振荡培养48 h,测定氯霉素浓度。
1.5.6 外加碳氮源对氯霉素降解率的影响。
将菌株以10%的接种量接种至100 mL氯霉素无机盐培养基中,分别加入1.0 g/L的酵母膏、蛋白胨、葡萄糖、蔗糖、麦芽糖,150 r/min、30 ℃恒温振荡培养48 h,测定氯霉素浓度。
1.6 氯霉素残留量的检测
色谱柱为XTERRA RP C18柱(250 mm×4.6 mm,5 μm),流动相为0.1%甲酸水溶液(A相)-乙腈(B相)。流速为1 mL/min,柱温35 ℃,进样量10 μL,检测波长278 nm,依照梯度洗脱方式洗脱。在上述条件下使用高效液相色谱测定氯霉素残留量,计算降解率。
1.7 最优条件下降解率的测定
在最优底物浓度、接种量、温度、转速、pH条件下振荡培养48 h,测定氯霉素浓度,计算氯霉素降解率。
2 结果与分析
2.1 菌种鉴定
经过多重驯化分离和富集筛选,得到一株氯霉素降解菌CAP_CXMF,菌落形态呈圆形(图1A),白色、不透明,在透射电镜下观察菌株发现该菌以鞭毛运动(图1B)。氯霉素降解菌经PCR扩增后的16S rDNA大小为1 442 kb。在NCBI中进行BLAST比对,研究其同源性,初步鉴定为假单胞菌属(Pseudomonas sp.),最高相似度达99.79%。选取相近同源性的細菌,构建系统进化树,如图2所示。
2.2 生长曲线
从图3可以看出,CAP_CXMF从第1天开始就进入对数生长期,菌株持续增殖,第3天达到最大生长量,OD600约为1.46,之后菌株进入1 d的稳定期,第4天后该菌进入衰亡期。
2.3 降解菌的降解特性研究
2.3.1 初始底物浓度对降解菌降解率的影响。
从图4可以看出,底物浓度为300 mg/L时降解菌CAP_CXMF对氯霉素的降解率达70.84%。在低浓度的初始条件下,氯霉素的降解率较低,可能由于浓度低的氯霉素供给的碳源不足以支撑降解菌的生长。随着底物浓度从10 mg/L增加至200 mg/L,降解率从44.98%迅速增大至69.09%,直至在300 mg/L达到最大。说明该菌适于在氯霉素浓度较高的环境中生长且利用底物效果较好。当浓度大于300 mg/L时,氯霉素对菌株产生的生物毒害作用抑制了该菌的生长,菌株的降解能力受到很大影响。
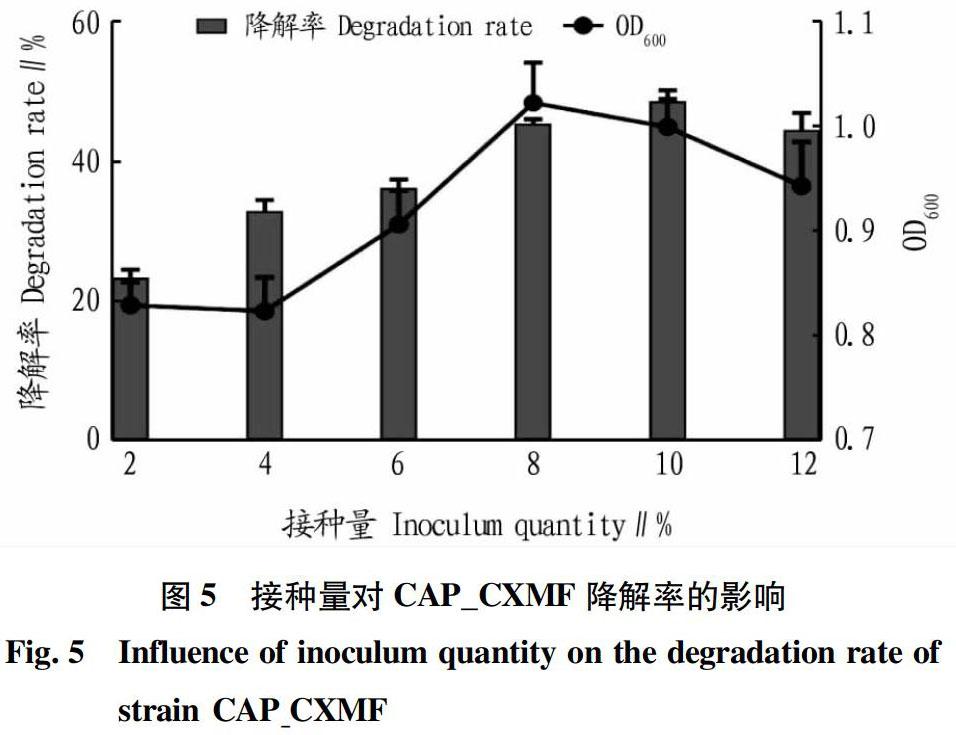
2.3.2 接种量对降解菌降解率的影响。
从图5可以看出,接种量为10%时降解菌CAP_CXMF能高效率地去除氯霉素。较大的接种量有利于该菌对氯霉素的降解,因为该菌需要的底物浓度较大,接种量的增加能在一定程度上促进菌株对氯霉素的降解作用。但是过高的接种量容易导致培养基中菌种受营养限制而抑制生长,降低生物活性。
2.3.3 温度对降解菌降解率的影响。
从图6可以看出,降解菌CAP_CXMF受温度影响较大。在20 ℃的环境下菌株长势好、活性高,降解率达68.52%;30 ℃时该菌仍有较好的降解率。该菌株在适宜温度下迅速生长繁殖,大量消耗碳氮源,降解效率高。之后菌株降解率随着温度的上升而大幅下降,温度为40 ℃时降解率低至27.10%,说明温度大于30 ℃,菌株酶活性受抑制生长缓慢,对氯霉素的降解能力低。
2.3.4 转速对降解菌降解率的影响。
从图7可以看出,转速对降解菌CAP_CXMF的降解率影响较小。转速为160 r/min时降解率最高,达70.95%;转速为200 r/min时,该菌的降解率也达到了70.74%;而转速为80、120 r/min时,该菌的降解率仍有60%以上,表明转速对菌株的生长和降解率影响不大,说明在该菌的生长发育过程中,溶解氧的需求量较少。160、200 r/min时菌株的降解率并未有较大的波动,说明该转速范围已接近菌株的最高降解性能。考虑到摇床设备的高能耗,可以选择160 r/min作为优化的转速。
2.3.5 pH对降解菌降解率的影响。
从图8可以看出,pH对降解菌CAP_CXMF影响较大,随pH的增加降解率呈先增加后降低的趋势,pH为7时达到最高降解率。pH小于6,降解率由pH为3时的18.44%增加至pH为6时的70.64%,pH较低时菌株酶结构遭破坏,活性受到抑制,难以适应环境条件,降解性能低下。pH大于8时,菌株生长量和降解率同样因过高的pH而受到限制,菌株需要较长的时间来适应外部环境的改变。pH为7时,达到该菌的最佳降解条件,菌株活性最高,生长繁殖最迅速,降解能力最强,能降解72.35%的氯霉素,降解效果较好。所以初始pH为7时,菌株的生长量最大且氯霉素降解效率最高。
2.3.6 外加碳氮源对降解菌降解率的影响。
从图9可以看出,碳氮源的添加能一定程度上提高降解菌CAP_CXMF对氯霉素的降解率。试验表明,该菌株利用酵母膏、葡萄糖和蛋白胨能力较好,在添加酵母膏、蛋白胨和葡萄糖的环境下降解菌对氯霉素的降解率较高,分别达73.15%、68.84%和72.80%;而添加蔗糖、麦芽糖作为碳源时降解率分别仅有54.87%和55.79%,说明该菌利用蔗糖和麦芽糖效果一般。因此添加一定的葡萄糖、酵母膏、蛋白胨有助于该菌更好地利用、分解氯霉素。
2.3.7 最优条件降解率。
接种菌株以10%的接种量,初始底物浓度300 mg/L,调节pH为7,在温度20 ℃、转速160 r/min条件下,测得降解率为72.55%。
3 讨论
氯霉素的处理方法主要有物理吸附萃取、化学法和生物法[16]。近年来,氯霉素处理工艺主要集中在化学氧化还原上。吴宇炜[17]利用活性炭对纳米零价铁进行改性,制备出活性炭负载纳米零价铁,用于处理去除氯霉素且具有很高的去除能力,经分析结果得出活性炭负载纳米零价铁主要通过[H]的还原作用降解氯霉素。杨志伟[18]利用亚氧化钛阳极电化学氧化处理氯霉素废水,在初始浓度为20 mg/L的废水中进行模拟,以0.05 mol/L的硫酸钠溶液作为电解质溶液,采用20 mA/cm2的电流密度,当pH为5时能完全去除氯霉素;因其较低的能耗,可用于深度处理氯霉素废水。

