低咖啡碱可可茶活性成分和药理作用研究进展
闫振 王登良

摘要 可可茶是一种有别于传统茶类植物的天然低咖啡碱茶树品种,是一类稀有的茶树资源。可可茶以可可碱、没食子儿茶素没食子酸酯和原花青素为主要活性成分,具有改善睡眠质量、抑制新生血管抗肿瘤、抑制脂肪细胞抗肥胖、调控细胞凋亡抑制肝细胞癌、抗炎、抗氧化和抗前列腺癌等药理作用。对可可茶的功能性成分和药理作用进行了综述,为其进一步资源开发与挖掘利用提供有益的参考。
关键词 可可茶;可可碱;儿茶素;原花青素;药理作用
中图分类号 TS272 文献标识码 A
文章编号 0517-6611(2021)09-0001-04
doi:10.3969/j.issn.0517-6611.2021.09.001
Abstract Cocoa tea as a kind of rare tea resource has low contents of caffeine,which is different from traditional tea plants.Theobromine,gallocatechin gallate and proanthocyanidin are the main active components of cocoa tea,which makes cocoa tea has the health care effects of improved sleep quailty,antiangiogenesis and anti-tumor,inhibition of adipocyte differentiation and anti-obesity,regulation of apoptosis and anti-hepatocellular carcinoma,anti-inflammatory,anti-oxidation and anti-prostate cancer.This article mainly focused on the functional ingerdients,pharmacological effects of cocoa tea in order to provide useful reference for the further development and utilization of cocoa tea.
Key words Cocoa tea;Theobromine;Catechin;Proanthocyanidin;Pharmacological effects
可可茶 (Camellia ptilophylla Chang),属于山茶属茶亚属茶组茶系植物,发源于广东龙门、从化和增城三县市交汇处的南昆山一带,因其富含可可碱而被命名为“可可茶”,同时也是一种天然低咖啡碱茶树种质资源。在形态学上,可可茶为大叶种,野生可可茶树属小乔木型,栽培种为灌木型,其嫩梢芽叶毫毛浓密,分白芽、红芽和特红芽3种,可可碱含量随着芽叶颜色的加深而依次减少[1]。近些年研究发现,可可茶以其高可可碱、高没食子儿茶素没食子酸酯(GCG)而低咖啡碱的优势被证实具有改善睡眠、抗肥胖、抗癌和降血脂等活性作用,被认为是一种潜在的功能性茶饮料。笔者对可可茶和传统茶如龙井的茶叶水溶出物组分含量进行对比,并主要从可可茶的保健功效如改善睡眠质量、抗氧化、抑制肿瘤、抗炎、减肥、调控细胞凋亡抑制肝细胞癌和抗前列腺癌等方面进行阐述和归纳,以期为可可茶的进一步研究与开发提供参考。
1 可可茶活性成分组成特征
1.1 可可茶生物碱单体组成特征
茶叶中主要化学成分由茶多酚、氨基酸、黄酮类、茶多糖和生物碱等组成,水溶出物是衡量茶叶质量的一个重要标准。Li等[2]对可可茶和传统茶龙井茶的主要水浸提物成分测定结果表明,与龙井茶相比,可可茶的总水浸出物、总茶多酚、总氨基酸、总生物碱含量更高,总黄酮类和茶氨酸相对较低;龙井茶的生物碱以咖啡碱为主而可可茶的生物碱则以可可碱为主;龙井茶的优势儿茶素为EGCG而可可茶的优势儿茶素则为GCG(表1)。
茶叶生物碱是茶叶内含成分的重要组成部分,包括咖啡碱、可可碱、茶碱、黄嘌呤等嘌呤甲基衍生物,在苦茶和Camellia puanensis Kurihara[3]茶种中还存在苦茶碱。一般情况下,茶树中的代表性生物碱为咖啡碱,含量最高。Li等[2]通过高效液相色谱分析了可可茶和龙井茶的生物碱组分,结果表明,龙井茶的生物碱由咖啡碱和可可碱组成,以咖啡碱为主含量达4.64%左右而可可碱仅占0.12%左右;与龙井茶不同,可可茶的优势嘌呤生物碱为可可碱,含量高达6.78%,且在生物碱总含量上高于龙井茶(表1)。
1.2 可可茶儿茶素单体组成特征
儿茶素在化学结构上属于黄烷醇类化合物,是茶叶多酚类的主体成分,也是茶叶保健功效首要活性物质。组分测定结果表明可可茶与龙井茶均含有没食子酸(GA)、没食子儿茶素没食子酸(GCG)、儿茶素(C)、没食子儿茶素(GC)、儿茶素没食子酸酯(CG)及其表型结构化合物表没食子儿茶素没食子酸酯(EGCG)、表儿茶素(EC)、表沒食子儿茶素(EGC)、表儿茶素没食子酸酯(ECG)。传统茶龙井茶的优势儿茶素为EGCG(7.87%),其主要儿茶素组成为EGCG > EGC > GC > ECG,以表型儿茶素为主;可可茶的优势儿茶素则为GCG(8.11%),主要儿茶素组成为GCG > C > GC > EGCG,以非表型儿茶素为主(表1)。
2 可可茶的药理作用
2.1 改善睡眠作用
茶叶作为世界三大饮料之一,具备多种生物活性,对人体具有积极的养生功效。茶(Camellia sinensis)叶中一般含有2%~4%的咖啡碱,饮茶有助于兴奋神经、缓解疲劳,但过多摄入则会引起血压升高、心悸、失眠等负面影响,影响睡眠质量。
睡眠质量好的体现是睡眠时间长、睡眠频度少和活动次数多。杨晓绒[4]通过戊巴比妥钠诱导小鼠睡眠试验发现传统绿茶拮抗戊巴比妥钠诱导睡眠的药效,刺激小鼠大脑皮质兴奋从而缩短小鼠睡眠时间;与传统绿茶的作用相反,可可绿茶可协同戊巴比妥钠增强大脑皮质抑制从而保证小鼠睡眠时间。以果蝇为研究对象发现GCG可延长果蝇夜晚睡眠时间增加白天活动,减少夜晚活动次数和睡眠次数,对睡眠质量有增益效果;EGCG可稍延长果蝇夜晚睡眠时间,但高剂量则会减少白天活动次数;可可碱对果蝇睡眠时间和活动次数基本没有影响;而咖啡碱和传统绿茶则缩短果蝇白天睡眠时间、增加夜晚睡眠次数和活动次数,降低果蝇睡眠质量;可可绿茶可增加果蝇活动次数、减少睡眠次数增加白昼活动,对睡眠时间无明显影响。以上结果表明,可可绿茶不会对睡眠质量产生负面影响还可增加白天活动,可以开发为低咖啡碱的天然保健饮品。
2.2 抗氧化作用
抗氧化被认为是茶叶保健抗癌最主要的方式,而茶多酚类物质是其首要功能成分。茶叶抗氧化性的强弱与多种因素有关包括茶多酚含量、儿茶素组成、羟基的位置和数目以及是否存在没食子酰基等[5]。
彭力[6]通过清除自由基能力和抑制脂质过氧化法对可可绿茶和碧螺春、龙井茶浸提物的抗氧化活性测定结果表明可可茶较后者有更强的抗氧化活性,其抗氧化强弱与其茶多酚含量的大小规律一致。Li等[2]用清除自由基能力法测定可可茶、苦茶和龙井茶的抗氧化活性发现可可茶清除自由基的能力最强,其次为苦茶,龙井茶清除能力相对最差,这与其茶多酚含量的大小规律也一致。细胞抗氧化活性检测法是一种较好的生理相关性分析方法,常用于评价茶叶提取物以及EGCG和GCG的细胞抗氧化活性。Gao等[7]研究发现可可绿茶比云南大叶种绿茶的细胞抗氧化活性更高,GCG的细胞抗氧化活性略高于EGCG。可可绿茶的没食子酸型儿茶素含量(24.00%)明显高于云南大叶种绿茶(14.23%),而非没食子酸型儿茶素含量差异不显著。因此,可可茶具有突出的细胞抗氧化活性,不仅与茶多酚总含量高有关,也与其独特的儿茶素组成模式(以GCG、C和GC为代表)有很大的关系,是一种有别于传统茶的新资源。
2.3 抑制新生血管预防肿瘤
血管新生在胚胎和胎儿的正常发育以及包括伤口愈合在内的正常生理过程中都是必不可少的。血管新生失调常与肿瘤细胞生长、视网膜病变和血管瘤有关[8]。新生血管的生长和发育是肿瘤细胞发生的关键阶段,所以血管预防是癌症治疗中一种很好的方法[9-10]。
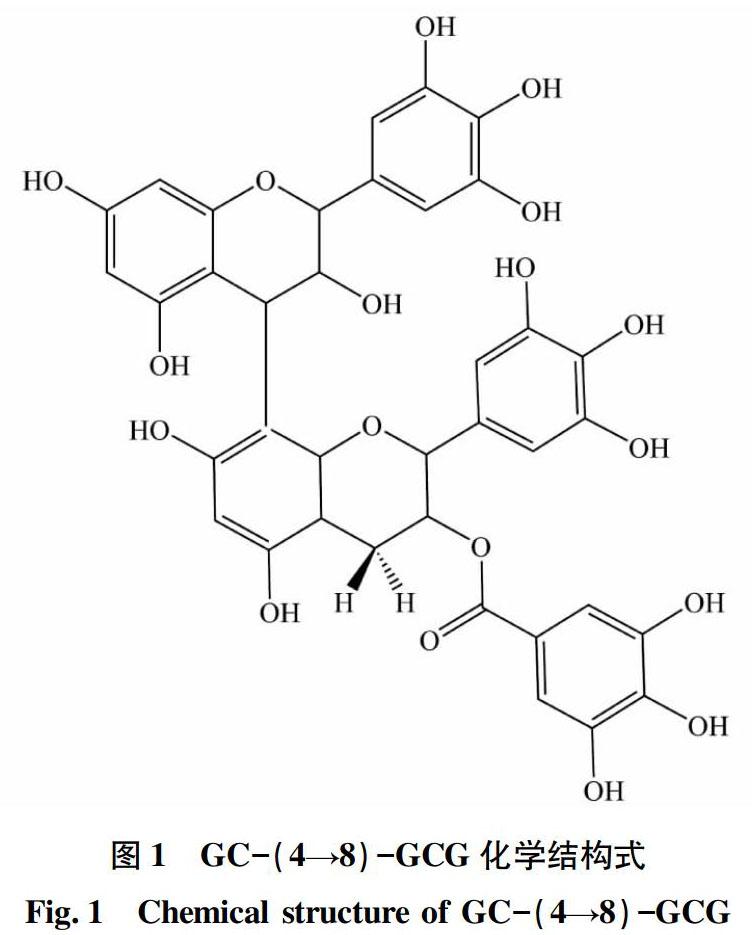
研究表明原花青素具有较强的自由基清除和抗氧化活性以及抗癌、抗炎、抗过敏和心脏保护等功效[11]。Li等[12]首次在可可绿茶中发现一种由GC和GCG组成的新原花青素化合物GC-(4→8)-GCG,占茶叶干重的1.0%左右。以人微血管内皮细胞HMEC-1为研究对象发现GC-(4→8)-GCG对HMEC-1细胞的增殖、迁移和分化3个重要血管生成过程均有显著的抑制作用,GC-(4→8)-GCG呈剂量依赖性减弱HMEC-1细胞的胞外信号调节激酶ERK、Akt和p38蛋白磷酸化从而共同抑制血管生成,且GC-(4→8)-GCG浓度低于400 μg/mL并持续24 h不会对HMEC-1细胞活力产生毒害作用,说明GC-(4→8)-GCG的抗血管生成作用不是因其对细胞的毒害作用所致。这些结果表明,原花青素GC-(4→8)-GCG是一种很有潜力的天然抗血管生成药物。GC-(4→8)-GCG存在于可可茶叶中,人们通过饮茶便可容易地获得,因此可可茶作为一种新型功能性食品具有极大的挖掘价值。GC-(4→8)-GCG化学结构式见图1。
2.4 抗炎作用
慢性炎症与多种疾病如糖尿病、神经退化和心血管疾病的发生均有一定的关系。研究表明绿茶具有抑制RAW264.7活化噬菌体产生NO的抗炎活性,而茶多酚是绿茶有效抑制NO生成的主要活性成分[13-14]。
Lin等[15]研究发现,可可绿茶比云南大叶种绿茶含有更多的茶多酚(特别是没食子酸和儿茶素的C-2差向异构体),且无论是浸提液、沉淀还是上清液,可可绿茶都比云南大叶种绿茶对炎症介质NO的生成有更强的抑制活性。活化噬菌体释放NO受诱导型NO合成酶(iNOS)的调控[16],Gao等[7]研究发现可可绿茶、云南大叶种绿茶、GCG和EGCG均可以剂量依赖性的方式下调iNOS的表达水平,且可可绿茶对iNOS的抑制效果比云南大叶种绿茶更突出,GCG的抑制效果优于EGCG。促炎细胞因子TNF-α和IL-6的分泌主要发生在炎症早期,可可绿茶、云南大叶种绿茶、GCG和EGCG均可以剂量依赖性的方式抑制其分泌,且可可绿茶的抑制效果表现更佳。以上研究结果表明,可可茶能够通过抑制iNOS表达、清除NO自由基和抑制促炎细胞因子分泌等多条途径抑制活化噬菌体炎症介质NO的生成和积累,从而起到抗炎的功效。
2.5 调节肥胖
肥胖是最常见的代谢性疾病之一。肥胖的特征在细胞水平上表现为脂肪细胞数量和大小的增加,因此,医学上常采用抑制脂肪细胞分化来控制肥胖[17-19]。
Yang等[20]分别用高脂食物和添加可可茶的高脂食物喂养小鼠,发现可可茶以剂量依赖性的方式显著降低小鼠的体重、肝重血脂和干细胞之间的圆脂滴。Li等[21]研究发现可可茶对成熟脂肪细胞中甘油三酯的积累有明显的抑制作用,这种抑制作用是通过调控C/EBPα和PPARγ等关键脂肪转录因子的表达来下调脂肪细胞特异性基因的表达,从而实现抑制脂肪细胞的分化增殖。同时发现,前脂肪细胞3T3-L1脂肪分化过程中的丝裂原活化蛋白激酶(MAPKs)的磷酸化过程也受到了可可茶浸提液作用的抑制。研究表明可可碱和GCG能在一定程度上降低血浆中胆固醇和甘油三酯的含量[22]。Li等[23]研究发现GCG能够通过抑制圆脂滴在前脂肪细胞转向成熟脂肪细胞过程中的产生进而抑制前脂肪细胞的增殖和细胞活力,从而阻止脂质在前脂肪細胞中积累。表明GCG通过抑制C/EBPα和PPARγ等关键脂肪转录因子的表达来下调脂肪细胞特异性基因的表达从而抑制脂肪细胞的分化。GC-(4→8)-GCG有较好的抗氧化和抗新生血管活性,血管生成对脂肪细胞组织的扩张和代谢也有一定的影响。Peng等[24]研究发现与GCG抗脂减肥的作用机制相似,GC-(4→8)-GCG也可通过抑制MAPK信号通路的磷酸化下调脂肪细胞分化过程中转录因子和脂肪细胞特异性基因的表达,从而降低高脂食物诱导的小鼠脂质积累、改善肝脂肪变性、高脂血症和改善肥胖相关的胰岛素抗性发挥其抗脂减肥的功效。
绿茶中的儿茶素特别是EGCG具有减肥效果的临床研究已被证实[25-26],可可茶的代表性儿茶素成分为GCG和C,EGCG含量较少,因此,可可茶良好的抗脂减肥效果暗示了GCG及其衍生物GC-(4→8)-GCG应是可可茶降脂减肥效果的主要成分。
2.6 调控细胞凋亡抑制肝癌细胞
肝细胞癌是世界上第六大常见的人类癌症,也是中国第三大最常见的恶性肿瘤。绿茶及其主要成分茶多酚被证实具有安全有效的抗癌作用[27-29]。
Yang等[30]以人肝癌HepG2细胞和裸鼠异种移植模型为研究对象,评价可可绿茶浸提液的体内和体外抗肝癌活性。可可绿茶浸提液能够以剂量依赖性的方式通过激活细胞凋亡诱导因子、抑癌基因p53和细胞周期抑制蛋白的表达导致肝癌细胞的细胞周期G0/G1期受阻滞,从而抑制肿瘤的生长和转移。B淋巴细胞瘤-2基因(Bcl-2)是细胞凋亡抑制基因,Bax不仅具有拮抗Bcl-2的抑制凋亡作用,而且具有促进细胞凋亡的功能。Bax/Bcl-2比值可在一定程度上说明细胞对抗癌药物凋亡刺激的敏感性。可可绿茶浸提液处理HepG2细胞过程中Bax/Bcl-2比值增加也证明可可绿茶浸提液具有调控细胞凋亡的活性。体内研究通过体外HepG2异种移植小鼠肿瘤组织也证实了可可绿茶浸提液可显著诱导肝癌细胞凋亡。研究发现用可可绿茶浸提液喂养的试验小鼠平均肿瘤重量和体积均以剂量依赖性的方式显著降低且不会对试验小鼠正常肝组织及正常体重造成不良影响。这些结果表明可可绿茶浸提液可作为一种潜在的天然肝癌治疗药物。
2.7 抗前列腺癌作用
前列腺癌细胞分为激素依赖性和激素非依赖性2种,前列腺癌病变初期主要表现为激素依赖性癌细胞增加,通过激素药物可大幅抑制癌细胞生长,但激素非依赖性癌细胞并不受雄性激素的影响[31]。
Peng等[32]以人雄激素非依赖性前列腺癌细胞系PC-3为研究对象探讨可可茶抗前列腺癌的作用机制。在细胞形态学上,可可茶水提取物处理后的PC-3细胞由畸形生长开始变圆、体积减小、细胞核颜色加深、细胞离壁悬浮生长;细胞增殖和流式细胞测定结果表明可可茶水提取物以浓度和时间依赖性的方式抑制PC-3细胞的生长,阻滞细胞周期G2/M期从而诱导前列腺癌细胞死亡。进一步研究结果表明,可可茶水提取物通过调控细胞周期抑制因子下调其下游细胞周期调控蛋白的表达从而来阻滞PC-3细胞周期诱导细胞死亡,同时也发现Bax/Bcl-2比值在PC-3细胞中随着处理浓度的增加而增加。茶叶抗前列腺癌的研究已有报道,其主要活性成分为茶多酚中的EGCG,EGCG通过阻滞PC-3细胞周期G0/G1期来抑制PC-3细胞增殖达到抗前列腺的效果[33-35]。与EGCG的作用机制不同,可可茶作用于阻滞PC-3细胞周期G2/M期,而可可茶的代表性儿茶素为GCG,表明可可茶抗前列腺癌的机制应主要与GCG有关。
3 展望
可可茶作为一种天然的高可可碱低咖啡碱茶树资源,具有与传统栽培种茶所没有的优良特性。可可茶因低含量咖啡碱的特点而不会对睡眠质量产生负面影响,越来越受到人们的青睐,而市场上流通的低咖啡碱茶产品多是经过化学物理等方法处理的脱咖啡碱产物[36],可可茶以其天然低咖啡碱的特点可以大幅度降低加工成本,具有低成本且天然的优势。同时可可茶的生物活性在近些年也得到了充分的关注与研究,其抗氧化、抑制肿瘤、抗炎、减肥、抑制肝细胞癌和抗前列腺癌等作用机制也日趋明确。研究表明,与EGCG相比,GCG抑制胆固醇吸收效率更高[37],GCG对胆固醇生物合成的抑制能力也高于EGCG[38],且质膜对GCG的吸收率要高于EGCG[39]。此外,可可碱通过调控AMPKs信号转导通路在脂肪生成早期抑制前脂肪细胞3T3-L1的脂肪分化也得到了报道[40]。可可茶在生物碱和儿茶素组成上的特点使其与传统栽培茶在药理效果上有所差别而具有特殊的保健功效,可可茶保健功效的研究结果证明了可可茶是一种潜在的功能性茶饮料,具有极大的开发与利用价值。
参考文献
[1] 叶创兴,郑新强,袁长春,等.无咖啡因茶树新资源可可茶研究综述[J].广东农业科学,2001,28(2):12-15.
[2] LI K K,SHI X G,YANG X R,et al.Antioxidative activities and the chemical constituents of two Chinese teas,Camellia kucha and C.ptilophylla[J].International journal of food science & tchnology,2012,47(5):1063-1071.
[3] LI M M,SUN Y,PAN S A,et al.Engineering a novel biosynthetic pathway in Escherichia coli for the production of caffeine[J].RSC Advances,2017,7(89):56382-56389.
[4] 楊晓绒.可可茶生化成分和药理作用研究[D].广州:中山大学,2011.
[5] NAYAK B,LIU R H,BERRIOS J D J,et al.Bioactivity of antioxidants in extruded products prepared from purple potato and dry pea flours[J].Journal of agricultural and food chemistry,2011,59(15):8233-8243.
[6] 彭力.可可茶驯化选育过程中特征生化成分和抗癌活性的研究[D].广州:中山大学,2010.
[7] GAO X,LIN X R,LI X F,et al.Cellular antioxidant,methylglyoxal trapping,and anti-inflammatory activities of cocoa tea (Camellia ptilophylla Chang)[J].Food function,2017,8(8):2836-2846.
[8] 曲藝南,房绍红,李呼伦,等.血管新生的形成及其与疾病的相关性研究进展[J].现代生物医学进展,2018,18(23):4593-4596.
[9] GORDON M S,MENDELSON D S,KATO G.Tumor angiogenesis and novel antiangiogenic strategies[J].International journal of cancer,2010,126(8):1777-1787.
[10] EIKESDAL H P,KALLURI R.Drug resistance associated with antiangiogenesis therapy[J].Seminars cancer biology,2009,19(5):310-317.
[11] 张慧文,张玉,马超美.原花青素的研究进展[J].食品科学,2015,36(5):296-304.
[12] LI K K,LIU C L,TAM J C W,et al.In vitro and in vivo mechanistic study of a novel proanthocyanidin,GC-(4→8)-GCG from cocoa tea (Camellia ptilophylla) in antiangiogenesis[J].Journal of nutritional biochemistry,2014,25(3):319-328.
[13] LIN C C,LU M J,CHEN S J,et al.Heavy fermentation impacts NO-suppressing activity of tea in LPS-activated RAW 264.7 macrophages[J].Food chemistry,2006,98(3):483-489.
[14] OZ H S.Chronic inflammatory diseases and green tea polyphenols[J].Nutrients,2017,9(6):1-14.
[15] LIN X R,CHEN Z Z,ZHANG Y Y,et al.Interactions among chemical components of Cocoa tea (Camellia ptilophylla Chang),a naturally low caffeine-containing tea species[J].Food function,2014,5(6):1175-1185.
[16] TSAI P J,TSAI T H,YU C H,et al.Comparison of NO-scavenging and NO-suppressing activities of different herbal teas with those of green tea[J].Food chemistry,2007,103(1):181-187.
[17] SU C W,CHEN C Y,Li Y,et al.Helminth infection protects against high fat diet-induced obesity via induction of alternatively activated macrophages[J].Scientific reports,2018,8(1):1-14.
[18] SMITH A,YU X,YIN L.Diazinon exposure activated transcriptional factors CCAAT-enhancer-binding proteins α (C/EBPα) and peroxisome proliferator-activated receptor γ (PPARγ) and induced adipogenesis in 3T3-L1 preadipocytes[J].Pesticide biochemistry and physiology,2018,150:48-58.
[19] HE Y F,LIU F Y,ZHANG W X.Tangeritin inhibits adipogenesis by down-regulating C/EBPα,C/EBPβ,and PPARγ expression in 3T3-L1 fat cells[J].Genetics molecular research,2015,14(4):13642-13648.
[20] YANG X R,WAT E,WANG Y P,et al.Effect of dietary cocoa tea (Camellia ptilophylla) supplementation on high-fat diet-induced obesity,hepatic steatosis,and hyperlipidemia in mice[J].Evidence-based complementary and alternative medicine,2013,2013:1-12.
[21] LI K K,LIU C L,SHIU H T,et al.Cocoa tea (Camellia ptilophylla) water extract inhibits adipocyte differentiation in mouse 3T3-L1 preadipocytes[J].Scitific report,2016,6:1-11.
[22] LEE S M,KIM C W,KIM J K,et al.GCG-rich tea catechins are effective in lowering cholesterol and triglyceride concentrations in hyperlipidemic rats[J].Lipids,2008,43(5):419-429.
[23] LI K K,PENG J M,ZHU W,et al.Gallocatechin gallate (GCG) inhibits 3T3-L1 differentiation and lipopolysaccharide induced inflammation through MAPK and NF-KB signaling[J].Journal of function food,2017,30:159-167.
[24] PENG J M,JIA Y,HU T Y,et al.GC-(4→8)-GCG,A proanthocyanidin dimer from Camellia ptilophylla,modulates obesity and adipose tissue inflammation in high-fat diet induced obese mice[J].Molecular nutrition & food research,2019,63(11):1-12.
[25] LEGEAY S,RODIER M,FILLON L,et al.Epigallocatechin gallate:A review of its beneficial properties to prevent metabolic syndrome[J].Nutrients,2015,7(7):5443-5468.
[26] SANTAMARINA A B,CARVALHO-SILVA M,GOMES L M,et al.Decaffeinated green tea extract rich in epigallocatechin-3-gallate prevents fatty liver disease by increased activities of mitochondrial respiratory chain complexes in diet-induced obesity mice[J].Journal of nutritional biochemistry,2015,26(11):1348-1356.
[27] QU Z H,LIU A L,LI P H,et al.Advances in physiological functions and mechanisms of (-)-epicatechin[J].Critical reviews in food science and nutrition,2021,61(2):211-233.
[28] SHIMIZU M,SHIRAKAMI Y,SAKAI H,et al.Chemopreventive potential of green tea catechins in hepatocellular carcinoma[J].International journal of molecular sciences,2015,16(3):6124-6139.
[29] LIU H X,XU M Q,LI S P,et al.Jujube leaf green tea extracts inhibits hepatocellular carcinoma cells by activating AMPK[J].Oncotarget,2017,8(66):110566-110575.
[30] YANG X R,WANG Y Y,LA K K,et al.Inhibitory effects of cocoa tea (Camellia ptilophylla) in human hepatocellular carcinoma HepG2 in vitro and in vivo through apoptosis[J].Journal of nutritional biochemistry,2012,23(9):1051-1057.
[31] THOMAS-JARDIN S E,DAHL H,NAWAS A F,et al.NF-κB signaling promotes castration-resistant prostate cancer initiation and progression[J].Pharmacolgy & therapeutics,2020,211:1-10.
[32] PENG L,KHAN N,AFAQ F,et al.In vitro and in vivo effects of water extract of white cocoa tea (Camellia ptilophylla)against human prostate cancer[J].Pharmaceutical research,2010,27(6):1128-1137.
[33] YEO C,HAN D S,LEE H J,et al.Epigallocatechin-3-gallate suppresses vasculogenic mimicry through inhibiting the Twist/VE-cadherin/AKT pathway in human prostate cancer PC-3 cells[J].International journal molecular science,2020,21(2):1-11.
[34] DEB G,SHANKAR E,THAKUR V S,et al.Green tea-induced epigenetic reactivation of tissue inhibitor of matrix metalloproteinase-3 suppresses prostate cancer progression through histone-modifying enzymes[J].Molecular carcinogenesis,2019,58(7):1194-1207.
[35] KARPOV E I.Prostate cancer prevention.The current trends[J].Urologiia,2018,6:164-167.
[36] RANATUNGE I,ADIKARY S,DASANAYAKE P,et al.Development of a rapid and simple method to remove polyphenols from plant extracts[J].International journal of analytical chemistry,2017,2017:1-7.
[37] IKEDA I,KOBAYASHI M,HAMADA T,et al.Heat-epimerized tea catechins rich in gallocatechin gallate and catechin gallate are more effective to inhibit cholesterol absorption than tea catechins rich in epigallocatechin gallate and epicatechin gallate[J].Journal of agriculture and food chemistry,2003,51:7303-7307.
[38] LU C H,HWANG L S.Polyphenol contents of Pu-Erh teas and their abilities to inhibit cholesterol biosynthesis in Hep G2 cell line[J].Food chemistry,2008,111(1):67-71.
[39] HODGSON A B,RANDELL R K,MAHABIR-JAGESSAR-T K,et al.Acute effects of green tea extract intake on exogenous and endogenous metabolites in human plasma[J].Journal of agricultural and food chemistry,2014,62(5):1198-1208.
[40] JANG Y J,KOO H J,SOHN E H,et al.Theobromine inhibits differentiation of 3T3-L1 cells during the early stage of adipogenesis via AMPK and MAPK signaling pathways[J].Food function,2015,6(7):2365-2374.

