跗骨窦切口辅助Ilizarov技术与切开复位内固定治疗SandersⅢ、Ⅳ型跟骨骨折的疗效比较*
余兰伟 张祝辉 邱华骥 王清玉 陈妍 李良华 韩大为
(福建中医药大学附属人民医院 福州350004)
跟骨骨折是最常见的跗骨骨折,其中约有3/4是关节内骨折[1],坠落伤和交通伤是其主要原因[2]。跟骨外形不规则,为松质骨,支撑弱,且周围组织薄,血供差。跟骨骨折的传统治疗方法是切开复位内固定术,常用入路是外侧大切口[3],其可直接复位骨折,且能看到后关节面的骨折碎片[4]。但该切口易损伤皮瓣血供,产生并发症[5],有文献通过回顾分析发现该术式伤口边缘坏死率为2%~11%,感染率为1.3%~7%[6],这些并发症给患者造成了心理和经济的双重负担。近年来,关节镜、外固定技术、小切口等微创元素越来越多地出现在跟骨骨折的治疗中。Park CH[7]通过距下关节镜监视下复位内固定获得了满意复位固定和较低的并发症发生率。Lin J等[8]使用跗骨窦切口处理Sanders Ⅳ型跟骨骨折,术后伤口愈合并发症和腓肠神经损伤的发生率均较传统的外侧“L”型切口更低。2019年,Muir RL等[9]回顾分析了11篇高证据等级文献,认为使用外固定架治疗跟骨骨折,能得到与切开复位内固定术一样的疗效,但大幅减少了严重并发症的发生,且可以早期负重。上述方法虽然均获得了满意的疗效,降低了并发症发生率,但跟骨骨折最理想的治疗方法依然没有定论[10]。我们前期在闭合复位下应用Ilizarov技术治疗跟骨骨折,发现对于骨折块少、移位不明显的骨折尚可获得满意复位,而对于移位明显的粉碎性骨折则会出现关节面不平整的情况[11]。鉴于此,我们采用跗骨窦切口辅助Ilizarov技术治疗Sanders Ⅲ、Ⅳ型跟骨骨折患者,回顾性分析其临床资料,并与同期采用外侧“L”形入路切开复位内固定的患者资料进行对比,旨在探讨跗骨窦切口辅助Ilizarov技术治疗Sanders Ⅲ、Ⅳ型跟骨骨折的优势和适应证、手术要点和注意事项。现报道如下:
1 资料与方法
1.1 一般资料 回顾性分析2013年6月~2019年12月治疗的40例(45足)Sanders Ⅲ、Ⅳ型跟骨骨折患者资料,其中男性34例,女性6例;年龄19~70岁,平均(31.59±11.56)岁;左足26例,右足19例;30例为坠落伤,7例为交通伤,3例为重物砸伤。16例17足采用跗骨窦切口辅助Ilizarov技术治疗纳入微创外架组,24例28足采用经外侧“L”形切口切开复位钢板内固定术治疗纳入切开钢板组。两组患者的年龄、性别、侧别、骨折分型等资料比较,差异均无统计学意义,P>0.05。见表1。本研究已通过福建中医药大学附属人民医院医学伦理委员会审核批准。
1.2 入组标准 纳入标准:年龄18~70岁;SandersⅢ、Ⅳ型跟骨骨折;有明确的外伤史;闭合性跟骨骨折;受伤时间<2周。排除标准:跟骨骨质破坏;患足皮肤完整性缺失或有皮肤病;既往足踝疾患遗留的疼痛或畸形;不能耐受麻醉或手术;依从性差;多发伤。
1.3 手术方法
1.3.1 两组术前健、患侧影像学测量结果比较 查跟骨X线片、CT,从多个维度了解骨折情况。在跟骨侧位和轴位片上测量相关数据。两组术前健、患侧影像学测量结果比较,差异均无统计学意义,P>0.05。见表2、表3。
1.3.2 术前准备 皮肤褶皱试验阳性时可进行手术。术前等待期一般为3~10 d,微创外架组在跗骨窦切口软组织条件允许时即可手术,切开钢板组须待整个后足软组织条件允许时方可手术。
表1 两组一般资料比较(±s)

表1 两组一般资料比较(±s)
组别 n 性别(例)男 女 年龄(岁)微创外架组切开钢板组t/χ2 P 16(17足)24(28足)13 3 21 3 0.005 >0.05 32.14±11.15 31.23±12.02 0.198>0.05 12 5 14 14 0.002 >0.05 13 4 23 5 0.169 >0.05侧别(例)左 右Sanders分型(例)Ⅲ Ⅳ
表2 两组术前健侧影像学测量结果比较(±s)
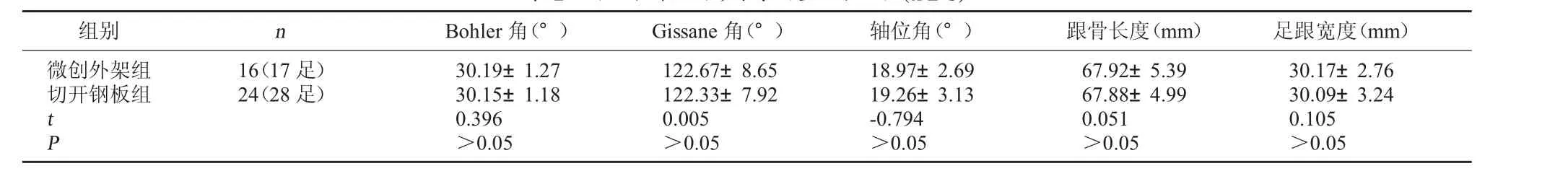
表2 两组术前健侧影像学测量结果比较(±s)
组别 n Bohler角(°) Gissane角(°) 轴位角(°) 跟骨长度(mm) 足跟宽度(mm)微创外架组切开钢板组 t P 16(17足)24(28足)30.19±1.27 30.15±1.18 0.396 >0.05 122.67±8.65 122.33±7.92 0.005 >0.05 18.97±2.69 19.26±3.13 -0.794 >0.05 67.92±5.39 67.88±4.99 0.051 >0.05 30.17±2.76 30.09±3.24 0.105 >0.05
表3 两组术前患侧影像学测量结果比较(±s)

表3 两组术前患侧影像学测量结果比较(±s)
组别 n Bohler角(°) Gissane角(°) 轴位角(°) 跟骨长度(mm) 足跟宽度(mm)微创外架组切开钢板组 t P 16(17足)24(28足)5.32±2.94 6.16±2.77 -0.597 >0.05 159.83±7.76 159.64±8.32 -0.022 >0.05 34.76±5.94 33.97±6.16 -0.974 >0.05 45.13±4.39 45.42±4.27 -0.414 >0.05 48.83±2.96 48.72±3.11 -0.247 >0.05
1.3.3 手术过程(1)微创外架组:麻醉后,取跗骨窦切口,显露并牵拉腓骨肌腱,显露并切断跟腓韧带,暴露后跟距关节面;在跟骨结节前方和距骨颈各穿入透针,用撑开器撑开,恢复跟骨长度,纠正跟骨内翻;挤压跟骨,恢复跟骨宽度;清理骨折端,复位关节面,植入同种异体骨(北京鑫康辰医学科技发展有限公司),恢复跟骨高度、关节角及关节面的平整性。C臂机下观察骨折及足弓情况,满意后于后跟距关节面下方穿入半针,固定跟骨高度;于跟骨结节指向后关节面方向穿入半针,克氏针经过骨折块固定在距骨上;于胫骨远端穿针,安装并调整外固定架(北京瑞朗医疗器械有限公司)。(2)切开钢板组:麻醉后,患者取仰卧位。取跟骨外侧“L”型扩大切口;全层切开至骨膜,骨膜下剥离皮瓣;显露跟骨及其后关节面;复位骨折,骨质缺损区植入同种异体骨;用跟骨解剖锁定钢板(天津金兴达实业有限公司)固定骨折。
1.3.4 术后处理(1)微创外架组:术后垫高患足,常规镇痛。术后24 h开始做足趾屈伸锻炼。术后48 h换药。若6周后骨痂形成,可在非住院条件下拆除外固定架,部分负重。术后8~12周,骨折愈合会后,全部负重。(2)切开钢板组:镇痛方案同微创外架组。术后24 h做足趾、踝关节屈伸锻炼。术后48 h换药,若引流液较少,则拔除引流。术后14~21 d拆线。术后6周若骨痂形成,患足部分负重。术后8~12周骨折愈合后,全部负重。术后1年于手术室在麻醉条件下取出内固定物。
1.4 观察指标(1)对比两组愈合时间、等待手术时间、手术时间、止血带时间、出血量,手术前后Bohler角、Gissane角、足跟宽度、跟骨长度、轴位角,每位患者的跟骨影像学测量由骨科一名副主任医师和影像科一名高年资主治医师同时进行。(2)对比两组患者术后的患足功能、生活质量、疼痛情况。用美国足踝外科协会(American Orthopaedic Foot and Ankle Society, AOFAS)踝-后足评分标准评估患足功能。用健康调查简表(The MOS Item Short From Health Survey, SF-36)评估跟骨骨折对患者生活质量的影响。用疼痛视觉模拟评分(Visual Analogue Scale, VAS)评估患者的疼痛缓解情况。(3)统计两组切口、针道等并发症发生情况。
1.5 统计学分析 数据处理采用SPSS22.0统计学软件,Bohler角、Gissane角、足跟宽度、跟骨长度、轴位角、等待手术时间、手术时间、止血带时间、出血量、AOFAS评分、SF-36评分、VAS评分等计量资料以(±s)表示,两组比较使用独立样本t检验;性别、侧别、骨折分型等计数资料以%表示,采用χ2检验。检验水准琢值取双侧0.05。P<0.05为差异有统计学意义。
2 结果
2.1 两组手术相关时间及出血量比较 所有患者获随访。随访时间为10~25个月,平均14.6个月。至末次随访时,本研究所有病例达骨性愈合,微创外架组愈合时间8~17周,平均(11.77±3.13)周;切开钢板组愈合时间7~18周,平均(12.02±2.97)周,两组比较差异无统计学意义(P>0.05)。微创外架组等待手术时间、手术时间、止血带时间、出血量均少于切开钢板组,差异有统计学意义(P<0.05)。见表4。
表4 两组手术相关时间及出血量比较(±s)
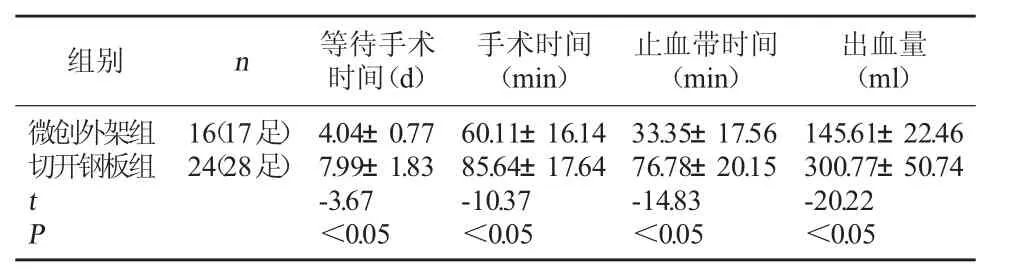
表4 两组手术相关时间及出血量比较(±s)
组别 n 等待手术时间(d)手术时间(min)止血带时间(min)出血量(ml)微创外架组切开钢板组tP 16(17足)24(28足)4.04±0.77 7.99±1.83-3.67<0.05 60.11±16.14 85.64±17.64-10.37<0.05 33.35±17.56 76.78±20.15-14.83<0.05 145.61±22.46 300.77±50.74-20.22<0.05
2.2 两组临床功能评价比较 微创外架组AOFAS评分为63~96分,优6足、良8足、可3足、差0足,优良率82.35%;切开钢板组AOFAS评分为45~91分,优8足、良15足、可3足、差3足,优良率82.14%,两组比较差异无统计学意义(t=1.603,P>0.05)。微创外架组SF-36评分为81~96分;切开钢板组SF-36评分为77~97分,差异有统计学意义(t=2.167,P<0.05)。微创外架组VAS评分为0~3分;切开钢板组VAS评分为0~5分,两组比较差异无统计学意义(t=0.339,P>0.05)。见表5。
表5 两组临床功能评价(分,±s)
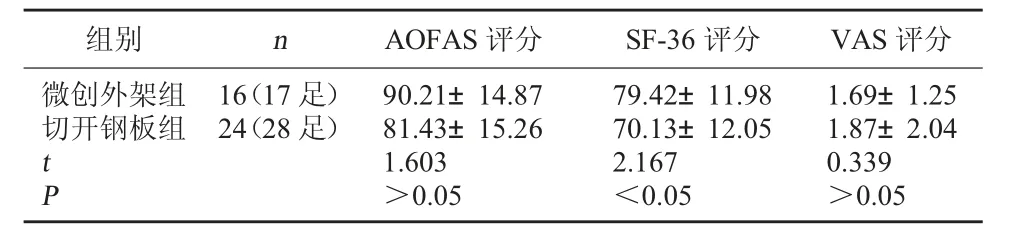
表5 两组临床功能评价(分,±s)
组别 n AOFAS评分 SF-36评分 VAS评分微创外架组切开钢板组tP 16(17足)24(28足) 90.21±14.87 81.43±15.26 1.603 >0.05 79.42±11.98 70.13±12.05 2.167 <0.05 1.69±1.25 1.87±2.04 0.339 >0.05
2.3 两组术后患侧影像学测量结果比较 两组Bohler角、Gissane角比较,差异均有统计学意义(P<0.05),说明在恢复跟骨高度及关节面对位方面,切开钢板组优于微创外架组。两组轴位角、跟骨长度、足跟宽度比较,差异均有统计学意义(P<0.05),说明在恢复跟骨宽度、长度及纠正内翻角度方面,微创外架组均优于切开钢板组。见表6。
表6 两组术后患侧影像学测量结果比较(±s)

表6 两组术后患侧影像学测量结果比较(±s)
组别 n Bohler角(°) Gissane角(°) 轴位角(°) 跟骨长度(mm) 足跟宽度(mm)微创外架组切开钢板组 t P 16(17足)24(28足)28.75±2.53 30.14±2.97 -2.413 <0.05 129.23±4.12 127.63±4.61 2.179 <0.05 18.96±2.11 22.53±5.17 -2.376 <0.05 64.91±5.27 63.06±4.91 1.192 <0.05 32.17±3.31 35.96±3.12 -2.104 <0.05
2.4 两组并发症发生情况比较 微创外架组3例患者在术后20 d左右出现针道红肿渗液,经酒精纱布外敷后好转;1例出现切口积血,经换药、引流、加压包扎后愈合。切开钢板组5例患者切口持续渗液,经换药后愈合;3例在术后第8天出现切口皮缘坏死,经换药后延迟愈合;1例出现钢板外露,经换药80 d后延迟愈合。两组比较差异无统计学意义(P>0.05)。
2.5 典型病例治疗前后的影像学改变 A为跟骨侧轴位片,B为跟骨CT显示跟骨解剖外形丧失,C为跟骨短缩、内翻、横径变宽,D为后关节面塌陷、向前翻转,足弓高度下降。E~H 为术后3 d复查跟骨X线及CT,跟骨CT虽有伪影干扰,但仍可显示后关节面基本平整,Bohler角和Gissane角基本恢复;但跟骨下方一小骨块难以复位,考虑不对足弓及负重产生影响,故未予处理。I~K为术后即刻大体照,显示本研究中使用的Ilizarov组合式外固定架简洁、稳定、安全。通过胫骨和跟骨多平面、多角度、多点穿针,用稳定连接不稳定,最终重建稳定结构。L~O为术后2个月拆除外固定架后复查跟骨侧轴位片及跟骨CT显示最终骨折愈合情况及穿针情况。见图1。
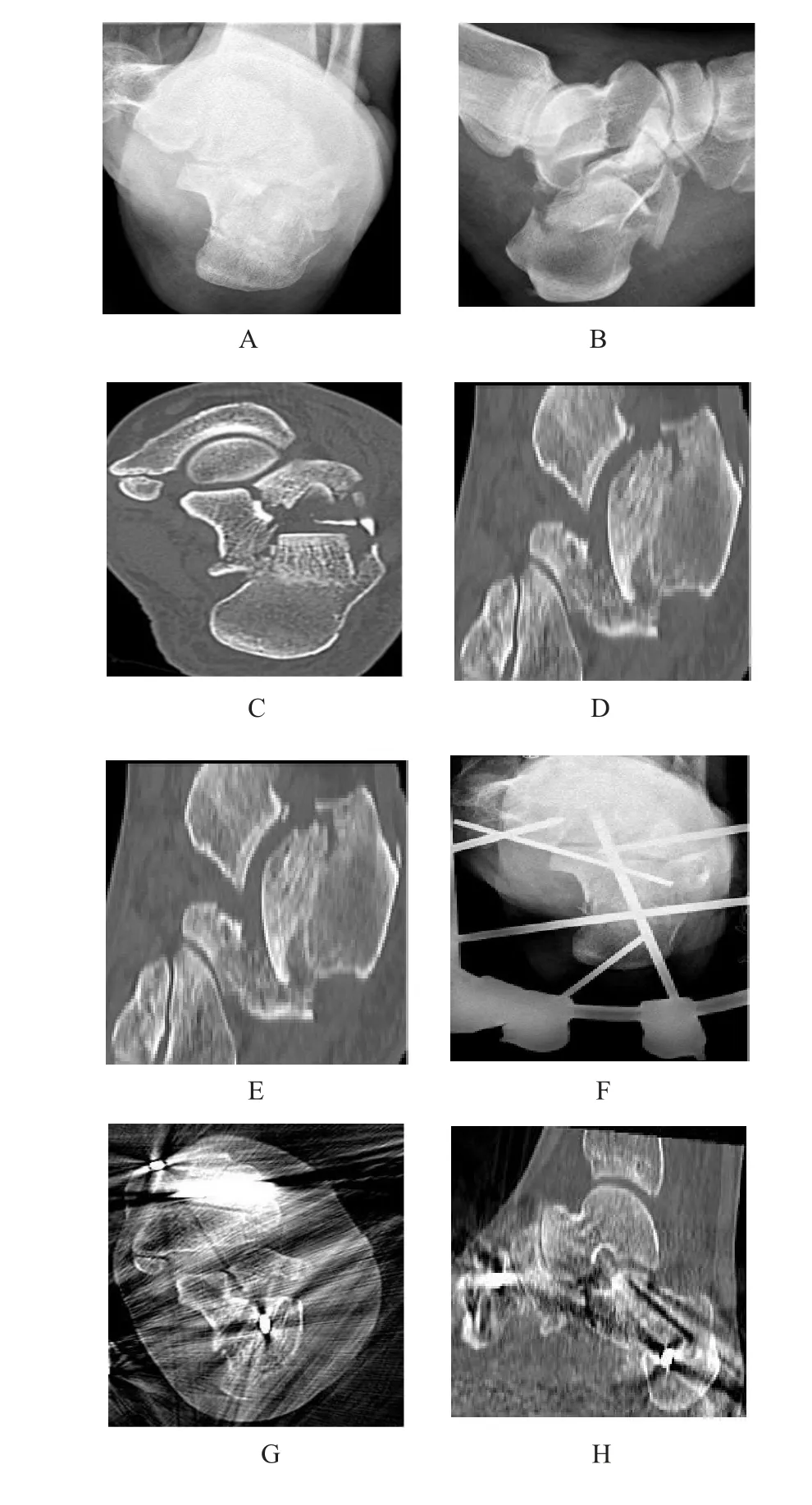

图1 典型病例治疗前后的影像学改变及大体照片
3 讨论
跗骨窦切口与Ilizarov技术对软组织要求相对较低。本研究中微创外架组等待手术时间明显少于切开钢板组,可避免因等待时间过长而导致的复位困难。跗骨窦切口部位皮瓣血供丰富,但切口对血供的影响较小[12]。Iliazrov外固定架穿针一般为2~4 mm,对血运损伤较小,且穿针后可避免软组织回缩张力导致的伤口并发症[13]。Ilizarov技术能多平面、多角度、多点穿针,且其牵张力可促进组织再生。面对像“核桃壳被夹子夹碎一样”的骨折碎裂,Ilizarov外固定架可因地制宜,随机穿针。外固定架还可通过牵拉骨折块上的韧带间接复位,恢复后距下关节的高度,减少内外翻和跟骨宽度。另外,克氏针固定的骨折可产生微动,避免应力遮挡。Ilizarov技术还可牵开关节,促进软骨再生。Watt FE等[14]发现,对晚期膝骨关节炎患者进行膝关节牵张,可持续改善患者临床症状,原因是牵张力可导致滑膜液产生分子改变,从而促进软骨修复。Wiegant K等[15]通过对犬膝关节进行牵张,发现关节内张力可通过提高软骨蛋白聚糖含量和减少胶原蛋白损失来促进软骨修复。本研究中虽然两组的AOFAS评分相比,差异无统计学意义,但微创外架组在评分更高,这可能与关节牵开导致的软骨再生有关。
跗骨窦切口弥补了闭合复位下距下关节复位不良的不足。我们前期研究发现对于后关节面骨折移位明显,特别是塌陷、翻转的情况,闭合的方法较难获得关节面的满意复位[11]。梅晓龙等[16]也发现闭合情况下不能显露骨折断端,撬拨复位难以控制小骨块,不能植骨填充以支撑关节面。而跗骨窦切口可以较好暴露距下关节面,有利于骨折的复位和固定[17],且其与传统大切口相比伤口并发症少[8],花费低[1]。本研究通过跗骨窦切口在直视下可更准确地钻入后关节面下方的穿针,对于关节面塌陷的情况,可方便地进行植骨填充,对关节面的支撑固定起到关键的作用。在适应证的选择上,对于Sanders Ⅱ型和关节面破坏不严重的Ⅲ型骨折,撬拨复位即可获得较满意的解剖参数,而不必切开[11];但关节面破坏严重的Ⅲ型和移位不严重的Ⅳ型骨折则需要跗骨窦切口辅助复位;对于复杂的Ⅳ型骨折,除非软组织损伤严重,否则不建议采用小切口加外固定架治疗的方法。
跟骨骨折常见的损伤机制为轴向暴力使距骨冲击跟骨,造成跟骨塌陷嵌插、短缩变宽,进而导致跟骨内翻,解剖外形丧失,足弓降低。根据逆损伤机制复位原则,首先通过牵引恢复跟骨长度,进而为达到后续复位目标创造空间。牵引针的穿针位置在跟骨结节前和距骨颈,此两点的连线应尽量与跟骨长轴平行,两牵引针之间也应尽量保持平行。撑开器撑开时,首先用锁扣将一端锁定,长度恢复满意时锁定另一端;内翻明显时,内侧撑开的长度会更大。锁定后须通过侧轴位片验证复位,以防复位丢失。验证时须注意足弓的恢复。上述牵引针作为最终固定针连接于外固定架。
Esparon T等[18]通过尸体解剖发现了跟骨穿针的高、中、低风险区,认为自外向内穿针时胫后动脉、胫后静脉和胫后神经是容易损伤的高危结构。因此,足部穿针除跟骨结节前的牵引针为透针外,其余均为半螺纹针。在钻入半螺纹针时应先分离周围软组织,用软组织保护器钻入,以防损伤周围血管神经。后关节面下穿针位置应选择在关节面下5~10 mm指向载距突方向,以2枚细针为宜。跟骨纵向穿针应穿过后跟距关节,穿至距骨。还须在骰骨和舟骨各穿1枚半螺纹针以增加稳定性。另可根据骨折情况增加穿针,穿针可连接外固定架,亦可不连接。
术前应分析跟骨CT,以了解骨折情况;同时拍摄健侧跟骨侧轴位片,以了解患者自身跟骨的解剖参数,为术中复位提供参照。应用跗骨窦切口可更方便地观察关节面复位情况,但不能放弃撬拨复位,尤其注意应用牵引针和撑开器进行复位。钻入跟骨结节前的牵引针时不能过于偏下,以防负重疼痛;不能过于靠近跟腱,以减少跟腱感染概率。对关节面塌陷的患者,须植入同种异体骨或自体骨进行支撑。对于严重粉碎的Ⅳ型骨折,在关节面难以维持的情况下,应首先保证跟骨力线和足弓的恢复。并注意缝合穿针创口,以减少穿针摩擦皮肤造成钉道感染。
在随访期内微创外架组取得了与经外侧扩大切口钢板内固定相当的疗效,且软组织并发症相对较少。但仍有不足:(1)学习曲线长。跗骨窦切口和外固定穿针技术均需医师有一定手术经验的积累和较长的学习过程。(2)虽然在跗骨窦切口监视下可以更方便进行后关节面的复位,但对于严重粉碎的Ⅳ型骨折,仍难以获得满意的复位和固定,而仅仅是恢复了力线和足弓。对于这部分患者,并非全部都出现了距下关节僵硬的情况,究竟是随访时间短,还是关节面磨损导致的重新匹配,这需要进一步研究。(3)即使是在跗骨窦切口直视下,通过外固定架牵伸结合撬拨复位,小的骨折块仍难以复位。(4)此为回顾性研究,难免产生选择偏倚,有待前瞻性随机对照研究进一步解决。(5)目前的穿针位置和外固定架设计是否为最优,仍需要生物力学的研究支持。

