江水短时浸渍法脱胶亚麻纤维果胶单糖组分的变化
姜彩霞,郑喜群,刘晓兰,田英华
(1.黑龙江八一农垦大学 国家杂粮工程技术研究中心,黑龙江 大庆 163319; 2.黑龙江八一农垦大学 食品学院,黑龙江 大庆 163319; 3.齐齐哈尔大学 食品与生物工程学院,黑龙江 齐齐哈尔 161006)
亚麻(flax)学名为LinumusitatissimumL,为一年生草本植物。亚麻纤维是一种天然的植物纤维,具有“绿色保健”的特点[1-2],为纺织、生物复合材料等领域提供了优质的纤维材料[3-5]。亚麻纤维以束纤维的形式分布于亚麻茎的韧皮部,束纤维之间及单纤维之间主要依靠果胶等胶质物质发挥黏连作用,因此部分去除果胶等胶质物质,即半脱胶工艺成为了制备亚麻纤维的首要环节[6]。目前针对麻类脱胶技术的研究多集中在脱胶菌和脱胶酶的研发与应用方面[3,7],而对于脱胶过程中果胶等胶质物质成分的变化鲜见报道。
一般酶法脱胶因其成本较高,故制约了其工业化进程[8]。本文采用江水短时浸渍法脱胶,主要是指亚麻不进行长时间浸泡,而是短暂地浸渍在江水中,使亚麻茎尽可能吸收江水达到饱和,保持亚麻茎的高度湿润状态,利用江水中存在的天然微生物所产生的大量酶系直接作用于亚麻茎,从而达到脱胶效果。另一方面,利用PMP (1—苯基—3—甲基—5—吡唑啉酮) 柱前衍生化高效液相色谱法测定脱胶过程中亚麻纤维果胶单糖组分的变化,为进一步探究麻类半脱胶工艺的机制奠定理论基础。
1 材料与方法
1.1 主要材料、试剂与设备
亚麻原茎(齐齐哈尔金鼎亚麻纺织有限责任公司);江水(取自嫩江)。
D-(+)-半乳糖(Gal)、D-葡萄糖醛酸(Glu acid)、L-(+)-鼠李糖(Rha)、D-(+)-半乳糖醛酸(Gal acid)、D-甘露糖(Man)、D-(+)-木糖(Xyl)、D-(+)-岩藻糖(Fuc)、葡萄糖(Glu acid)、D-阿拉伯糖(Ara)(均为生化试剂,国药集团化学试剂有限公司);PMP(阿拉丁化学试剂有限公司);液相用试剂均为色谱纯,其他均为分析纯。
高效液相色谱仪(安捷伦科技有限公司); SunFireTM C18色谱柱(4.6 mm×250 mm,5 μm)(美国Water公司)。
1.2 试验条件
1.2.1 江水短时浸渍法脱胶方法
取3份烘干的亚麻纤维,每份约10.0 g,全部进行碾压处理,按质量比1∶10的比例加入江水(经4层无菌纱布过滤),按下述流程进行浸渍脱胶:浸渍30 min,同时以150 r/min的频率进行震荡处理,震荡结束后再淋洗30 s,37 ℃恒温培养,需在脱胶过程中保持亚麻纤维湿润状态,直至达到脱胶终点。
1.2.2 亚麻脱胶终点的判定
Fried评分法:将不同脱胶时间处理的亚麻茎置于试管中,加入沸水,封口,先轻摇30 s,后在垂直方向大力振摇10次,根据纤维分散情况记分:0分(不分散);1分(部分分散);2分(基本分散);3分 (分散良好)。
1.2.3 亚麻纤维果胶的提取及水解条件
采用草酸铵法提取亚麻纤维果胶[2]:草酸铵质量分数1%,提取温度90 ℃,料液比1∶45(g/mL),提取时间4 h,提取液透析48 h,透析液冷冻干燥后备用。亚麻纤维果胶经三氟乙酸完全水解[10],氮气吹干。
1.2.4 单糖组分的测定条件
亚麻纤维果胶单糖组分的测定参照PMP柱前衍生化方法[9]:PMP与单糖物质的量比为5∶1,NaOH与单糖物质的量比为3∶1,水浴70 ℃,反应30 min。
高效液相色谱检测条件:流动相磷酸盐缓冲液(pH值6.7)与乙腈的体积比为83∶17;流速1.0 mL/min,波长245 nm。
2 结果与讨论
2.1 亚麻纤维脱胶终点的确定
采用Fried评分法对江水短时浸渍法脱胶的亚麻纤维进行评分,由Fried评分标准可知,当评分为2分时表明亚麻纤维已基本分散,此时应适量增加检测的频率,直至评分为3分,确定为脱胶终点,不同脱胶时间亚麻纤维的评分结果见表1。

表1 不同脱胶时间Fried评分
由表1可知,江水短时浸渍法脱胶72 h时亚麻纤维开始出现部分分散现象,脱胶108 h时亚麻纤维基本分散,当脱胶时间达到120 h时纤维分散良好,到达脱胶终点。
2.2 9种单糖混合标准品柱前衍生高效液相色谱分析
首先采用PMP柱前衍生化方法对9种单糖标准品分别进行高效液相色谱分析,确定每种单糖的保留时间,为简化实验流程,同时增强标准品的对照性,将9种单糖混合标准品利用同样方法衍生后进行高效液相色谱分析,9种单糖标准品柱前衍生高效液相色谱图见图1。

图1 9种单糖标准品柱前衍生高效液相色谱图
由不同单糖PMP柱前衍生物HPLC图谱可确定每种单糖不同的保留时间,并以此确定混合标准品(图1)按保留时间从小到大依次为Man、Rha、Glu acid、Gal acid、Glu、Gal、Xyl、Ara、Fuc的衍生物。
2.3 9种单糖含量标准曲线的绘制
分别配制0.5、1.0、2.0、4.0、6.0、8.0、10.0 mmol/L 9种单糖混合标准品进行柱前衍生化高效液相色谱法分析,测定不同浓度下每种单糖衍生物的峰面积。以单糖浓度为横坐标,衍生物峰面积为纵坐标分别绘制9种单糖含量的标准曲线,9种单糖含量标准曲线见表2。
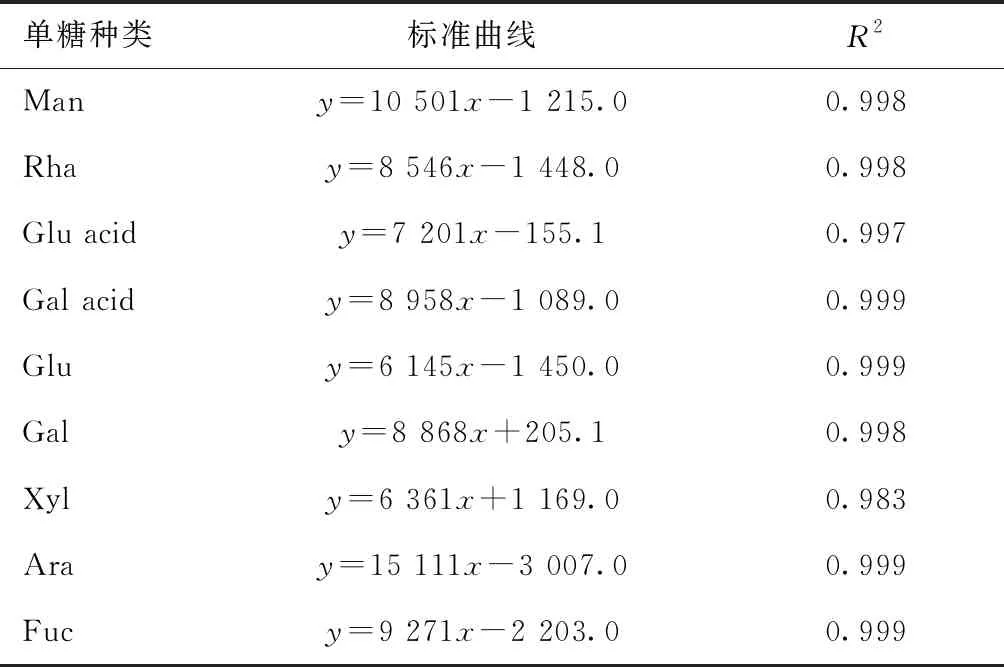
表2 9种单糖含量标准曲线
不同浓度的单糖混合标准液经PMP柱前衍生化高效液相色谱法分析,各单糖保留时间重现性良好。由表2可知,各单糖含量在0.5~10.0 mmol/L范围内衍生物峰面积与浓度呈现良好的线性关系。
2.4 未脱胶亚麻纤维果胶单糖组分分析
经草酸铵法提取未脱胶亚麻纤维果胶组分,经酸完全水解后利用PMP柱前衍生化高效液相色谱法测定其单糖组成,并通过9种单糖含量的标准曲线计算出各种单糖的浓度,结果如图2所示。
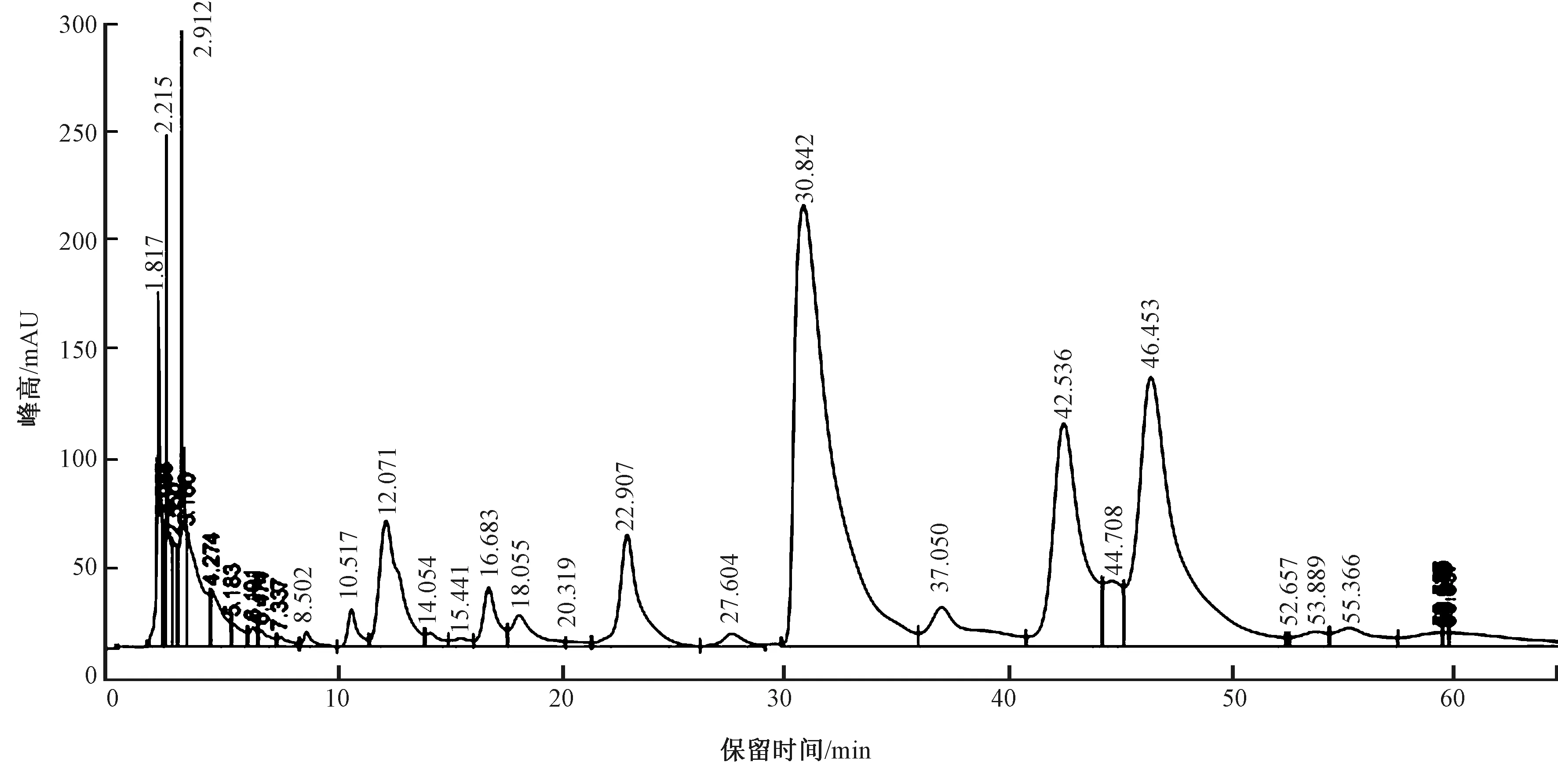
图2 亚麻纤维果胶水解样品柱前衍生高效液相色谱图
通过亚麻纤维果胶水解后高效液相色谱图可以看出,各单峰没有重叠,分离效果良好。通过与9种单糖混合标准品柱前衍生高效液相色谱图对照,最终确定亚麻纤维果胶中单糖组分为:Man、Rha、Glu acid、Gal acid、Glu、Gal、Xyl、Ara和Fuc。另外,通过各单糖含量标准曲线计算出亚麻纤维果胶中各单糖物质的量比为Gal acid∶Ara∶Gal∶Glu∶Rha∶Fuc∶Xyl∶Man∶Glu acid=64.52∶28.23∶25.55∶17.75∶13.41∶7.36∶5.72∶5.18∶5.05。
2.5 不同胶脱时间亚麻纤维果胶单糖组分的变化
采用江水短时浸渍法脱胶,从不同脱胶时间的亚麻纤维中提取果胶组分,经完全酸水解后利用PMP柱前衍生化高效液相色谱法进行分析,随着脱胶时间的延长亚麻纤维果胶单糖组分的变化如图3所示。

图3 不同脱胶时间亚麻纤维果胶单糖组分的变化
采用江水短时浸渍法脱胶后亚麻纤维果胶单糖比例为Gal acid∶Gal∶Rha∶Ara∶Glu∶Xyl∶Man∶Glu acid=2.15∶0.57∶0.53∶0.42∶0.41∶0.30∶0.29∶0.19。脱胶过程中各单糖含量逐渐降低,但单糖种类变化不大,其中脱胶前24 h内各单糖含量降低较为明显,Fuc在脱胶96 h后含量为零。此外其余各单糖含量变化从大到小依次为Ara、Gal、Glu、Gal acid、Glu acid、Rha、Xyl、Man,损失率分别为85.00%、77.64%、76.67%、66.72%、61.43%、60.44%、48.01%和44.19%。
3 结 论
经PMP柱前衍生化高效液相色谱法测定出未脱胶亚麻纤维果胶中各单糖物质的量比为Gal acid∶Ara∶Gal∶Glu∶Rha∶Fuc∶Xyl∶Man∶Glu acid=64.52∶28.23∶25.55∶17.75∶13.41∶7.36∶5.72∶5.18∶5.05。采用江水短时浸渍法脱胶120 h后达到脱胶终点,脱胶后亚麻纤维果胶各单糖物质的量比例为Gal acid∶Gal∶Rha∶Ara∶Glu∶Xyl∶Man∶Glu acid=2.15∶0.57∶0.53∶0.42∶0.41∶0.30∶0.29∶0.19。脱胶过程中各单糖含量逐渐降低,但单糖种类变化不大,其中脱胶前24 h内各单糖含量降低较为明显,Fuc在脱胶96 h后含量为零。此外其余各单糖含量变化从大到小依次为Ara、Gal、Glu、Gal acid、Glu acid、Rha、Xyl、Man,损失率分别为85.00%、77.64%、76.67%、66.72%、61.43%、60.44%、48.01%和44.19%。本文研究通过对江水短时浸渍法脱胶过程中亚麻纤维果胶单糖组分变化的分析为进一步探究麻半脱胶的机制奠定了理论基础。

