酸性红壤上玉米不同部位固氮微生物群落丰度和组成特征
王 超,陈 娟,沈仁芳*
(1 土壤与农业可持续发展国家重点实验室/中国科学院南京土壤研究所,南京 210008;2 中国科学院大学,北京 100049;3 浅水湖泊综合治理与资源开发教育部重点实验室/河海大学,南京 210098)
在中国,酸性土壤 (pH<5.5) 面积约 2.18 亿 km2,占土壤总面积的22.7%,主要分布在南方热带和亚热带地区[1]。这些地区具有充足的水热资源,较高的生产潜力,但是较高的土壤酸度严重限制了作物的生产。尤其是近几十年来,不合理的土壤利用在不断加速土壤酸化,对该地区生态环境构成了严重威胁[2-3]。其中,大量化学氮肥的投入是土壤加速酸化的主要诱因,并引起面源污染和温室气体排放增加等一系列负面影响[2,4]。因此,当务之急是在稳产、增产的同时减少化学氮肥的投入。生物固氮是固氮微生物将大气中不能被植物直接利用的氮气还原成氨的过程,是经济、无污染和生态友好的氮素供应方式[5-6]。生物固氮的挖掘和利用,在提高作物产量、降低化肥使用量、减少环境氮污染以及缓解土壤酸化等方面具有重要意义。
固氮微生物具有丰富的生物多样性,按照固氮条件和生活习性,可分为共生固氮、联合固氮和自生固氮[7]。除对豆科植物根瘤共生固氮微生物的研究外,近年来,非豆科植物的非共生固氮受到广泛关注,涉及联合固氮和自生固氮[7-9]。相对于共生固氮而言,非共生固氮速率虽然较低,但对非豆科作物的氮素来源具有重要贡献[7,10]。非共生固氮微生物在时空分布上更为广泛,在植物根际、根部、叶面甚至组织内部经常被发现[9]。目前,在水稻、玉米和小麦等作物中均发现了大量非共生固氮菌,暗示了禾本科作物具有生物固氮的潜力[11-13]。生物固氮效率的高低与固氮微生物数量和种群结构的变化密切相关[14-15]。对于固氮微生物种类的认识,以前的大多研究仅局限于纯培养技术,大大限制了对固氮菌的了解。随着高通量测序的发展,利用分子生态学方法发现了大量不可培养的固氮微生物[16],其中nifH基因已经被广泛应用于对固氮微生物的多样性和群落结构的研究中,进而反映生态环境中固氮功能的变化和潜能[17-18]。
在酸性土壤中,铝毒是限制作物生长的主要因素之一,植物基因型表现不同的耐铝能力去适应酸性土壤环境[19-20]。而这些植物基因型可直接影响或通过改变土壤环境间接影响土壤微生物的群落结构、多样性和丰度[18,21]。我们前期研究中发现,酸性土壤上不同耐铝能力的玉米品种形成了差异明显的根际固氮微生物群落组成,说明植物基因型控制着根际固氮微生物群落[18]。这可能由于非共生固氮菌与植物构成的体系容易受到植物因素的影响[7]。目前,对不同耐铝植物品种根部和叶际固氮微生物的物种组成和群落结构还缺乏认识。因此,本研究采用荧光定量PCR和高通量测序相结合的方法,以固氮微生物nifH基因为分子标记,对耐铝玉米品种先玉335和铝敏感玉米品种Mo17的不同部位 (叶部、根部和根际土壤) 中的固氮微生物群落丰度、多样性和结构组成进行研究,目的在于探讨固氮微生物群落在不同玉米品种和不同部位的存在特征,为探明酸性土壤植物氮素养分途径提供理论依据。
1 材料与方法
1.1 试验材料和盆栽试验
供试土壤取自中国科学院江西鹰潭农田生态系统国家野外科学观测研究站的松树林。土壤母质为第四纪红粘土,土壤基本理化性质为pH 4.62、有机质 7.20 g/kg、全氮 0.40 g/kg、全磷 0.38 g/kg、全钾10.53 g/kg、可交换性铝 0.25 g/kg。玉米品种选用本课题组前期研究中的杂交系先玉335 (耐铝)和自交系 Mo17 (铝敏感)[18]。
盆栽试验于2019年4—5月在中国科学院南京土壤研究所遮阴网室中进行,培养条件为自然光照。每盆各装2.0 kg土壤,并施用磷酸二氢钾0.20 g/kg和硫酸铵0.50 g/kg作为基肥。在玉米播种前,先将基肥和土壤充分混匀,浇灭菌的纯净水,平衡一周。每个玉米品种分别种植4盆,每盆播种10粒玉米种子,在地上部长到1 cm高时间苗,每盆留3棵幼苗。自间苗之日起,进行为期4周的培养。期间土壤含水量保持在20% (w/w)。
培养结束后,分别收集玉米根系和地上部,采用抖根法收集根际土壤,每盆玉米根际土壤收集并混匀为一个土壤样品,相应的根系和地上部也分别混合为一个样品。取一部分根部和叶部样品保存于–80℃冰箱,用于土壤DNA的提取。土壤样品过2 mm筛后分为3份,一份保存于–80℃冰箱用于土壤DNA的提取;一份4℃保存,用于铵态氮和硝态氮测定;余下部分自然风干、过筛和研磨用于土壤理化指标测定。
1.2 玉米植株氮磷含量和土壤理化指标测定
收集的根系和地上部样品,用蒸馏水冲洗后于105℃杀青,随后70℃烘干至恒重,称重。样品粉碎,经H2SO4–H2O2消煮后用凯氏定氮仪测定氮含量;经HNO3消煮后,采用钼锑抗比色法测定磷素含量。
土壤理化性质测定参照《土壤农业化学分析方法》[22]进行。土壤pH采用pH计测定,全氮测定采用凯氏定氮法,有效磷测定采用碳酸氢钠浸提—钼锑抗比色法,速效钾测定用乙酸铵浸提—火焰光度法,有机质测定用重铬酸钾容量法—外加热法,铵态氮和硝态氮采用流动分析仪测定。
1.3 土壤和植株 DNA 提取
采用 DNA 试剂盒 (FastDNA SPIN Kit for soil) 提取土壤DNA,然后用DNA纯化试剂盒 (PowerClean®DNA Clean-up Kit) 对 DNA 进行纯化。
将新鲜玉米根部和叶部分别用无菌剪刀剪成2 cm 的小段,70% 酒精浸泡 30~60 s,10% NaCl处理10 min进行表面灭菌,然后无菌水冲洗4次,每次10 min,最后一次洗涤的无菌水涂布在LB平板上作为对照,确定是否消毒彻底。将消毒的根和叶片采用 DNA 试剂盒 (Fast DNA SPIN Kit for soil) 提取植株DNA。
1.4 nifH基因丰度测定
固氮菌nifH基因的扩增引物序列为PolyF:5′–TGCGAYCCSAARGCBGACTC–3′和PolyR:5′–ATSGCCATCATYTCRCCGGA–3′[23]。利用荧光定量PCR技术检测nifH基因拷贝数,反应在荧光定量PCR 仪 LightCycler 480 系统 (Roche Diagnostics,Mannheim,Germany) 上进行。反应体系为:2 ×SYBR real-time PCR premixture (Bioteke,大连)10 μL,上下游引物 (10 μmol/L) 各 0.8 μL,DNA 模板 2.0 μL(1~10 ng),最后用灭菌的超纯水补至20 μL。荧光定量 PCR 反应条件为:94℃ 5 min;94℃ 30 s,58℃ 30 s,72℃ 30 s,42 个循环。按照我们以前的方法[18,24],获得含有nifH基因的重组质粒,分别以10倍梯度稀释基因重组质粒得到标准曲线。并根据标准曲线计算基因丰度。
1.5 高通量测序和数据处理
采用引物PolyF/PolyR扩增固氮菌nifH基因。扩增时在每个样品的上游引物5'端添加一段长度为7个碱基的特异性多肽用于区分样品。PCR体系(25 μL):5 × ExTaq 缓冲液 5.0 μL,dNTP (2.5 μmol/L) 2.0 μL,上下游引物 (10 μmol/L) 各 1.0 μL,DNA 模板 2.0 μL (1~10 ng),最后用灭菌的超纯水补至25 μL。PCR 反应条件为:94℃ 5 min;94℃ 30 s,58℃ 30 s,72℃ 30 s,30 个循环;72℃ 7 min。扩增结果进行1%琼脂糖凝胶电泳,切取目的片段用凝胶回收试剂盒回收。PCR产物送至上海派森诺测序公司,运用IlluminaMiSeq测序平台进行测序。
利用FLASH软件对双端序列进行连接后,通过QIIME软件调用USEARCH检查并剔除嵌合体序列。质量和拼接的效果进行质控过滤,根据序列特异性多肽和引物序列区分样品得到有效序列。再将序列翻译成为氨基酸序列,含有终止子或与nifH蛋白不匹配的序列删掉。最后,优质序列聚类成操作分类单元 (operational taxonomic unit,OTU),阈值设置为90%[17-18],并选取每个OTU中丰度最高的序列作为代表序列。这些序列与NCBI GenBank中已知nifH序列相比对,以此对OTU进行分类注释[17-18]。将每个样品的OTU序列稀释到相同水平 (26900个有效序列),用于α和β多样性分析。使用QIIME软件中alpha_diversity.py指令计算出每个样品的Shannon指数。
1.6 数据分析
不同玉米品种间的干重、氮磷含量和土壤根际理化性质差异采用SPSS 22.0软件的单因素方差分析(One-way ANOVA) 进行检验,并通过 Duncan 检验进行多重比较。玉米品种和取样部位对固氮微生物群落丰度、多样性指数和优势菌属相对丰度的影响采用双因素方差分析进行检验,如果影响达到显著水平,再用单因素方差分析或T-test进行差异比较。通过非度量多维尺度 (NMDS),(vegan程序包,R语言) 分析固氮微生物群落结构的相似程度,并对不同品种和不同取样部位间的群落相似性差异进行多因素方差 (PERMANOVA) 分析 (vegan 程序包,R 语言)。
2 结果与分析
2.1 玉米生物量、氮磷含量及根际土壤理化性质
在酸性红壤上生长1个月的玉米,耐铝品种先玉 335 地上部和根部生物量显著 (P<0.05) 高于铝敏感品种Mo17 (表1),表明耐铝品种更适应酸性土壤。然而,铝敏感品种Mo17地上和根部氮、磷含量显著 (P<0.05) 高于先玉 335 (表 1),这可能由于耐铝品种吸收的养分分布到更大的生物量中,从而对养分元素产生了稀释作用。

表 1 玉米地上部和地下部生物量和氮磷含量Table 1 Biomass, N and P concentrations in maize shoot and root
玉米收获后,先玉335根际土壤比Mo17根际土壤具有更低的土壤pH、铵态氮和速效钾含量 (P<0.05),然而两者间的硝态氮、有效磷、全氮和有机质含量没有显著差异 (表2)。耐铝品种更高的生物量需要从根际土壤中吸收更多养分,而根系吸收更多铵态氮伴随质子释放,加速根际土壤酸化。
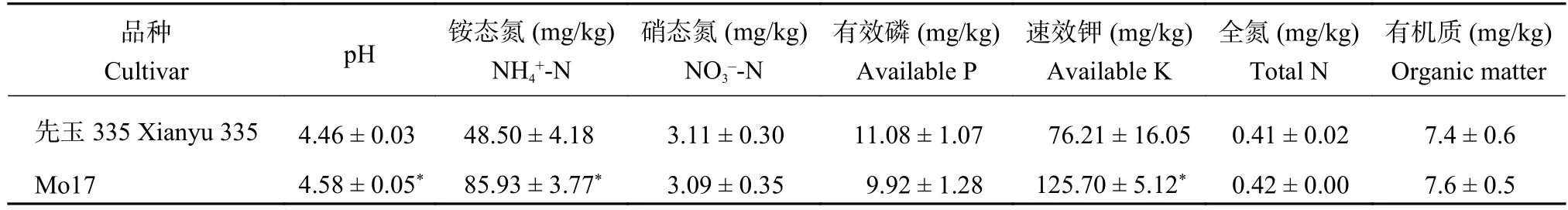
表 2 玉米根际土壤理化性质Table 2 Soil physicochemical characteristics in the rhizosphere soil of maize
2.2 固氮微生物 nifH基因丰度
植株和根际土壤样品nifH基因丰度范围为1 g 干土或植株 0.32 × 105~8.92 × 105copies。双因素方差分析显示,取样部位 (根际土壤、根部和叶部)和玉米品种 (先玉 335和Mo17) 都显著 (P<0.05) 影响固氮微生物nifH基因丰度 (图1),但是取样部位的影响程度 (F=285.072,P=0.000) 要高于品种 (F=14.371,P=0.001)。对于每个品种的不同取样部位,根部nifH基因丰度显著 (P<0.05) 高于根际土壤和叶部的丰度,而根际土壤 (0.62 × 105copies/g 土和0.64 × 105copies/g 土)和叶部 (0.59 × 105copies/g 植株和0.50 × 105copies/g 植株) 之间没有显著差异。对于不同玉米品种,先玉335根部nifH基因丰度 (7.61 ×105copies/g 植株) 显著 (P<0.05) 高于 Mo17 根部(5.12 × 105copies/g 植株),然而根际土壤和根叶部nifH基因丰度在两个品种间没有显著差异。这些结果说明,酸性红壤上固氮微生物群落丰度在玉米不同部位间的差异程度大于品种间的差异程度。

图 1 玉米根际、根系和叶片nifH基因丰度Fig.1 The nifH gene abundance in the rhizosphere, root and leaf of maize
2.3 固氮微生物测序结果和α 多样性
利用IlluminaMiSeq平台对固氮微生物nifH基因进行测序,经质控和蛋白翻译检测后,将每个样品的有效序列稀释到相同测序深度 (26900个有效序列),以用于α和β多样性分析。把相似度水平 ≥ 90%的序列聚为一个操作分类单元 (OTU),根际土壤、根部和叶部中获得的OTU数量分别为258~291、166~200和103~126。α多样性主要分析了Shannon指数和OTU数量 (图2)。双因素方差分析可见,取样部位显著影响 Shannon 指数 (F=167.728,P=0.000)和OTU 数量 (F=306.460,P=0.000),而品种并未表现显著影响。在不同的取样部位,Shannon指数和OTU数量的变化趋势一致为根际土壤>根部>叶部。这些结果说明,固氮微生物群落多样性在玉米不同部位间的差异程度大于品种间的差异程度。

图 2 玉米根际、根系和叶片固氮菌群落多样性指数Fig.2 Diazotrophic community diversity index in the rhizosphere, root and leaf of maize
2.4 固氮微生物优势菌属
通过对样品获得的OTUs进行归类,得到2个门,4个纲,11个目,21个科和39个属。在门水平上,分别为变形菌门 (Proteobacteria)和蓝藻门(Cyanobacteria),在根际土壤和根部样品中变形菌门占65.96%~98.27%,叶部样品中蓝藻门占40.86%~64.43%。在属水平上 (图 3),优势属 (相对丰度>1%) 主要包括慢生根瘤菌属 (Bradyrhi zobium)、细鞘丝藻属 (Leptolyngbya)、伯克氏菌属(Burkholderia)、鞘脂单胞菌属 (Sphingomonas)、寡养单胞菌属 (Stenotrophomonas)、动胶菌属 (Zoogloea)、艾德昂菌属 (Ideonella)、固氮根瘤菌属 (Azorhizobium)、甲基细胞菌属 (Methylocella)、固氮弧菌属(Azohydromonas)、红游动菌属 (Rhodoplanes)、厌氧粘细菌属 (Anaeromyxobacter)和磁螺菌属(Magnetospirillum)。其中Bradyrhizobium在根际土壤和根部样品中为最多的优势属,相对丰度占17.92%~65.86%,而Leptolyngbya在叶片样品中为优势属,相对丰度为40.64%~64.37% (图3)。双因素方差分析显示 (表 3),取样部位显著 (P<0.05) 影响Bradyrhizobium、Leptolyngbya、Burkholderia、Sphingomonas、Stenotrophomonas、Zoogloea、Ideonella、Azospirillum和Rhodoplanes的相对丰度,而玉米品种仅仅显著影响Leptolyngbya的相对丰度。其中,相比于根际土壤和根部样品,叶部含有更高的Leptolyngbya相对丰度 (59.96%和44.70%)和更低的Bradyrhizobium相对丰度 (7.16%和5.70%)。
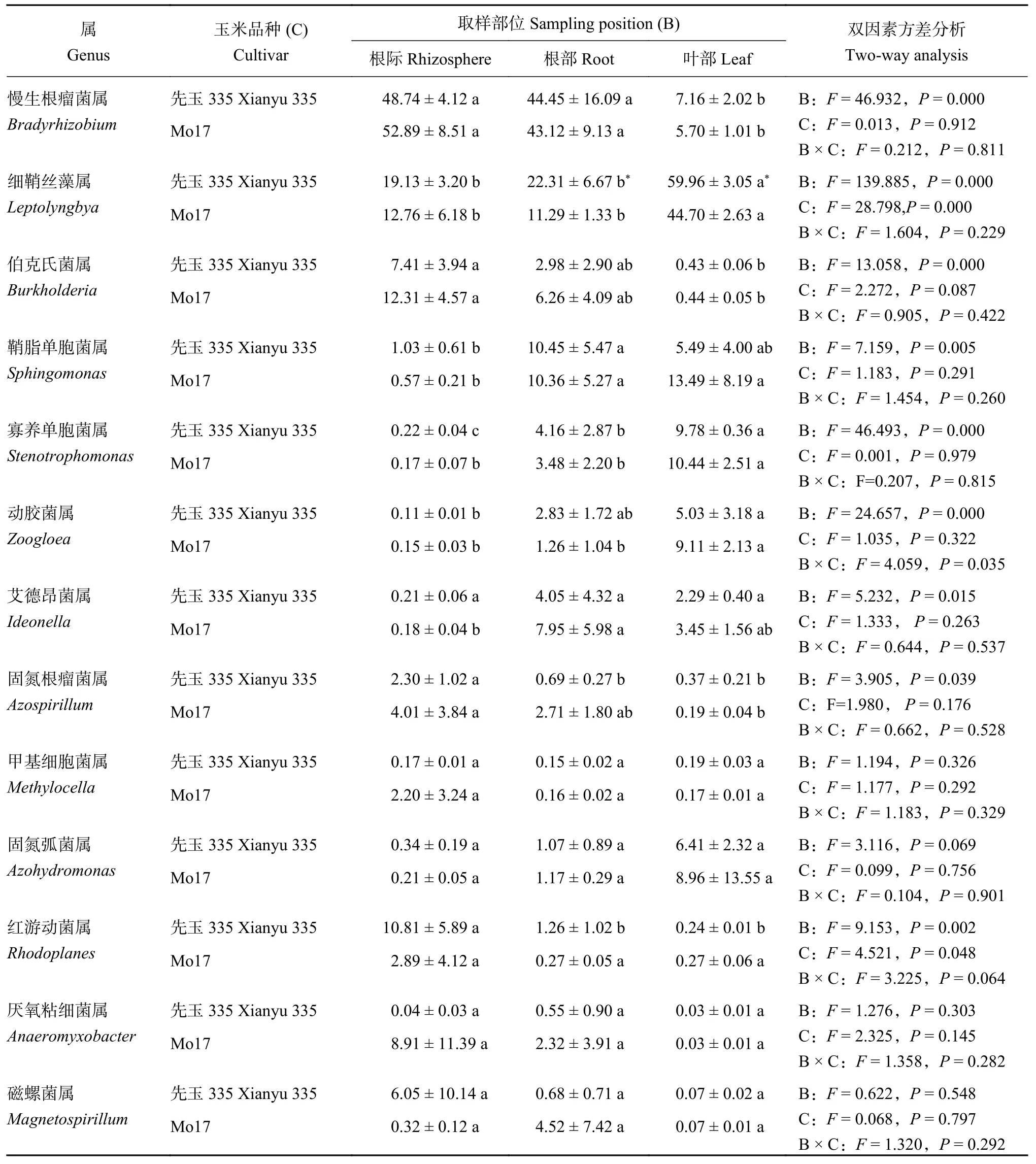
表 3 玉米根际、根和叶片中优势固氮菌属 (>1%) 的相对丰度比较 (%)Table 3 Comparison of the relative abundances of dominant diazotrophic genera (>1%) in rhizosphere,root and leaf of maize
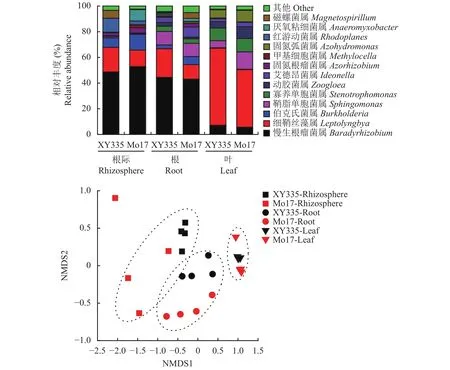
图 3 玉米根际、根系和叶片优势固氮菌属种类 (>1%)和固氮菌群落结构的 NMDS 分析Fig.3 The relative abundance of the dominant diazotrophic genera (>1%) in the rhizosphere, root and leaf of maize and the non-metric multidimensional scaling analysis (NMDS) of diazotrophic community composition
2.5 固氮微生物群落结构
采用NMDS可视化了固氮微生物的群落结构(图3),结果显示两个玉米品种相同取样部位样品的聚集更加紧凑,相比叶部,根际土壤和根部样品距离更近。PERMANOVA分析进一步证实了取样部位(R2=0.461,P=0.001) 对固氮微生物群落组成的影响程度大于玉米品种 (R2=0.077,P=0.006),尽管两者都产生了显著影响 (表4)。在不同取样部位中,固氮微生物群落组成在根际土壤、根部和叶部之间的差异都达到显著水平 (P<0.05),而根际土壤与叶部 (R2=0.523)、根部与叶部之间的差异 (R2=0.460)程度明显高于根际土壤与根部之间的差异 (R2=0.188)。对于不同玉米品种,根际土壤样品间存在显著差异 (P<0.05),而根部和叶部样品在两个品种间的差异未达到显著水平。这些结果可见,酸性红壤上玉米不同部位对固氮微生物群落组成的影响程度大于品种的影响。
3 讨论
在贫瘠的酸性土壤上,除了严重的毒害因子 (例如铝毒、锰毒),养分缺乏也是限制作物生长的重要因素[3-4,19]。因此,充分发挥固氮微生物功能对保障酸性土壤植物氮素供应,以及降低化学氮肥的投入具有重要贡献。其中固氮微生物群落结构组成和丰度对生物固氮潜能及维持氮素循环平衡起到关键作用[14-15]。已有研究认为植物与固氮微生物的互作关系受植物基因型的控制[18]。而本研究发现,相对于玉米品种,玉米不同部位间的固氮微生物丰度、多样性和群落组成的差异更为明显 (图1、图2和表4),说明玉米不同部位为固氮微生物的定殖和生长提供了不同的环境场所。这些场所不仅为固氮微生物提供赖以生存的营养物质和能量来源,而且也存在一些障碍因子,已形成了独特的固氮微生物生态位。类似的,Prakamhang等[25]研究发现,水稻不同组织对固氮微生物的影响要远远大于土壤类型和施肥。Rodríguez-Blanco等[26]研究也发现,固氮微生物物种对植物不同组织表现出很强的偏好性。
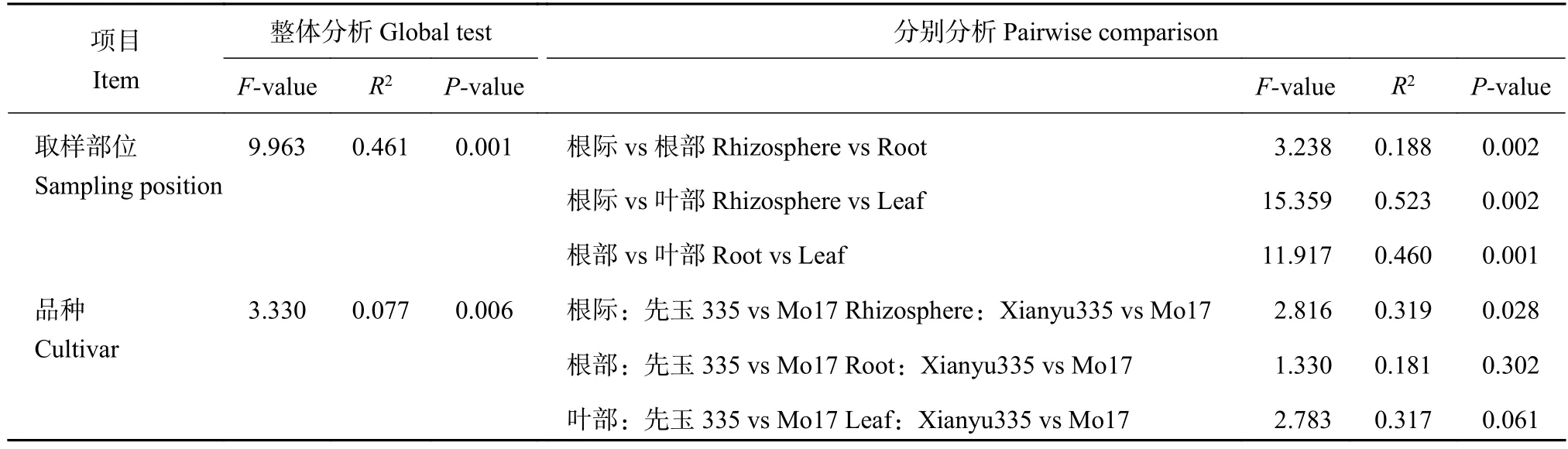
表 4 玉米不同取样部位固氮微生物群落组成的PERMANOVA分析Table 4 PERMANOVA analysis (global test and pairwise comparison) of diazotrophic community composition in different sampling positions and cultivars of maize
尽管植物根部定殖的微生物物种主要来源于周围根际土壤,但是在多数研究中根际土壤和根部表现出明显不同的微生物群落组成[24]。在本研究中,相比于根际土壤,根部固氮微生物丰度更高 (图1),说明根部环境有利于固氮微生物的生长,但是多样性指数更低 (图2),而且两者之间的固氮微生物群落组成也明显不同 (表4)。这与我们以前的研究结果相似[24]。作为微生物的栖息地,根部通过细胞壁、组织结构以及防御系统,特异地从周围土壤中选择微生物物种在根部组织中定殖[27]。一旦在根部定殖,固氮微生物物种将降低土壤氮素的抑制作用以及与土著微生物的竞争关系。此外,植物根部分泌碳源和抑菌物质在促进一些微生物物种生长的同时也抑制了其他物种的生长[25]。植物根部分泌的糖、有机酸、氨基酸形成的梯度和低氧浓度能吸引特定固氮菌,降低其对营养物质的竞争,促进植物与菌体之间的物质交换[28]。因此,这些进入植物根部的固氮微生物物种,具有较高的特异性,占据着根部组织内有利于营养供应和微环境适宜的生态位,不仅提高自身生长,而且能够有效地拮抗病原微生物的生长,较根外环境更有利于形成高效固氮体系。
研究发现,相对于根际土壤和根部,叶部固氮微生物群落组成的差异更大,多样性更低 (图2和表4)。与根际环境相比,叶际生态系统相对简单,环境比较苛刻,营养物质更为贫乏[29-30]。尽管叶际微生物与其生存环境形成了一个复杂的生态系统,但是由于直接暴露在空气中,紫外线照射和存在活性氧,以及昼夜温差和湿度波动等不利因素都会直接或间接的影响叶际固氮微生物的生存,使其与周围土壤中的微生物群落组成明显不同[29,31]。因此,叶际固氮微生物物种的适应性是环境和植物分泌物性质的特殊选择,导致为固氮微生物提供了更少的生态位。然而,这些叶际固氮微生物对植物氮素供应仍然起着重要作用。
前期研究发现,玉米耐铝性影响了根际土壤固氮微生物的群落组成[18]。本研究也发现了类似现象,但是在叶部和根部中玉米品种间的固氮微生物群落组成没有显著差异 (表4),说明玉米耐铝性对固氮微生物群落组成的影响表现出部位间的差别。有机酸分泌被认为是植物耐铝毒的一个重要机制,在酸性土壤中耐铝植物往往比铝敏感植物分泌更多的有机酸[19-20]。这些有机酸分泌上的差别可能影响根际土壤固氮微生物群落结构[32-33]。此外,由于较高的生物量,耐铝植物吸收更多的根际养分,从而形成与铝敏感植物不同的根际环境。在本研究中,耐铝玉米先玉335根际土壤表现出更低的土壤pH、铵态氮和速效钾含量 (表2)。这些土壤理化因子被报道是影响固氮微生物群落组成的重要因素[34-35]。而且,在酸性土壤中耐铝植物生长越旺盛,根系分泌物越多,越有利于根际固氮微生物物种的特异性生长。这些因素可能引起根际固氮微生物群落组成的变化。然而,由于根部和叶际环境对微生物的选择性定殖作用,形成特异的固氮微生物群落结构,进而可能降低了植物耐铝性在这些部位引起的群落结构差异。
不同玉米部位由不同的优势固氮菌组成,这些物种相对丰度的差异直接贡献于群落结构的变化 (表3)。本研究与Rösch等[36]报道的结果一致,变形菌门固氮菌在酸性土壤中占优势。本研究中,根际土壤和根部的优势菌属是慢生根瘤菌属 (Bradyrhizobium),而叶部中的优势菌属是细鞘丝藻属 (Leptolyngbya),说明不同部位优势物种的差异较大。慢生根瘤菌属在酸性土壤中有很高的存活能力[33,37],因为该菌属能更好的忍耐和适应酸性条件[38]。此外,慢生根瘤菌属不仅是共生固氮菌,也是一种非共生固氮菌[35],而且在一些研究中也发现行使植物促生功能[39]。细鞘丝藻属属于蓝藻门,该门类的微生物一般是水生环境中的优势固氮菌群,但在一些叶际固氮菌中也常被发现[31]。蓝藻门在江西红壤中普遍存在[40],这与我们的研究结果一致。
4 结论
酸性红壤上,固氮微生物丰度、多样性和群落组成在玉米不同部位间的差异大于品种间的差异。玉米根部表现出更高的固氮微生物丰度,而固氮菌多样性指数在根际土壤中最高。叶部与根部和根际土壤的固氮菌群落组成差异更大,而且有最低的固氮菌丰度和多样性指数。不同玉米部位固氮菌群落组成差异主要体现在富集的优势菌属明显不同。
——固氮微生物

