CHO细胞Kcmf1基因内定点整合ZsGreen1报告基因的表达稳定性研究
杨 蕾,丁学峰,蔡燕飞,陈 蕴,龚笑海,段作营,李华钟,金 坚*
(1.江南大学 生物工程学院,江苏 无锡214122;2.江南大学 药学院,江苏 无锡214122)
中国仓鼠卵巢(Chinese hamster ovary,CHO)细胞作为生物技术药物生产细胞的优势地位已经明确,且构建适于稳定生产治疗性生物制品的CHO工程细胞系一直是研究工作的热点[1-2]。经典的CHO工程细胞系构建均是采用目的基因随机整合,多轮单克隆筛选,挑选相对稳定表达目的蛋白细胞株的方法[3-4]。带来的麻烦是构建工作费时费力,更重要的是无法知晓高、低表达目的蛋白的原因。随着主细胞库到生产细胞库的放大和生产过程传代,目的蛋白的表达量极易变化,丢失了目的蛋白表达的非生产性细胞克隆持续增加,难以达到生产和监管的要求。构建定点整合的稳定表达外源基因的CHO工程细胞系是理论上解决这些问题的有效方法。CHO细胞的一、二和三代基因测序结果均已相继公布,相关品系的CHO细胞染色体变异很大。对已保有的各种生产治疗性生物制品的高、低表达CHO细胞株,结合其整合位点和临近区域的结构分析,还未有成功地将CHO细胞的稳定高表达整合位点用于建立生产型CHO工程细胞系的报道[5-7]。
作者前期以CHO-K1为出发细胞株,组合应用慢病毒示踪报告基因技术和染色体步移技术,寻找到了可以持续表达绿色荧光标签的基因组内位点。测序结果明确了该整合位点为NW_003614172.1第629890碱基处,位于钾通道调节因子1(potassium channel modulatory factor 1,Kcmf1)基因内部的一段非编码区域。该基因编码锌指蛋白,参与钾通道的调节[8-9]。以此为基础,构建和单克隆化了以Kcmf1基因NW_003614172.1第629890碱基处定点整合ZsGreen1报告基因的CHO-K1细胞(2C3),对其作为工程细胞的稳定性开展了系统评价。
1 材料与方法
1.1 材料
1.1.1 细胞株 中国仓鼠卵巢细胞亚株CHO-K1,购自美国ATCC公司;2C3细胞,为染色体NW_003614172.1内第629890号碱基处整合了ZsGreen1基因的CHO-K1细胞株,由作者所在课题组构建和保存[9]。
1.1.2 主要试剂 Ham's F-12K培养基、胎牛血清:美国Gibco公司产品;M2、M4无血清基础培养基:苏州康聚生物技术公司产品;PCR试剂:南京诺唯赞生物科技有限公司产品;TRIzol试剂:美仑生物公司产品;反转录试剂盒、SYBR®Green Master Mix:Takara公司产品;DEPC水、基因组DNA小量抽提试剂盒:上海碧云天生物技术有限公司产品;其他试剂均为国产分析纯。实验中所用引物序列见表1。
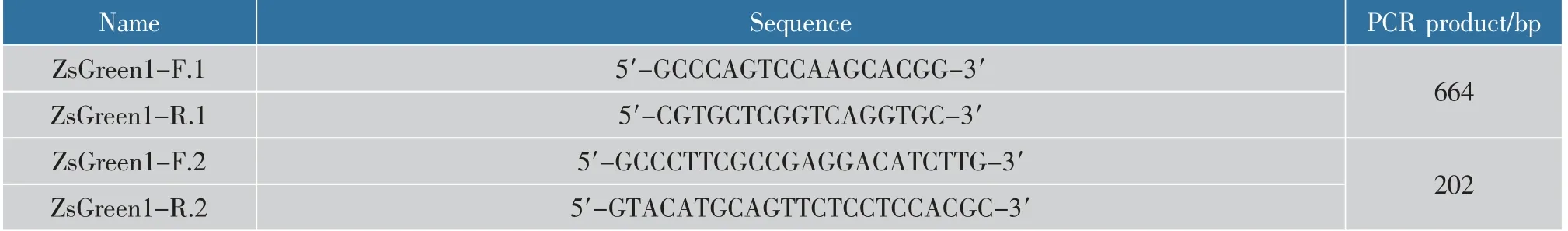
表1 PCR引物列表Table 1 List of PCR primers
1.1.3 仪器与设备 细胞培养箱SeriesⅡWater Jacket、NANODROP 2000:美国Thermo Fisher公司产品;倒置荧光显微镜、倒置式生物显微镜TE2000-S:日本NIKON公司产品;流式细胞仪、流式分选仪BD FACSAriaIII:美国BD公司产品;酶标仪infinite M200 PRO、凝胶成像系统Tanon-5200Multi:上海天能公司产品;核酸电泳仪Mini-Protean、PCR仪C1000和Q-PCR仪CFX96:美国伯乐公司产品。
1.2 方法
1.2.1 细胞培养 CHO-K1细胞和2C3细胞在完全培养基(Ham's F-12K+体积分数10%FBS)内连续贴壁传代培养,培养条件为37℃,体积分数5%CO2。
先后采用了两种方法对2C3细胞进行悬浮驯化:第一种是使用无血清基础培养基M2+M4(体积比为1∶1)直接替换完全培养基来培养细胞,第二种是使用无血清基础培养基M2+M4(体积比为1∶1)逐步取代完全培养基,使培养基中血清的最终体积分数也逐步递减,梯度为10%、8%、6%、4%、2%、1%、0.5%、0%,每个梯度连续传代培养2~3次,当细胞生长状态良好时减为另一梯度。
细胞驯化成功后,在150 mL摇瓶中使用无血清基础培养基M2+M4(体积比为1∶1)悬浮传代培养,培养基为30 mL,恒温摇床上的培养条件为110 r/min、37℃、体积分数5%CO2。每天取样计数,调整细胞接种密度为1.0×106个/mL。
1.2.2 MTT法检测2C3贴壁细胞的倍增时间 将T75培养瓶中的培养细胞用胰蛋白酶消化后计数,用新鲜的完全培养基将细胞稀释至1×104个/mL,吹打混匀后按每孔2 500个细胞接种到96孔板中,5个重复孔,共接种10块相同的96孔板,置于恒温培养箱中培养过夜。第二天,取出一块96孔板,避光加入MTT,每孔10μL,4小时后加入MTT Buffer,每孔100μL,过夜反应后用酶标仪测取560 nm波长下的吸光值。之后9天内,在每天相同时间点取一块板重复上述操作,依据测得的吸光值绘制出细胞的生长曲线。
1.2.3 倒置荧光显微镜观察ZsGreen1蛋白表达情况 贴壁细胞每分裂倍增10次,细胞汇合度达50%~60%时,倒置荧光显微镜观察ZsGreen1蛋白表达情况,随机选择镜下视野进行明场和荧光场拍摄。每次拍摄条件一致,AECompensation为+0.0 EV,Exposure Time为1 s,Gain为4×,Contrast为Linear,荧光场照片采用ImageJ软件分析细胞的平均荧光强度。
按血清终浓度递减的方法悬浮驯化的细胞(2C3-M2M4+体积分数0%FBS),每次降低血清含量时观察ZsGreen1蛋白表达情况;直接使用无血清基础培养基培养的细胞(2C3-M2M4),待细胞转至摇瓶培养时初次观察。驯化成功后的悬浮2C3细胞,每分裂倍增10次进行观察,拍摄条件及分析方法与贴壁细胞相同。
1.2.4 流式细胞分析仪检测细胞平均荧光强度贴壁细胞每分裂倍增10次后取出部分细胞进行冻存,储存于液氮罐中。在细胞总倍增次数达到50次时,同时复苏之前冻存的所有不同代次的细胞,传代培养至细胞生长状态良好,使用流式细胞分析仪检测细胞的平均荧光强度,检测结果使用FlowJo 7.6.2软件进行分析。
悬浮细胞在驯化成功后每分裂倍增10次进行流式分析,检测时和贴壁细胞使用同一条件,数据分析方法相同。
1.2.5 流式细胞分选仪分选悬浮细胞池 分析悬浮驯化成功的2C3细胞池,发现细胞池中的细胞表达ZsGreen1蛋白的荧光强度有一定的差异。以未插入外源基因的CHO-K1细胞为阴性对照,收集10 000个细胞测定对照组细胞荧光强度,确定103为阴、阳性细胞分界线:单细胞FITC-A荧光强度低于103时为阴性细胞,高于103时为阳性细胞。流式细胞分选仪对2C3细胞池进行分选,收集阴性细胞1.2×106个,分成四组分别培养在M2M4、M2M4+10%FBS、Ham's F-12K、Ham's F-12K+10%FBS四种培养基中(M2∶M4体积比为1∶1);收集荧光强度值最高的10%阳性细胞3×105个,使用无血清基础培养基扩培。
1.2.6 2C3细胞中ZsGreen1基因的分析 使用基因组DNA小量抽提试剂盒,分别提取在无血清基础培养基里扩培后的阴性、阳性细胞的基因组,使用表1中ZsGreen1-F.1和ZsGreen1-R.1引物进行PCR扩增,反应体系为:2×Phanta®Max Buffer 12.5μL,dNTPMix 0.5μL,ZsGreen1-F.1(10μmol/L)1μL,ZsGreen1-R.1(10μmol/L)1μL,Phanta®Max Super-Fidelity DNA Polymerase 0.5μL,DNA 100 ng,ddH2O补足25μL。扩增条件为:95℃预变性3 min;95℃变性15 s,58℃退火15 s,72℃延伸45 s,30个循环;72℃延伸5 min,4℃保存。PCR产物进行琼脂糖凝胶电泳检测并测序。
1.2.7 2C3细胞中ZsGreen1基因转录水平分析分别提取在M2M4、M2M4+10%FBS、Ham′s F-12K、Ham′s F-12K+10%FBS四种不同培养基中扩培的阴性细胞的RNA,将其反转录成cDNA,反转录体系 为:5×PrimeScript RTMaster Mix(Perfect Real Time)4μL,Total RNA 1μg,RNase Free dH2O补足20μL。轻柔混匀后使用PCR仪进行反转录反应,反应条件为:37℃,15 min;85℃,5 s;降温至4℃,于-20℃长期保存。反转录得到的cDNA产物进行Q-PCR,反应体系为:SYBR®Premix Ex TaqTMⅡ(2×)10μL,ZsGreen1-F.2 (10μmol/L)1μL,ZsGreen1-R.2(10μmol/L)1μL,cDNA 10 ng,ddH2O补足20μL。反应条件为:95℃预变性30 s;95℃变性5 s,60℃延伸30 s,40个循环;溶解曲线为65℃反应5 s,95℃反应60 s。
2 结果与分析
2.1 2C3细胞倍增时间检测结果
用MTT法检测560 nm波长下的吸光值,绘制出的细胞生长曲线见图1。CHO细胞一般20~24 h分裂一次,定点整合ZsGreen1报告基因的CHO-K1细胞(2C3)的倍增时间与CHO-K1细胞大体一致,分裂倍增时间按24 h计,即每1天细胞发生1次倍增,记做细胞传代1次。
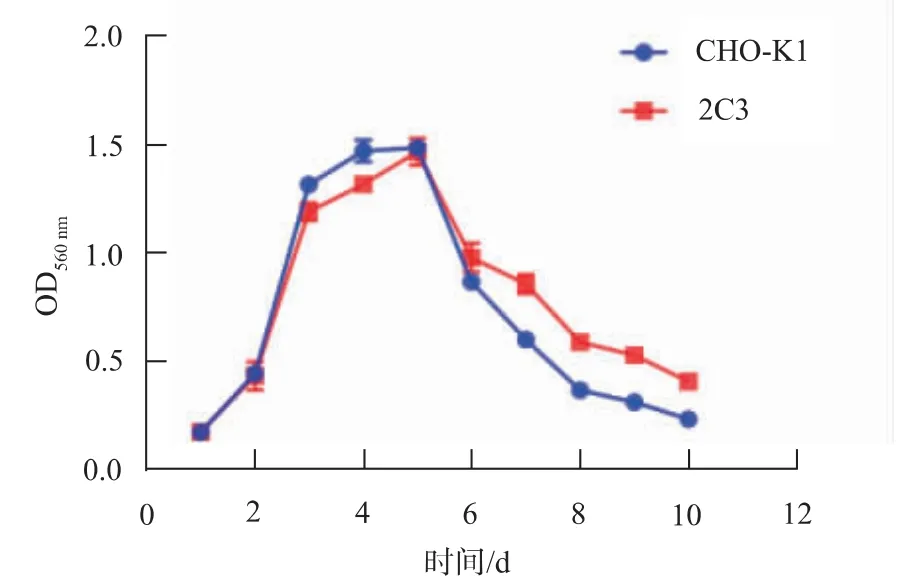
图1 2C3细胞生长速率Fig.1 Growth rate of 2C3 cells
2.2 贴壁培养的2C3细胞表达ZsGreen1蛋白情况
为了验证位点NW_003614172.1表达外源基因的稳定性,作者持续观察2C3细胞连续贴壁传代培养过程中ZsGreen1蛋白的表达情况。前期对此细胞已进行了20代传代实验,发现荧光蛋白可以持续表达[10]。基于从生产细胞库扩增到大生产罐需要45~50代次的实际状态,本实验设计以传至20代的2C3细胞为初始细胞,连续传代50次为实验终点,观察目的基因的表达情况,进行稳定性评估。具体实验为,每传10个代次,用倒置荧光镜观察并拍照记录,见图2(a),荧光场照片使用ImageJ软件分析细胞的平均荧光强度,见图2(b)。同时,传代过程中每传代10次进行一次细胞冻存,在连续传代50次后,复苏之前冻存的不同代次的细胞,使用流式细胞仪进一步对荧光蛋白的表达情况进行定量分析,见图2(c)、(d)。倒置荧光显微镜的观察结果和流式细胞仪分析结果皆显示,在连续贴壁传代培养50代的过程中,100%的2C3细胞可以稳定表达ZsGreen1报告基因。
2.3 悬浮培养的2C3细胞表达ZsGreen1蛋白情况
治疗性生物制品的原料药生产基本采用悬浮细胞大规模生产,所以在验证了贴壁培养的2C3细胞表达ZsGreen1蛋白的稳定性后,对其进行了悬浮驯化。先采用无血清基础培养基直接替换完全培养基的方法驯化2C3细胞。当细胞生长状态良好,大小均一,数量能隔天翻倍时,认为其驯化成功,开始进行无血清基础培养基悬浮传代培养。倒置荧光显微镜观察发现,细胞表达ZsGreen1蛋白荧光强度较培养基中含血清时有明显差异,细胞平均荧光强度降低。为了判断此现象是否因直接更换培养基引起的细胞不适应导致,作者采用了第二种悬浮驯化方法,使培养基中血清终浓度逐步递减,但是驯化成功后观察到了同样的实验结果:细胞平均荧光强度较培养基中含血清时有明显差异。
对两种方法驯化成功的细胞连续悬浮传代培养30、60 d后,倒置荧光显微镜均观察到细胞平均荧光强度有所提高,见图3,同时使用流式细胞仪对不同代次的悬浮细胞表达荧光蛋白的情况进行检测,使用FlowJo 7.6.2软件分析检测结果,见图4。以CHO-K1细胞为对照,通过连续传代培养后,表达荧光蛋白的细胞数目增多,阳性细胞比例有了12%~15%的提升。
与此同时,作者发现当悬浮培养使用的无血清基础培养基中加入体积分数10%血清后,悬浮细胞池中表达荧光蛋白的细胞比例明显提升,95%以上的细胞能够表达ZsGreen1报告基因,见图5。
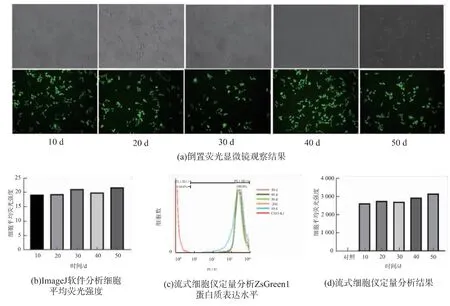
图2 贴壁传代培养的2C3细胞表达ZsGreen1蛋白情况Fig.2 Expression of ZsGreen1 protein by adherently subcultured 2C3 cells
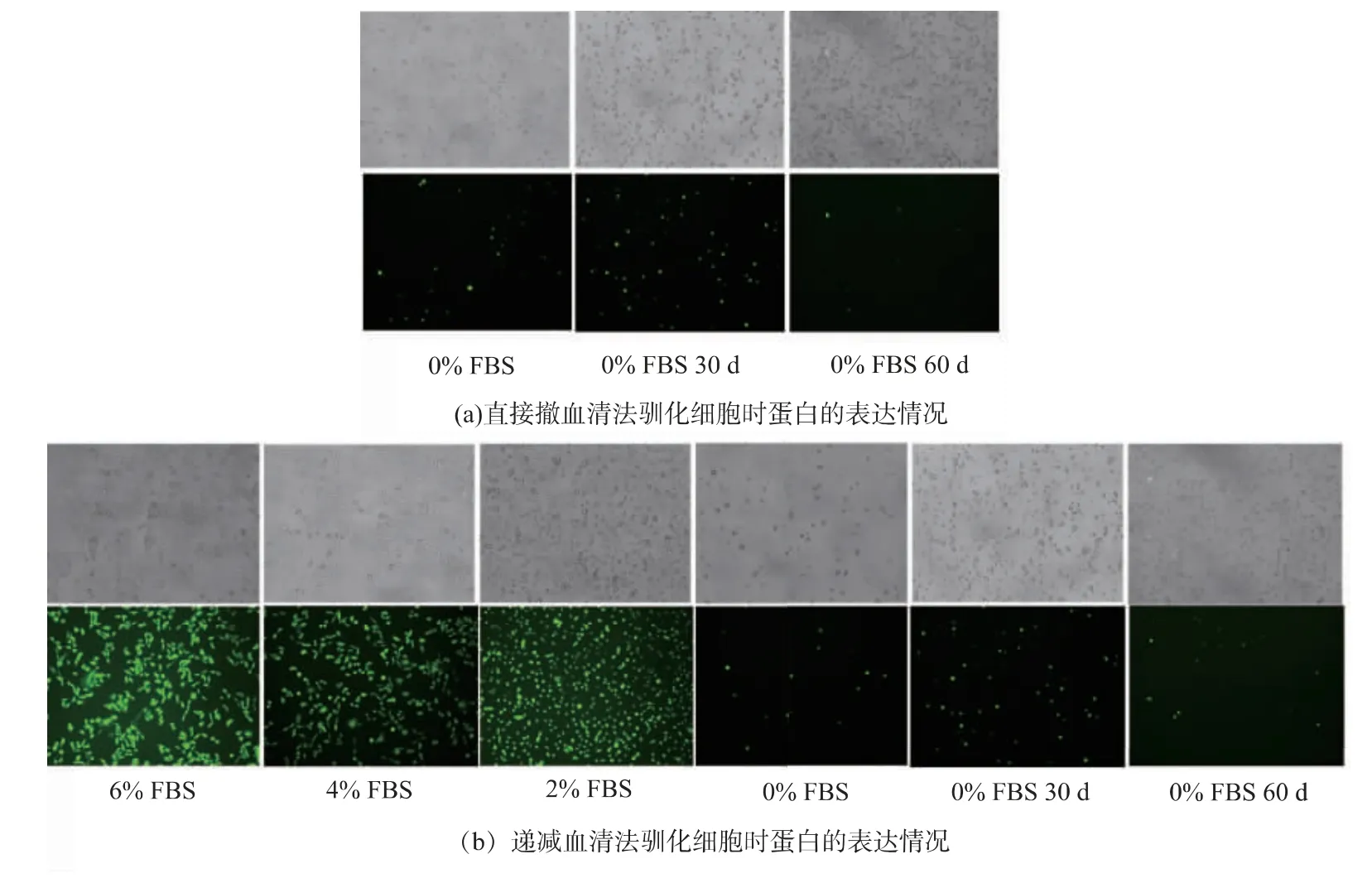
图3 悬浮传代培养的2C3细胞表达ZsGreen1蛋白情况Fig.3 Expression of ZsGreen1 protein in suspension-cultured 2C3 cells
2.4 ZsGreen1蛋白的DNA水平验证
为了确认流式分析仪检测到的阴性细胞是否在细胞分裂过程中丢失了ZsGreen1基因,采用流式细胞术从直接更换培养基的方法中驯化成功的2C3细胞分选细胞,以未插入外源基因的CHO-K1为对照,以FITC-A荧光强度值103为阴性和阳性细胞的分界,分别收集细胞,见图6。
以分别回收的1.50×106个荧光蛋白表达阴性和阳性细胞为材料,分别提取基因组,PCR扩增ZsGreen1基因,琼脂糖凝胶电泳验证扩增结果见图7,测序结果见表2。结果显示,阴性和阳性细胞群基因组内均含有ZsGreen1基因,说明蛋白表达的差异是细胞从贴壁培养到适应悬浮培养的过程中受到影响的结果。
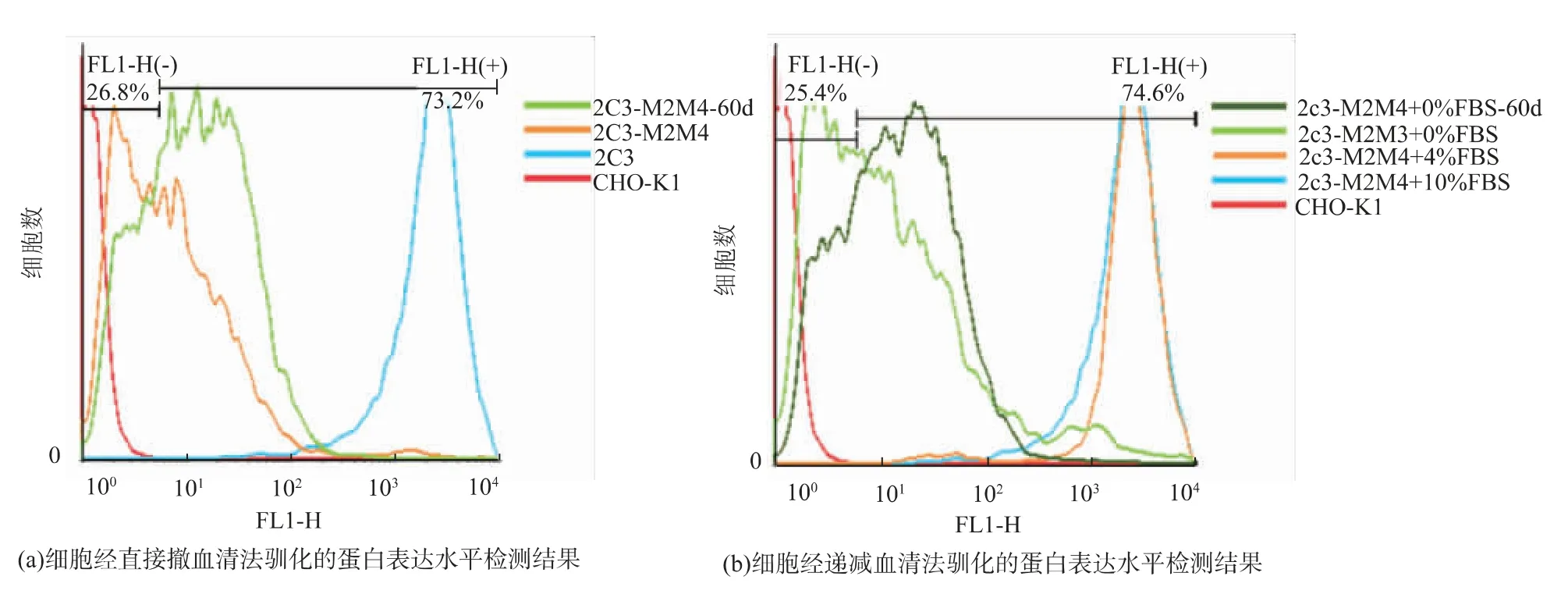
图4 流式细胞仪分析2C3细胞表达荧光蛋白情况Fig.4 Flow cytometry analysis of the expression of fluorescent protein in 2C3 cells
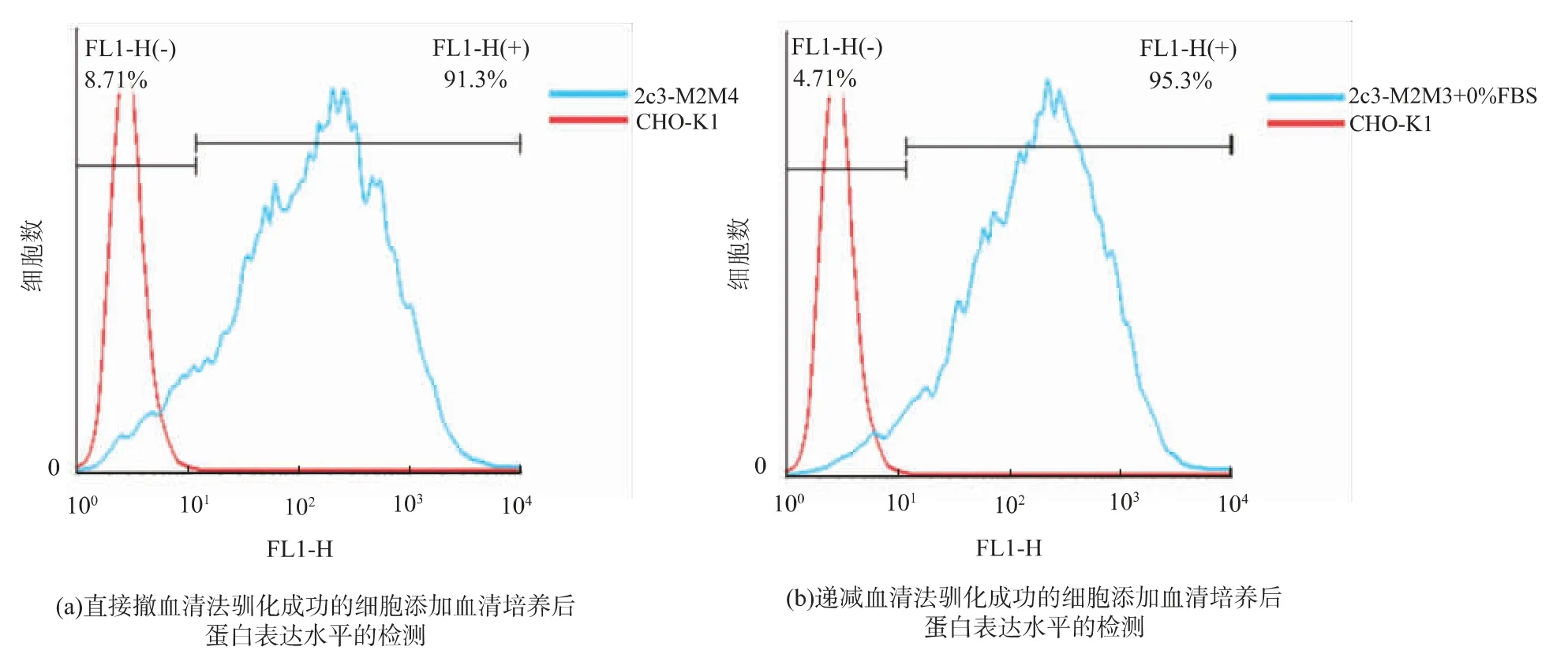
图5 无血清基础培养基中添加体积分数10%胎牛血清后2C3细胞表达ZsGreen1蛋白的情况Fig.5 Expression of ZsGreen1 protein in 2C3 cells supplemented with 10%FBSin serum-free basal medium
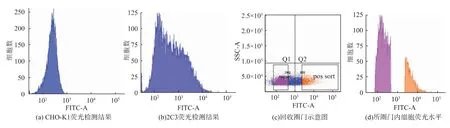
图6 流式分选仪分选2C3细胞示意图Fig.6 Schematic diagram of sorting 2C3 cells by flow sorter
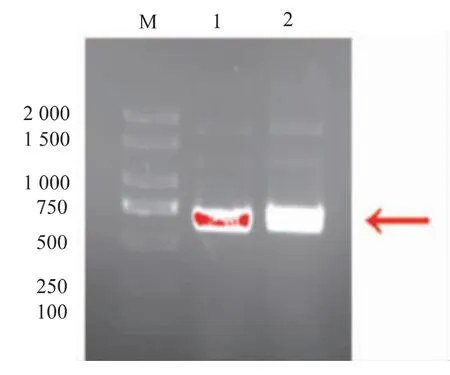
图7 2C3细胞流式分选后阴性细胞池ZsGreen1基因验证Fig.7 Verification of the ZsGreen1 gene in the negative cell pool after 2C3 cell flow sorting
为了验证上文提到的血清的作用,将回收的阴性细胞以3×105个/孔接种在六孔板内,使用M2M4、M2M4+10%FBS、F-12K+10%FBS三种培养基培养。扩培至T75培养瓶后,待细胞生长状态良好,进行流式细胞仪分析,结果见图8。培养基中加入血清后,有50%左右的阴性细胞转变为阳性细胞。以上结果都可以证明,在对2C3细胞悬浮培养的过程中,ZsGreen1基因并没有因细胞分裂、生长而丢失,通过优化悬浮驯化的培养基和培育条件,有望提高目的蛋白的表达量。

表2 2C3阴性细胞PCR扩增后片段测序结果Table 2 Fragment sequencing results of PCR amplification of 2C3 negative cells

图8 血清影响阴性2C3细胞表达ZsGreen1蛋白的验证Fig.8 Effect of serum on the ZsGreen1 protein expression in the negative 2C3 cells
2.5 ZsGreen1基因的转录水平验证
作者推测血清可能在转录水平上影响了蛋白表达,所以提取了在培养基M2M4、M2M4+10%FBS和F-12K+10%FBS中扩培的3组阴性细胞以及M2M4培养的阳性细胞的RNA,反转录成cDNA后,进行了Q-PCR实验,以GAPDH为内参。已经适应悬浮培养的细胞在F-12K+10%FBS培养基中培养后,mRNA含量稍高于对照组,而在培养基M2M4中加入血清后,ZsGreen1蛋白的mRNA含量明显提高,也稍高于同时收集的阳性细胞,见图9。
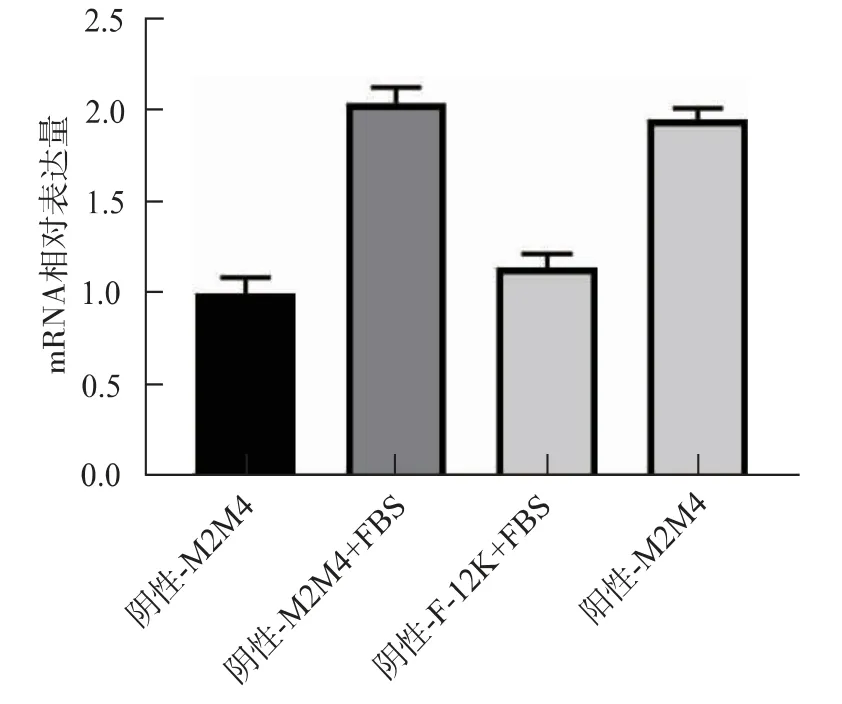
图9 不同培养基培养下2C3细胞内ZsGreen1的mRNA表达量的变化Fig.9 ZsGreen1 mRNA content in 2C3 cells cultured in different culture media
3 结语
应用定点整合的方法构建CHO工程细胞系,可以快速将外源基因插入宿主细胞基因组的特定位置,从而避免传统的随机整合方法带来的耗时费力、“位置效应”等问题。为了能挑选出相对稳定、高表达目的蛋白的细胞株,初始整合位点的选择尤其重要。
前期作者应用慢病毒示踪报告基因技术以及染色体步移技术,在CHO-K1细胞株中,寻找到了可以持续表达绿色荧光标签ZsGreen1的基因组内位点,测序结果明确了该整合位点为Kcmf1基因NW_003614172.1第629890碱基处[9]。本实验中主要使用倒置荧光显微镜和流式细胞术,以细胞荧光强度为指标,定量分析ZsGreen1报告基因的表达情况。通过对2C3细胞以贴壁和悬浮两种不同的培养条件传代培养,可以确定NW_003614172.1第629890碱基处可作为整合位点用于外源基因的稳定表达。
在实际工业生产过程中,生产细胞库扩增到大生产罐需要45~50代次,所以本研究中的稳定性评价以连续传代50次为实验终点,观察目的基因的表达情况。2C3细胞贴壁培养连续传代50代次,100%的细胞可以稳定表达ZsGreen1报告基因。无血清悬浮驯化培养2C3细胞时,倒置荧光显微镜观察到细胞平均荧光强度明显降低,但连续悬浮传代培养60代次,荧光细胞数目显著增多。在悬浮培养基中添加体积分数10%FBS后,悬浮培养的细胞池中ZsGreen1阳性细胞比例上升到95%以上。流式细胞术分选细胞池中高、低表达ZsGreen1蛋白的2C3细胞,可以确定细胞分裂生长过程中没有丢失ZsGreen1基因,培养环境的改变影响了基因表达水平,猜测细胞在营养匮乏时优先表达必需基因,关闭了非必需基因的表达以满足生长需求,当营养充足时重新开启。通过优化培养基和培养条件,比如在悬浮培养基中添加血小板裂解液、植物水解素等增加培养基的营养,有望提高目的蛋白质的表达量。无血清基础培养基直接替换完全培养基和无血清基础培养基逐步取代完全培养基这两种不同的悬浮驯化方法,不会造成细胞生长和外源蛋白表达的明显差异,推荐使用直接替换的驯化方法更能缩短驯化时间。
目前,作者以CHO-K1为出发细胞株,使用CRISPR/Cas9介导的定点整合技术,在该位点成功敲入了生物药市场上有代表性的3种治疗性蛋白质基因:人血清白蛋白(HSA,68 000)的基因、胰高血糖素样肽-1突变双联体-人血清白蛋白(HSANGG,75 000)的基因和靶向VEGF人源化抗体(VEGF-hAb,150 000)轻重链的基因[10-11],在连续的贴壁和悬浮传代培养中,细胞均可以表达对应蛋白质,进一步验证了该位点的适用度。综上,Kcmf1基因NW_003614172.1第629890碱基处可作为整合位点成为研究人员构建CHO工程细胞株的可靠选择。

