竞争性酶联适配体可视化检测玉米赤霉烯酮
韦丽婷,谭贵良,乐 琳,吴世嘉,王周平*
(1.食品科学与技术国家重点实验室,江南大学,江苏 无锡214122;2.江南大学 食品学院,江苏 无锡214122;3.中山市食品药品检验所,广东 中山528437)
玉米赤霉烯酮(zearalenone,ZEN),又称为F2毒素,是由镰刀菌属的禾谷镰刀菌、三线镰刀菌等产生的一种非甾体雌激素样作用的真菌毒素[1],其主要污染玉米、小麦、大米、高粱等谷物及其制品[2-4]。ZEN具有较高的耐热性,110℃条件下处理1 h才会被完全破坏,因此在食品或饲料加工过程中不易去除,对人体和动物健康带来极大的危害[5]。ZEN具有较强的生殖毒性、神经毒性和致癌性[6-8],可与雌激素受体结合引起动物发生雌激素亢进症,导致动物不孕或流产,给畜牧业经济造成巨大的经济损失[9]。ZEN被国际癌症研究机构IARC分类为第3组致癌物质,其毒性仅次于黄曲霉毒素[10-11]。为了减少ZEN对人类和动物的危害,多个国家已对食品和饲料中的ZEN制定了限量标准,欧盟规定了谷物和玉米中ZEN的含量分别不能超过0.1 mg/kg和0.35 mg/kg。澳大利亚规定谷物中ZEN的含量不能超过50μg/kg,我国《GB2761-2011食品中真菌毒素限量》标准规定玉米、小麦及其制品中ZEN的含量不得超过60μg/kg,《GB 13078.2-2006饲料中赭曲霉毒素A和玉米赤霉烯酮的允许量》规定配合饲料、玉米中ZEN的安全限量为500μg/kg。
目前,用于检测食品和饲料中ZEN含量的方法主要有薄层色谱法(TLC)[12]、气相色谱-质谱联用(GC-MS)[13]、高效液相色谱法(HPLC)[14]、液相色谱-质谱联用(LC-MS)[15]和酶联免疫法(ELISA)[16]。这些方法各有其优缺点,如操作复杂、需要昂贵的仪器和专业的操作人员、稳定性差等问题。酶联免疫法灵敏度高、特异性好,但小分子半抗原的抗体制备过程非常复杂,需要进行动物免疫实验,且研发周期较长。因此,研发一种新型的生物识别分子,用于检测玉米赤霉烯酮具有重要的意义。
核酸适配体是经SELEX(systematic evolution of ligands by exponential enrichment,指数富集的配体系统进化)技术体外筛选获得的一段具有特定复杂三维构象、可与靶标特异性结合的寡核苷酸片段[17-18]。与抗体相比,适配体具有易人工合成和修饰、靶物质范围广、稳定性好、分子量小和易保存等优点。目前,利用适配体作为识别分子主要应用于医学、生命科学和生物分析科学等领域,基于适配体的分析检测研究主要集中在荧光检测法、生物传感器和电化学传感器[19-21],在食品中小分子危害物质检测方面的报道不多。作者通过HRP标记适配体互补链形成信号探针,与靶标竞争结合适配体,建立一种可视化快速检测玉米赤霉烯酮的方法。
1 材料与方法
1.1 试剂和仪器
1.1.1 试剂 玉米赤霉烯酮(ZEN)、黄曲霉毒素B1(AFB1)、伏马毒素B1(FB1)、呕吐毒素(DON)和赭曲霉毒素A(OTA)标准品与链霉亲和素购于Sigma-Aldrich;牛血清白蛋白 (BSA)、氯化钠(NaCl)、磷酸氢二钠(Na2HPO4·12H2O)、磷酸氢二钾(K2HPO4)、碳酸钠(Na2CO3)、碳酸氢钠(NaHCO3)、氯化钾(KCl)、浓硫酸、吐温-20等均购买于国药集团化学试剂有限公司,均为分析纯;辣根过氧化物酶标记链霉亲和素(Streptavidin-HRP)、3,3′,5,5′-四甲基联苯胺(TMB)显色液、ZEN适配体5′bio-TCA TCT ATC TAT GGT ACA TTA CTA TCT GTA ATG TGA TAT G-3′和ZEN适配体互补链(cDNA)5′bio-AGT AGA TAG ATA CCA TGT AAT GAT AGA CAT TAC ACT ATA C-3′均购于生工生物工程(上海)有限公司。
1.1.2 仪器 AR224CN电子天平:奥豪斯仪器(中国)有限公司产品;Starter 3C实验室pH计:奥豪斯仪器(中国)有限公司产品;Direct-Q3超纯水制备仪:美国Millipore公司产品;96孔酶标板:美国Corning公司产品;Synergy H1全功能酶标仪:美国伯腾仪器有限公司产品。
1.2 实验方法
1.2.1 cDNA-HRP信号探针的合成 用PBS缓冲液(10 mmol/L,pH 7.4)将1 mg/mL链霉亲和素修饰的HRP进行稀释,取996μL HRP稀释液与8μL 10μmol/L生物素修饰的cDNA混合,在10℃条件下孵育3 h,即可得到cDNA-HRP信号探针,并于-20℃下保存。
1.2.2 链霉亲和素包被酶标板 用碳酸盐缓冲液(10 mmol/L,pH 9.6)将其上的链霉亲和素进行稀释,每孔加入200μL,置于4℃冰箱中过夜,然后将酶标板内的液体甩干,再用PBST洗涤缓冲液(1×PBS缓冲液+体积分数0.05%吐温-20)清洗3次,每次1 min,在滤纸上拍干,为了防止实验中发生非特异吸附,加入200μL的BSA封闭液对未完全被链霉亲和素包被的酶标板进行封闭,37℃条件下孵育1 h,用PBST洗涤缓冲液清洗3次,每次1 min,轻轻拍干。
1.2.3 竞争性酶联适配体检测ZEN 在链霉亲和素包被的酶标板中加入10μL生物素标记的ZEN适配体,37℃条件下孵育30 min,拍干,用PBST缓冲洗涤液洗板3次,每次1 min,轻轻拍干。将100μL待测样品加到酶标板中,同时加入100μL cDNAHRP信号探针,混合均匀,25℃条件下孵育1 h,然后将酶标板拍干,再用PBST洗涤缓冲液洗板3次,每次1 min,轻轻拍干。最后在每孔中加入100μL TMB显色液,室温放置20 min后,加入100μL的体积分数2%H2SO4终止液,用酶标仪测定在450 nm波长处溶液的吸光度值。
1.2.4 特异性实验 为验证实验方法的特异性,应用该实验建立的检测方法对ZEN、FB1、DON、AFB1、OTA标准液和空白样品同时进行检测,实验中ZEN的质量浓度为100 ng/mL,其他对照毒素质量浓度为ZEN的10倍。用酶标仪测定在450 nm波长处溶液的吸光度值,通过比较450 nm处的吸光度值大小和溶液颜色深浅来评价本实验的特异性。
1.2.5 实际样品加标回收测定 为验证基于竞争性酶联适配体检测玉米赤霉烯酮在实际应用中的可行性,用本地超市的啤酒和玉米样品进行加标回收实验。样品制备如下:将啤酒样品置于4℃冰箱中30 min,再超声30 min直至完全脱气,将20 g溶解在50 mL体积分数70%甲醇中,取10 mL溶液加入40 mL超纯水中稀释,随后用0.22μm过滤膜过滤。同样,将20 g粉碎的玉米溶于50 mL体积分数70%甲醇,高速搅拌2 min,用定量滤纸过滤,然后将10 mL滤液转移到40 mL超纯水中稀释,随后用0.22μm过滤膜过滤。然后在啤酒和玉米样品中加入ZEN标准溶液,加标啤酒和玉米样品的质量浓度分别为0.70、1.40、7.00 ng/mL。取100μL不同浓度的加标样品用本实验方法检测,另外取100μL不同浓度的加标样品用购买的玉米赤霉烯酮酶联免疫试剂盒检测,对两种方法的检测结果进行分析和比较,以验证实验所建立的检测方法的准确性和稳定性。
2 结果与讨论
2.1 检测原理
将生物素标记的ZEN适配体固定在链霉亲和素包被的微孔板上,适配体互补链cDNA与辣根过氧化物酶连接形成cDNA-HRP复合物作为信号探针,cDNA-HRP复合物和靶标竞争与适配体结合,加入TMB底物显色液,在HRP的作用下,TMB被氧化为蓝色,加入酸终止液后,溶液变为黄色。靶标浓度与溶液颜色深浅呈反比,通过测定溶液在450 nm处的吸光度值和观察溶液颜色的深浅变化,即可实现对待测样品中ZEN的可视化检测。检测原理见图1。
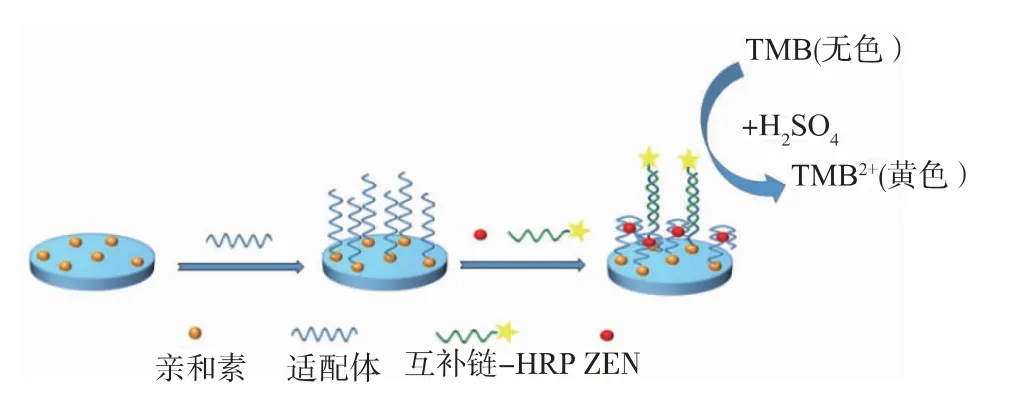
图1 基于竞争性酶联适配体可视化检测玉米赤霉烯酮的原理图Fig.1 Schematic illustration of the visual detection of zearalenone based on competitive emzyme-linked aptamer assay
2.2 实验条件的优化
2.2.1 链霉亲和素包被浓度的优化 生物素标记的ZEN适配体通过生物素-亲和素的连接固定于微孔板上,因此链霉亲和素的包被量对检测灵敏度有很大的影响。选取6个不同质量浓度的链霉亲和素(5、10、15、20、25、30μg/mL)包被微孔板进行实验。从图2(a)可知,随着链霉亲和素质量浓度的增加,溶液的吸光度值A450nm也不断增大,当链霉亲和素质量浓度达到20μg/mL后,A450nm值不再随着质量浓度的增加而增大,而是趋于平缓,说明包被微孔板的链霉亲和素的量达到了饱和状态。因此,选取20μg/mL链霉亲和素为最佳包被质量浓度。
2.2.2 BSA封闭液浓度的优化 为防止实验过程中发生非特异性吸附而影响检测结果,在链霉亲和素包被微孔板后加入BSA封闭液进行封闭,BSA封闭液浓度低会产生非特异性吸附,而浓度高也会降低检测灵敏度。因此,选取7个不同质量浓度的BSA封闭液(0、5、10、15、20、25、30 mg/mL)进行优化,在空白样品条件下测定溶液在450 nm处的吸光度值。从图2(b)可知,随着BSA质量浓度的增大,A450nm值逐渐降低,表明微孔板底面的非特异性吸附不断减少,当BSA质量浓度达到20 mg/mL后,A450nm值逐渐趋于平稳不再下降,说明BSA已将微孔板底部未被链霉亲和素包被的部分全部封闭。因此,BSA封闭液的最佳质量浓度为20 mg/mL。
2.2.3 适配体浓度的优化 生物素标记的ZEN适配体作为捕获探针,能够特异性识别和捕获靶标分子,并且能与cDNA-HRP信号探针互补杂交,从而实现待测样品中ZEN的检测,因此,适配体的浓度对实验结果有较大影响。实验选取6个不同浓度的ZEN适配体(100、200、300、400、500、600 nmol/L)进行空白样品的检测。从图2(c)可知,随着适配体浓度的增加,吸光度值A450nm也逐渐增大,当适配体浓度达到200 nmol/L后,A450nm值趋于平缓不再增大,表明适配体浓度已经达到饱和状态。根据实验结果,选择200 nmol/L为最佳适配体浓度。
2.2.4 HRP稀释倍数的优化 cDNA-HRP复合物作为实验中的信号探针,HRP能够将底物分子TMB催化氧化产生蓝色反应产物,HRP的浓度可影响ZEN的可视化检测的灵敏度。同时检测含靶标样品(ZEN质量浓度为1 000 ng/mL)和空白样品,当两者吸光度差值最大时,即溶液颜色的区分度最大,所对应的HRP稀释倍数为最佳稀释倍数。选取7个不同稀释倍数的HRP(100、500、1 000、1 500、2 000、2 500、3 000倍),同时检测含靶标样品和空白样品。从图2(d)可知,空白样品的吸光度比含靶标样品的信号强度高,随着HRP稀释倍数的增大,溶液的信号强度也逐渐降低,当HRP稀释倍数为500倍时,含靶标样品与空白样品在450 nm处的吸光度差值最大,达到了最佳的比色效果,因此,最佳的HRP稀释倍数为500倍。

图2 实验条件的优化Fig.2 Optimization of experimental conditions
2.3 标准曲线测定
在最佳实验条件下,采用竞争性酶联适配体检测不同浓度的ZEN,ZEN的系列标准质量浓度为1、10、100、1 000、10 000 ng/mL,以ZEN质量浓度的对数值为横坐标,溶液吸光度值A450nm为纵坐标,绘制标准曲线。从图3可知,ZEN质量浓度在1~10 000 ng/mL范围内具有良好的线性关系,检测限(3N/S,N为空白样品信号的标准偏差,S为标准曲线的斜率)为0.7 ng/mL。与欧盟、澳大利亚和我国国家标准规定的食品中ZEN的最大限量(100、50、60μg/kg)相比,该实验所建立的竞争性酶链适配体检测方法能够满足ZEN定量检测分析的要求。

图3 玉米赤霉烯酮浓度与450 nm处吸光度值之间的线性关系Fig.3 Linear relationship between zearalenoneconcentration and absorbance at 450 nm
2.4 特异性检测
为验证实验方法的特异性,防止假阳性现象的发生,应用所构建的方法对ZEN、FB1、DON、AFB1、OTA和空白样品同时进行检测。从图4可知,ZEN样品孔的吸光度值A450nm较低,颜色较浅,其余对照真菌毒素和空白样品孔的吸光度值A450nm都较高,溶液颜色也较深。实验结果表明此竞争性酶联适配体检测ZEN方法具有较高的特异性,可用于ZEN的特异性检测。

图4 竞争性酶链适配体检测方法的特异性实验结果Fig.4 Specific experimental results of the visual detection of zearalenone based on competitive emzymelinked aptamer assay
2.5 食品样品加标回收检测
为验证实验方法的准确性,用酶联免疫检测法与该方法进行对照。将从超市购买的啤酒和玉米样品进行前处理后,分别向2个样品中加入3种不同质量浓度的ZEN标准液,每个质量浓度做3组平行对照,分别用两种方法进行ZEN的加标回收检测。从表1可知,啤酒样品回收率为88.57%~102.14%,玉米样品回收率为91.43%~106.43%,与酶联免疫法对比,实验结果相差不大,表明了该实验方法具有准确性和稳定性,可用于不同食品样品检测。

表1 啤酒和玉米样品中ZEN加标回收检测结果(n=3)Table 1 Spike recovery results of ZEN in beer and corn samples(n=3)
3 结语
作者建立了一种基于竞争性酶联适配体检测玉米赤霉烯酮的方法,该方法检测灵敏度高、特异性好且成本低,能用肉眼判断实验结果,不需要特殊的仪器检测。方法的检测限为0.7 ng/mL,在1~10 000 ng/mL范围内具有良好的线性关系(R2=0.991 3),啤酒和玉米样品加标回收率分别为88.57%~102.14%和91.43%~106.43%,与酶联免疫法实验结果对比无明显差异,检测稳定性好、准确性高,可用于食品中玉米赤霉烯酮的可视化检测,对食品中小分子危害物质的检测具有重大意义。

