等离子体作用结合氧限制模型选育辅酶Q10高产菌株
张幸子, 王晓惠, 王泽建, 陈必钦, 李 丹, 郭美锦, 储 炬, 庄英萍
(1. 华东理工大学生物反应器工程国家重点实验室,国家生化工程技术研究中心(上海),上海 200237;2. 内蒙古金达威药业有限公司,呼和浩特 010000)
辅酶Q10(Coenzyme Q10)是一种广泛存在于生物体细胞膜上的脂溶性化合物,又称为泛醌(Ubiquinone),它作为线粒体呼吸链上的电子载体,负责将电子从复合物I(或复合物II)传递至复合物III[1-3]。研究表明,辅酶Q10具有抗氧化、清除体内自由基以及促进ATP (三磷酸腺苷)合成等生理功能[4-6],它可以降低体内氧化应激风险[7],临床上常与他汀类药物联用治疗心血管疾病[8-9],近二十年来其市场需求逐步增加,通过微生物法生产辅酶Q10市场潜力巨大[10]。
微生物虽然可以产生辅酶Q10,但对于自然界中的野生型菌株来说,其辅酶Q10的天然产量都较低,需要通过选育高产菌株、优化发酵工艺和提高分离纯化效率等手段,最大限度地提高辅酶Q10的产量,才能满足工业生产的需求[11-12]。类球红细菌(Rhodobacter sphaeroides)是近年来常用的辅酶Q10生产菌株,不少研究者从诱变育种、基因改造、代谢工程等角度出发来提高菌株产量[13-14]。扶教龙等[15]利用菌株对维生素K3、叠氮化钠和对羟基苯甲酸的复合抗性作为筛选标记,对类球红细菌使用亚硝基胍进行化学诱变,成功筛选出一株遗传稳定的高产菌株。Zhu等[16]通过表达类球红细菌中光合作用基因的转录调控因子ppsR和催化GGPP合成的crtE,增强了辅酶Q10生物合成中异戊二烯侧链前体(GGPP)的供应,使得改造菌RspPE的产量提高到73.2 mg/L,比野生菌提高了47%。
常温常压等离子体(Atmospheric and Room Tem–perature Plasma,ARTP)是由工作气体在外加射频电场的作用下,产生的温度在25~40 ℃之间的等离子体射流,其中包含了大量的活性粒子(如电子、离子、激发态原子、分子等),可以在常压下处理微生物,使DNA等遗传物质的分子结构发生改变[17],ARTP常温常压的工作条件有效降低了非致畸致变性处理的损伤与致死效应[18]。ARTP对活细胞DNA的损伤强度远高于其他诱变源,在一定范围内,DNA损伤强度与诱变率正相关,因此ARTP诱变比传统诱变手段更为高效,已成功用于100多种微生物的诱变育种[19-20]。对于诱变获得的大量突变株,需要选择合适、高效的筛选压力进行快速选育,大多诱变育种是采用前体、抗生素或结构类似物作为选择压力筛选[21-23]。在类球红细菌发酵过程中,供氧一直是影响菌体生长和产物合成的关键因素。高的氧消耗速率才能保证菌体的快速生长和产物合成速率的提升,但生产过程中动力能源的消耗过大会增加企业的生产成本;同时,菌体在一定的氧限制条件下才会快速进入次级代谢并开始启动大量合成辅酶Q10。Kien等[24]通过在发酵前期降低通气,限制供氧水平,有效提高了辅酶Q10产量。在相对低供氧情况下,如何筛选到菌体的比生长速率、氧亲和力和产物合成速率均较高的生产菌株是提升生产效率的关键。
本文通过 ARTP 作用的方式获得辅酶Q10的高产突变株,在建立的高通量培养平台上进行培养,根据菌体产物的合成特性,采用降低生长环境中氧供应的方法,构建氧限制模型,即通过在平板培养基中添加无水亚硫酸钠,胁迫菌体在氧限制的平板上生长的策略,快速筛选出了辅酶Q10高产的突变株,并在5 L反应器进行了验证。
1 实验材料与方法
1.1 原料和试剂
1.1.1 菌株及主要试剂 类球红细菌(Rhodobacter sphaeroides)J-1作为出发菌株,由内蒙古金达威药业有限公司提供;辅酶Q10由浙江新和成有限公司提供。
1.1.2 实验仪器 常压室温等离子体诱变仪(北京思清源生物技术公司,ARTP-II S型);5 L反应器(上海国强生化工程装备有限公司);高效液相色谱仪(美国Agilent Technologies Inc, Agilent 1100 series);尾气质谱仪(美国Extrel公司,MAX300-LG型);葡萄糖测定仪(山东省科学院生物研究所,SBA-50B型);可见分光光度计(上海棱光技术有限公司,721型)。
1.1.3 培养基
(1)平板培养基(g/L):酵母提取物15,磷酸氢二钾1,氯化钠2,硫酸亚铁0.1,硫酸镁0.15,琼脂粉20,辅液2 mL;pH 7.0~7.2。
(2)种子培养基(g/L):硫酸铵3,酵母提取物8,谷氨酸钠0.8,玉米浆干粉0.748,葡萄糖10,磷酸氢二钾1.5,硫酸亚铁0.25,硫酸镁1.8,氯化钠2,碳酸钙8,辅液2 mL;pH 7.1~7.2。
(3)发酵培养基(g/L):硫酸铵3,谷氨酸钠3.5,玉米浆干粉4.2,磷酸二氢钾1.6,硫酸亚铁0.8,硫酸镁10,氯化钠3,氯化钙0.07,葡萄糖32.5,碳酸钙10(摇瓶培养),辅液2.5 mL;pH 6.5~6.6。
(4)辅液(g/L):盐酸硫胺1 ,生物素0.015 ,烟酸1[15]。
1.2 培养方法
1.2.1 平板培养 无菌条件下,从培养6~7 d的新鲜平板上挑取外观饱满、大小适中的菌落8~10个,放入装有10 mL无菌生理盐水的试管中,充分打散制成菌悬液,按照10倍梯度依次稀释至母液的10−6倍,吸取0.1 mL菌液于平板均匀涂布后,放于32 ℃培养箱培养6~7 d,培养过程中需避光。
1.2.2 种子培养 用无菌竹签从新鲜培养的平板上挑取2~3个单菌落,接种于装有50 mL种子培养基的500 mL三角摇瓶中,在32 ℃、220 r/min转速下振荡培养28 h。当种子液吸光度OD700达到6时,转接至发酵培养基中。
1.2.3 发酵培养 按16%的接种量将种子液转接到500 mL三角摇瓶或5 L反应器中。摇瓶培养基装液量45 mL,添加碳酸钙稳定pH 值,在32 ℃、220 r/min转速下振荡避光培养48 h。5 L反应器培养基装液量2 L,在32 ℃避光培养106 h,初始转速400 r/min,发酵过程中用氨水控制pH 值为6.5~6.6,根据发酵液中残糖的消耗速率流加葡萄糖,控制残糖质量浓度不低于8 g/L。
1.2.4 孔板培养方法 无菌条件下,用10 μL移液枪从培养6~7 d的新鲜平板上挑取一个外观饱满、大小适中的菌落,直接打入24孔板中,加入培养基后盖上盖子,在32 ℃、220 r/min转速下振荡培养20 h。按16%的接种量用8孔道移液器将种子液接入装有发酵培养基的24孔板中进行发酵,在32 ℃、220 r/min转速下振荡避光培养48 h。
1.3 ARTP诱变步骤
按1.2节中方法制备菌悬液,在无菌条件下吸取10 μL菌液涂于金属载片上,使菌液均匀覆盖在载片表面。用镊子夹住载片放置在载物台上相应的孔位,把装有990 μL无菌水的2 mL离心管卡入对应的孔位下方。关闭舱门,设置好工作条件,进行诱变。待照射结束后,金属载片会自动落入下方的离心管中。将离心管置于旋涡振荡器上剧烈振荡1 min,使载片上的菌液洗脱完全,即得诱变后的菌悬液。
1.4 参数检测
1.4.1 辅酶Q10含量检测 由于利用类球红细菌生产辅酶Q10基本上都是在胞内的,所以检测首先要将胞内的辅酶Q10提取(酸化、有机溶剂提取)后进行检测。
标准曲线的绘制:准确称取0.1 g辅酶Q10标准品置于100 mL容量瓶中,用无水乙醇定容至刻度,配制成1 g/L的标品溶液,然后用无水乙醇将其稀释至10、20、30、40、50 mg/L,再用0.22 μm有机相过滤头过滤,供高效液相色谱仪分析。流动相为乙醇与甲醇(体积比1∶1)的混合液,色谱条件:检测波长275 nm,流速1.1 mL/min,进样量20 μL,柱温35 ℃。色谱柱:Hypersil ODS C18(150 mm×4.6 mm, 5 μm)。以峰面积为纵坐标,标品质量浓度为横坐标,绘制标准曲线。
摇瓶反应器中发酵液效价的检测:发酵结束后,取5 mL发酵液置于50 mL容量瓶中,加6 mol/L盐酸溶液1滴,轻微振摇,再加无水丙酮10 mL、9.8 mol/L双氧水1 mL,用无水乙醇定容至刻度,超声提取45 min。用0.22 μm滤头过滤,吸取1 mL置于液相小瓶中供液相检测,根据标准曲线计算发酵液效价。
孔板中发酵液效价的检测:发酵结束后,用8孔道移液器吸取0.5 mL发酵液,转移至另一个与孔板相对应的位置中,加6 mol/L盐酸溶液50 μL,轻微振荡摇孔板,加入无水丙酮1 mL、9.8 mol/L双氧水100 μL,再加入3.35 mL无水乙醇,盖上盖子,超声提取45 min。用0.22 μm滤头过滤,吸取1 mL置于液相小瓶中供液相检测,根据标准曲线计算发酵液效价。
1.4.2 菌浓检测和菌体干重测定 通过比浊法测定发酵液中的菌体浓度:取发酵液 5 mL,稀释至合适梯度振荡均匀后,用分光光度计在700 nm波长处测OD700即得菌浓。
发酵70 h后,以干重表征菌浓:将定量滤纸置于105 ℃烘箱中烘2 h,取出准确称量滤纸质量。取5 mL发酵液于滤纸上抽滤,将沉淀用去离子水清洗3次后,置于烘箱中烘至恒重得沉淀质量,除以取样体积即得菌体干重(g/L)。
1.4.3 发酵液残糖检测 将发酵液在12 000 r/min转速下离心10 min,取上清用去离子水稀释至合适梯度后,用葡萄糖测定仪检测。
1.4.4 在线摄氧率OUR检测 发酵过程中采用质谱仪对尾气进行检测,使用Biostar软件对数据进行采集,在线计算得到摄氧率OUR如下[25]:
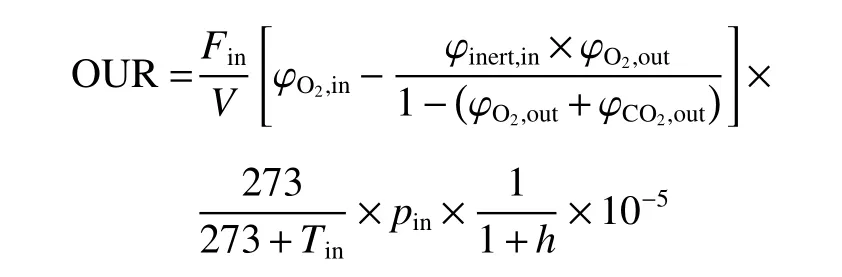
其中,Fin为进气流量(mmol/L),V为发酵液体积(L),φinert,in, φO2,in, φO2,out和 φCO2,out分别表示进气中惰性气体、氧气和尾气中氧气、二氧化碳的体积分数,pin表示进气气压(Pa),Tin为温度(℃),h为进气的相对湿度(%),所有上述变量除Tin、h外均为在线检测获得,Tin、h为离线测定所得。
2 结果与讨论
2.1 24孔板高通量培养方法的确定
2.1.1 孔板供氧水平和发酵时间对辅酶Q10发酵的影响 辅酶Q10发酵过程是好氧发酵,使用24孔板培养时,不同的培养基装液量会引起供氧水平的差异,从而影响产物合成。选取1.0、1.5、2.0、2.5、3.0 mL和3.5 mL的装液量,以同一瓶种子瓶进行接种,接种量16%、发酵48 h,考察孔板供氧水平对菌体生长和产物合成的影响。由图1可以看出,随着装液体积的提高,菌浓不断增加。孔板发酵过程中蒸发量大,装液量越低蒸发越严重,从而导致发酵液黏度上升,因此不利于菌体生长。当装液量为3.5 mL时,培养环境相对稳定,菌体生长情况最好,发酵结束时的OD700可达22.9。但随着装液量的提高,氧传递系数KLa逐渐减小[26],影响培养过程中的气液传质效果,且每个孔板的装液比变高使得空气含量减少,会进一步降低供氧水平,所以效价则呈现不同的变化趋势,装液量较高时,发酵结束的效价单位却比较低。综合考虑,选择2.0 mL的孔板装液量作为后续诱变初筛的培养体积。
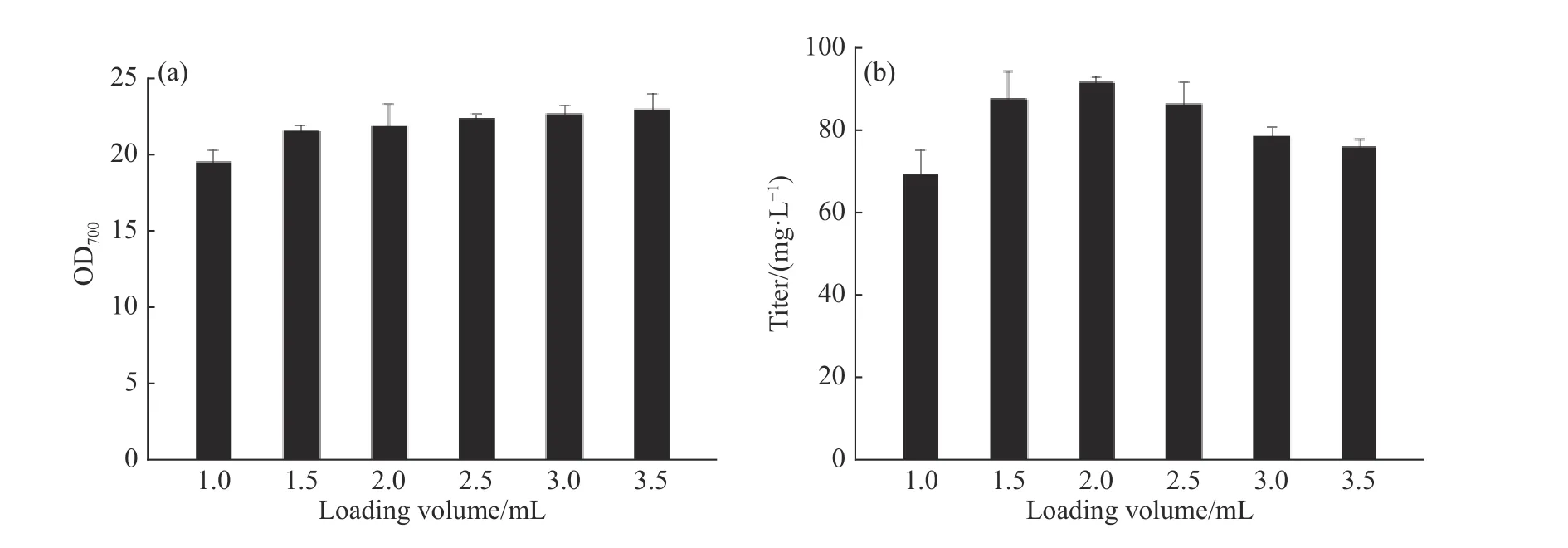
图1 不同装液量对类球红细菌菌浓和效价的影响Fig. 1 Effect of different loading volume on R. sphaeroides growth and titer
2.1.2 孔板培养平行性分析 确定装液量后,对孔板培养平行性进行评价(表1和表2)。结果表明24孔板发酵培养类球红细菌时,同一孔板各行列效价的相对标准偏差(RSD)最大为5.70%,平均为4.01%,不同孔板间效价的RSD最大为6.27%,平均为5.11%。该结果表明孔板培养的平行性良好,各行列之间的误差较小,将24孔板用于诱变菌株的初筛引起培养误差较小。
2.1.3 孔板培养与摇瓶培养一致性考察 24孔板培养中每一个孔板的体积小,供氧水平、剪切程度和营养传递等与摇瓶存在差异,取同一种子液,采用孔板和摇瓶同时进行发酵,比较了菌浓、效价、pH和残糖对两者发酵结果的影响,分析了孔板微量培养代替摇瓶培养的可行性,培养结果如表3所示。发酵结束时,培养基中的葡萄糖基本被消耗完全,所以两种培养模式下的pH 值和残糖浓度相近。总体结果显示孔板培养的菌浓和辅酶Q10含量略低于摇瓶培养,推断与孔板培养的透气膜孔小,蒸发量相对较大有关。但单位菌体的产率(Yp/x)非常一致,误差低于2%,说明孔板培养条件下,菌体的合成代谢能够反映摇瓶培养的结果,尤其是在初筛菌株时是完全可以用孔板替代摇瓶进行高通量筛选的。

表1 同一块孔板各行列平均效价差异Table 1 Difference of titer between rows and columns in one plate

表2 不同孔板平均效价差异Table 2 Difference of titer in different plates

表3 24孔板和摇瓶发酵情况对比Table 3 Comparison of fermentation conditions in 24-well plate and shake flask culture
为进一步考察孔板培养和摇瓶培养的一致性,延长发酵时间,选取2.0、2.5、3.0、3.5 mL的孔板培养与摇瓶培养(50 mL)对比,分析48 h和60 h培养周期下产物合成的差异,结果如图2所示。当发酵时间延长至60 h时,培养基中的碳源基本被消耗完全,营养限制使得菌体发生裂解,导致不同发酵体积的菌浓均有所下降。图2(b)结果表明在糖耗尽时,还有一些积累的中间代谢物参与了产物的合成,所以60 h时孔板和摇瓶的效价都呈现增长趋势,且孔板和摇瓶中效价的增长幅度相似(R2=0.902 6),表明孔板能够反映常规摇瓶培养的结果。因此在后续实验中,以孔板培养替代摇瓶培养,实现高通量菌株发酵性能筛选的方法是可行的。
2.2 高产菌株的诱变筛选
2.2.1 ARTP致死率曲线 ARTP诱变仪采用纯度99.99%以上的高纯度氦气作为工作气体,工作时可变参数有3个:功率、载气量和时间,一般来说仪器的功率是固定的,主要改变载气量和工作时间。为了寻找最佳的菌体诱变条件,在10 L/min的载气量下,设定不同的工作时间(0、10、15、20、25、30、35 s和40 s)进行诱变处理。将不同处理时间得到的菌液进行梯度稀释(一般稀释至10−4倍),取100 μL涂布于固体平板上,每个样品做3个平行,32 ℃避光培养6~7 d,根据平板上的菌落数目绘制致死率曲线(见图3)。随着诱变时间的增加,致死率不断上升,当诱变时间为30 s时,致死率能够达到99.04%,而其他微生物如白色链霉菌诱变420 s时的致死率为94.4%[27],可见类球红细菌对等离子体的致死作用较为敏感。一般情况下,致死率越高菌株越容易发生突变,致死率在80%~90%时较为合适,因此为了获得更多的突变株,本实验选择25 s作为最佳诱变时间,此时的致死率为86.02%。
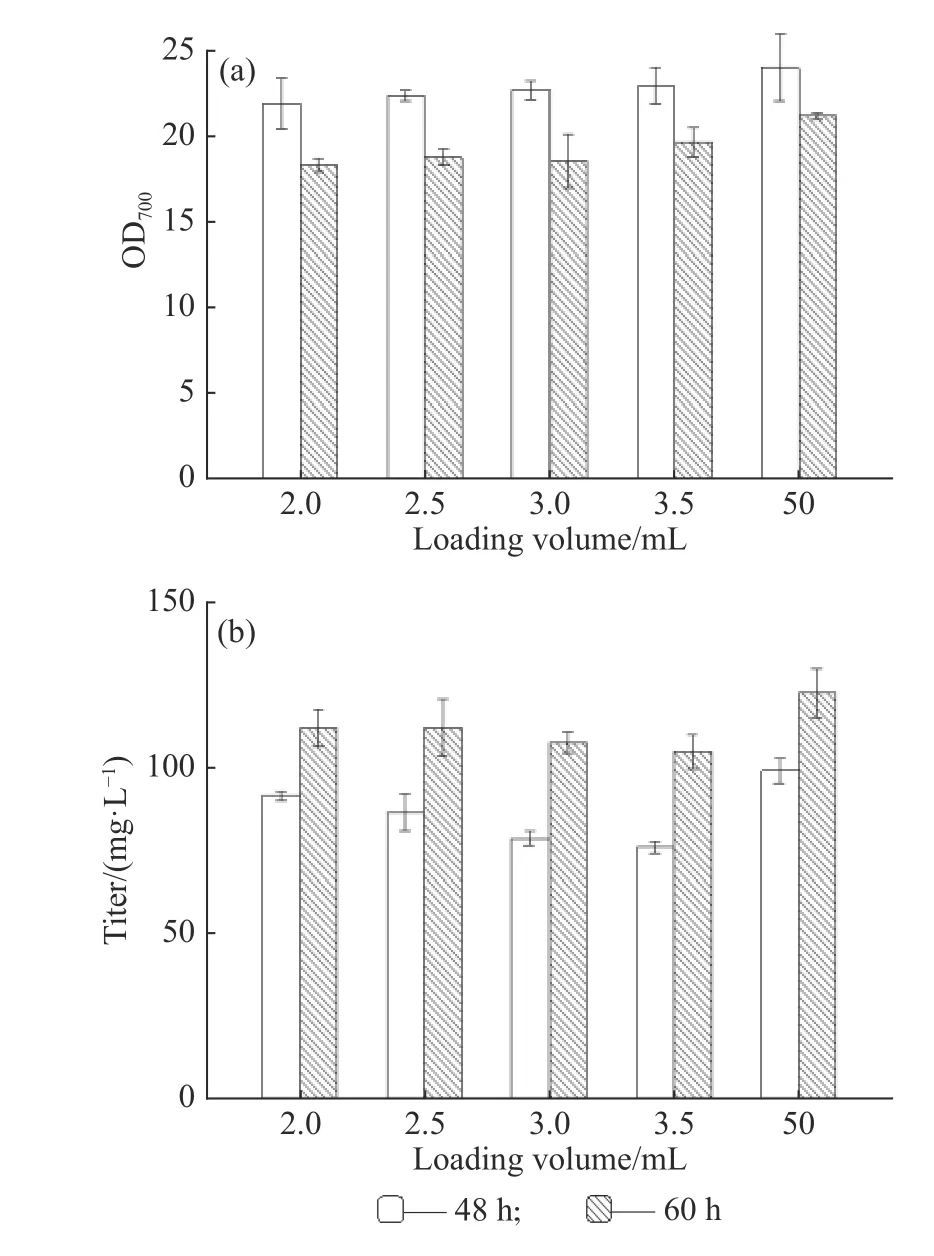
图2 类球红细菌发酵48 h和60 h菌浓和效价的对比Fig. 2 Comparison of R. sphaeroides growth and titer between 48 h and 60 h fermentation
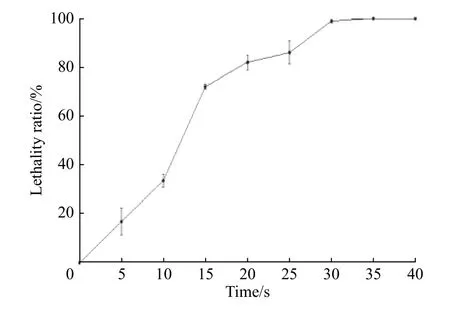
图3 类球红细菌的ARTP致死率曲线Fig. 3 Lethality curve of R. sphaeroides treated by ARTP
2.2.2 氧限制模型的构建 供氧受限能够促进细胞内辅酶Q10的积累。无水亚硫酸钠还原性极强,易溶于水,可与水中的氧气发生氧化反应,降低培养环境空间的氧浓度。通过在平板培养基中添加无水亚硫酸钠构建氧限制模型,可以筛选出在氧限制条件下能够正常生长和合成产物的菌株。将出发菌株的菌悬液涂布于含有不同质量浓度无水亚硫酸钠的平板上,每个浓度做3个平行,32 ℃避光培养6~7 d,统计各质量浓度平板上的菌落个数。从表4中可以看出,平板中无水亚硫酸钠的质量浓度达到0.4 g/L时,已无菌落长出。比较菌株在原始平板和添加0.2 g/L无水亚硫酸钠的平板上的菌落形态(图4)可以看出,原始平板上长出的菌落直径较大,且前期采用原始平板传代时,菌株会发生退化导致菌落变为黄色,退化菌落发酵后辅酶Q10的产量很低,而氧限制平板上长出的菌落颜色变为更深的墨绿色,直径较小且边缘整齐清晰,黄色菌落出现的概率大大减小。推测在该模型下长出的菌落有较强的氧亲和力,胞内呼吸代谢旺盛因而能够耐受低氧环境,具备辅酶Q10高产的潜力。因此为了提高筛选效率,将突变株在含有0.4 g/L无水亚硫酸钠的氧限制模型下生长。

表4 不同质量浓度的无水亚硫酸钠对菌落生长情况的影响Table 4 Effects of different mass concentrations of sodium sulfite on R. sphaeroides colony forming units (CFU)
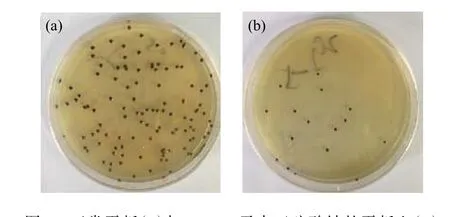
图4 正常平板(a)与0.2 g/L无水亚硫酸钠的平板上(b)培养菌落形态对比Fig. 4 Morphological comparison of colonies on normal plate (a)and 0.2 g/L sodium sulfite plate (b)
2.2.3 ARTP诱变结合氧限制模型筛选高产菌株 将用ARTP诱变25 s的类球红细菌菌悬液进行梯度稀释,涂布到无水亚硫酸钠质量浓度为0.4 g/L的平板上,培养6~7 d,在平板上可以生长的即为在氧限制环境下呼吸能力较强的突变菌株,从中挑选颜色鲜艳、外观饱满的单菌落,进行孔板初筛,培养体积2 mL,发酵48 h,产物采用HPLC检测。共筛选了506株菌,结果如图5所示。
2.2.4 高产菌株摇瓶复筛及遗传稳定性验证 选取孔板初筛效价提高25%以上的6株突变株,分别为R. sphaeroidesF3C21、R. sphaeroidesF4B01、R. sphaeroidesF4E15、R. sphaeroidesF5D13、R. sphaeroides
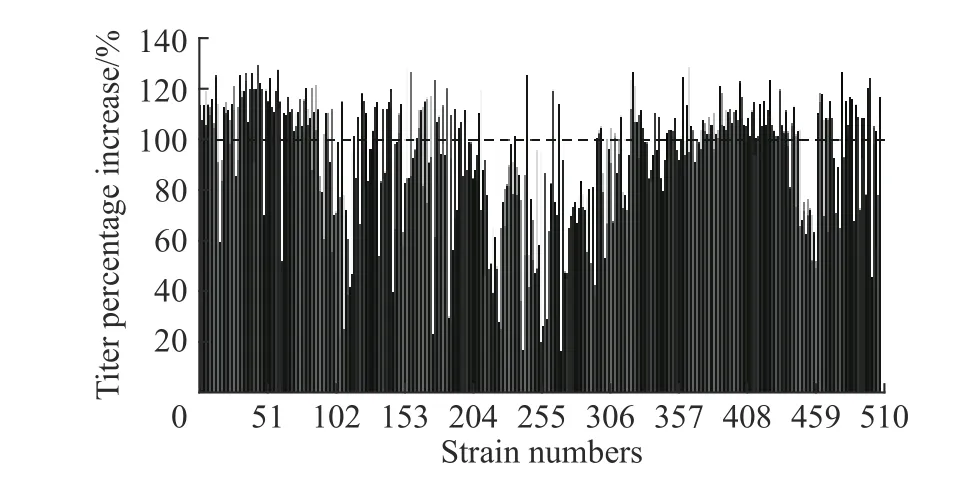
图5 突变株24孔板初筛结果Fig. 5 Preliminary screening results of mutants by 24-well plates
F6F19和R. sphaeroidesF6G16,连续传代培养并进行摇瓶发酵,验证高产菌株遗传稳定性,结果如图6所示。从图中可以看出,随着传代的进行,突变株的效价略有下降,其中R. sphaeroidesF3C21退化较大,R.sphaeroidesF5D13、R. sphaeroidesF4B01和R.sphaeroidesF6G16的遗传稳定性较好,R. sphaeroidesF5D13传代5代后的效价最高,为111.8 mg/L,比出发菌株(86.2 mg/L)提高了29.7%。
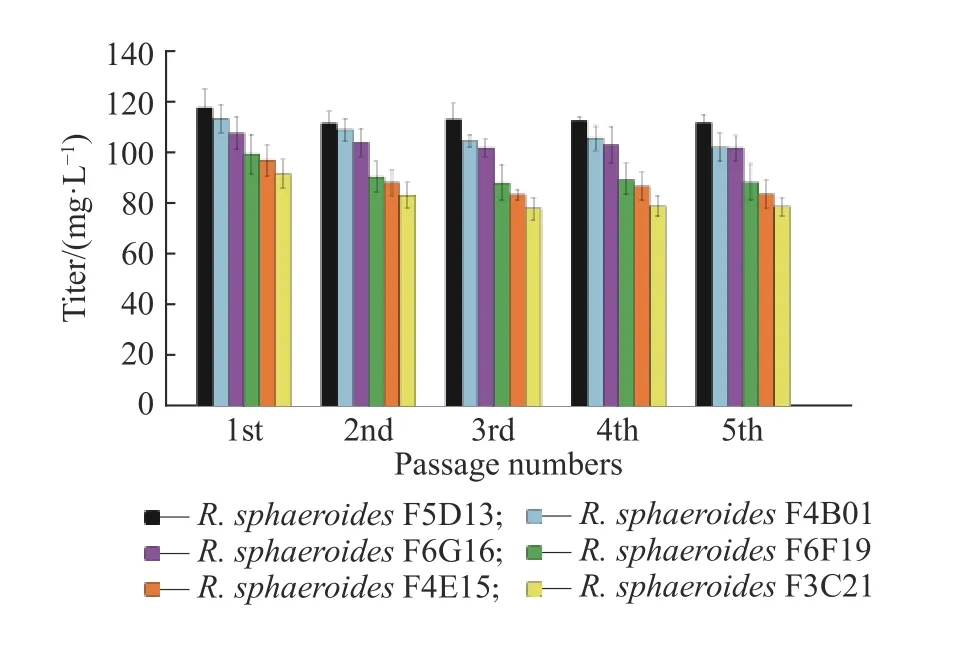
图6 菌株遗传稳定性验证Fig. 6 Verification of genetic stability of the strain
2.2.5 高产菌株和出发菌株的生理代谢特性参数比较 为了进一步评估高产菌株R. sphaeroidesF5D13的生产能力,本文在5 L反应器中开展了高产菌株和出发菌株的发酵培养,并对过程中的参数进行采集,进一步分析高产菌株和出发菌株在菌体生长和产物合成之间的差异,结果如图7和表5所示。在菌体生长方面,发酵前期(0~36 h),菌体快速生长,菌浓不断提高,32 h时高产菌株R. sphaeroidesF5D13菌浓比出发菌株R. sphaeroidesJ-1菌浓明显高14.5%,R.sphaeroidesF5D13的最大比生长速率为0.092 2 h−1,比R. sphaeroidesJ-1高了6.84%,表明在进入产物合成期前(48 h),R. sphaeroidesF5D13累积了较高的生物量进行产物合成。比较发酵中后期(48~100 h)两者的效价增长趋势(图7b),R. sphaeroidesF5D13的初始效价明显高于R. sphaeroidesJ-1,后期两者的差异越来越大,发酵结束时高产菌株的效价为770.06 mg/L,较出发菌株的652.69 mg/L提高了18.0%,糖转化率也较高。观察发酵过程的摄氧率OUR曲线(图7c)可以看出,前期R. sphaeroidesF5D13的OUR较早进入爬升期,随后下降进入稳定期,最终维持在80左右;而R. sphaeroidesJ-1稳定期的OUR维持在60左右,明显低于R. sphaeroidesF5D13。推测是前期高产菌R. sphaeroidesF5D13活力高、耗氧快,促进菌浓增加,OUR较早进入高点开始合成产物,因而初期的起步效价也较高;当产物大量合成,即OUR进入稳定期时,高产菌株对氧亲和力强,呼吸代谢较出发菌株更为旺盛,更有利于维持产物的合成,氧消耗速率OUR也稳定在较高水平。结合比耗氧速率QO2变化(图7d),高产菌株的QO2一直高于出发菌株,尤其是在产物合成的发酵中后期,进一步表明次级代谢阶段高产菌株细胞活力优于出发菌株,产物合成能力较强。

图7 5 L反应器中出发菌株和高产菌株发酵过程变化的差异Fig. 7 Difference of fermentation process between the high-yield strain and the parent strain in 5 L fermentation reactor
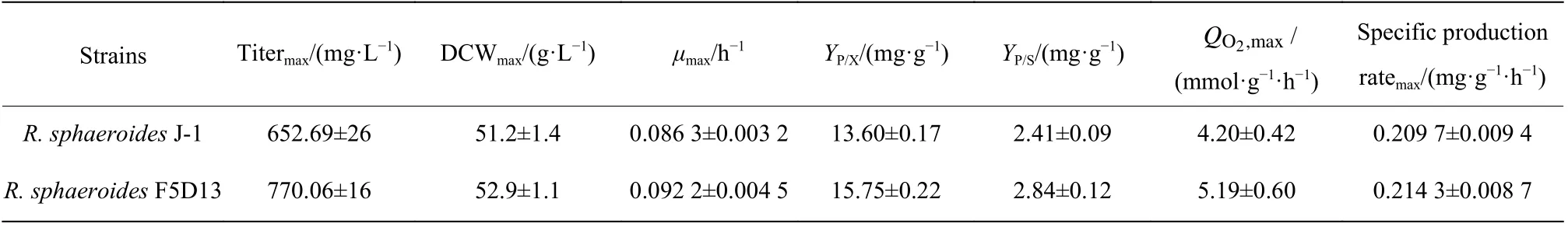
表5 出发菌株和高产菌株R. sphaeroides F5D13发酵过程参数Table 5 Calculated parameters of the fermentation conditions by R. sphaeroides J-1 and R. sphaeroides F5D13
3 结束语
为提高突变菌株的筛选效率,简化培养过程,本文以孔板代替摇瓶进行突变株的初筛,探究了不同供氧水平对菌体细胞代谢特性的影响,对孔板中不同体积的培养结果进行了评价。结果显示装液量为2.0 mL、发酵周期为48 h时,孔板的菌浓和效价都和摇瓶结果相近,不同孔板位置培养的差异在实验误差范围内,因此孔板可以用于类球红细菌突变菌株的高通量培养。
ARTP作为一种新兴的诱变手段,相较于传统诱变技术更为高效,释放的等离子体射流中包含的活性粒子可以引起细胞DNA的断裂,进一步引发DNA易错性修复机制,从而可以在短时间内处理生物细胞产生大量的突变体,提高突变率[28]。本文将ARTP技术应用于类球红细菌的诱变,并针对产物合成特性,首次采用无水亚硫酸钠构建氧限制模型筛选突变株。筛选得到高产菌株R. sphaeroidesF5D13,其传代5次以后的摇瓶效价为111.8 mg/L,比出发菌株的86.2 mg/L提高了29.7%,遗传稳定性良好。在5 L反应器中的培养结果显示,高产菌株R. sphaeroidesF5D13发酵前期生长快,发酵中后期则表现出更强的氧亲和力,耗氧速率明显维持在一个较高水平,最终辅酶Q10的效价较出发菌株提高了18.0%,达到了770.06 mg/L。
综上所述,利用ARTP对类球红细菌进行诱变,结合氧限制模型进行筛选,可以有效筛选出辅酶Q10的高产菌株。后续可针对筛选得到的高产菌株,从供氧、补料等方面进行发酵条件的进一步优化,以期取得产能的再提升。

