HLA-DQA1基因多态性与视神经脊髓炎的相关性研究
周莉莉 朱师国 黄诗诗 朱兰兵 王建勇 张雄 何志勇
视神经脊髓炎(neuromyelitis optica,NMO)是主要累及视神经及脊髓的中枢神经系统免疫炎性脱髓鞘疾病[1],其病因及发病机制至今尚不清楚。遗传因素在NMO发病机制中的作用日益受到重视。近年来,欧洲开展了较大规模的全基因组关联研究,发现了位于人类白细胞抗原(human leukocyte antigen,HLA)基因的一个易感区域HLA-DQA1,该区域中的rs28383224位点与NMO相关性较强[2]。HLA在机体免疫应答和免疫调节中起关键作用。有研究发现免疫反应和炎症参与NMO疾病过程,在NMO的发生和发展中有着重要作用[3-4],HLA-DQA1区域可能是导致NMO的重要遗传因素。尽管国内外一些学者己经对HLA基因多态性与NMO易感性的关联作了相关研究,但由于等位基因及其频率存在种族及地区差异性,各地研究结果不一,故目前尚无定论。本研究分析HLA-DQA1基因多态性与汉族人群NMO的相关性,探讨NMO的发病机制,为早期诊断及治疗提供帮助,现将结果报道如下。
1 对象和方法
1.1 对象 选择2015年1月至2020年5月就诊于温州医科大学附属第二医院脱髓鞘专病门诊的NMO确诊患者(NMO患者组)51例,其中男8例,女43例,年龄 10~83(46.31±17.27)岁;扩展残疾状况(expanded disability status scale,EDSS)评分为(2.66±2.12)分。NMO诊断标准参考Wingerchuk等[5]2015年的提议:(1)血清水通道蛋白 4(acquaporin 4,AQP4)-IgG 阳性:至少有一个核心临床特征;AQP4-IgG阳性(细胞转染法);排除其他诊断。(2)AQP4-IgG阴性或AQP4-IgG状态未知:①在1次或多次临床发作中,至少2项核心临床特征并满足下列全部条件:至少1项临床核心特征为视神经炎、急性脊髓炎或延髓极后区综合征;空间多发(2个或以上不同的临床核心特征);满足MRI附加条件;②检测AQP4-IgG阴性或未检测;③排除其他诊断。另选择同期本院健康体检者86例作为健康对照组,其中男16例,女 70 例,年龄 19~83(48.60±16.05)岁。两组对象性别、年龄比较差异均无统计学意义(均P>0.05)。NMO患者组中合并干燥综合征4例,重症肌无力、桥本甲状腺炎、甲状腺功能亢进各1例。根据AQP4-IgG抗体检测结果将NMO患者组再分为AQP4-IgG阳性亚组43例和AQP4-IgG阴性亚组8例。本次研究经温州医科大学附属第二医院医学伦理委员会审查批准(批准文号:LCKY2019-159),两组对象均签署知情同意书。
1.2 方法
1.2.1 NMO患者组临床资料的收集 收集、分析AQP4-IgG阳性亚组和阴性亚组NMO患者的性别、年龄、发病年龄、EDSS评分、首发症状(包括视神经炎、脊髓炎、视神经炎合并脊髓炎、极后区症状)、合并免疫系统疾病、MRI表现(受累脊髓节段>3、伴有颅内病灶)。
1.2.2 MRI检查方法 NMO患者组行MRI检查,使用MR专用的头颅线圈,用海绵垫固定患者头部。所有NMO患者组均使用美国GE Signal 3.0T超导型MR成像仪及相控阵头线圈。(1)头颅MRI成像序列:轴位自选回波T1WI、T2WI、水抑制反转回波成像及矢状位自选回波T1WI。(2)视神经MRI成像序列:轴位自选回波T1WI、T2WI、水抑制反转回波成像及矢状位自选回波T1WI。(3)脊髓MRI成像序列:矢状位快速自选回波T1WI、T2WI、脂肪抑制成像及轴位自选回波T2WI。增强MRI检查中,完成定位像扫描后,静脉注射对比剂钆喷酸葡胺(0.1 mmol/kg)20 ml,注射对比剂完毕后再依次进行矢状位、冠状位和轴位T1WI序列增强扫描。
1.2.3 基因型分析 (1)血液标本采集:分别抽取NMO两组受检者外周静脉血2 ml,用肝素抗凝,于-80℃冰箱保存。(2)血液标本基因组DNA的提取:采用德国Qiagen公司QIAmp血液基因组DNA提取试剂盒提取NMO患者组及健康对照组外周血DNA,用NanoDrop2000分光光度计测定DNA浓度及纯度,控制OD260/OD280在 1.7~1.8。(3)基因型检测:用 PCR 对 rs28383224位点进行扩增。其正向引物序列为F:5'CACTGTGGGATGAGGAGATGA 3';反向引物序列为 R:5'CCATTGGCTCCCTTGATCCT 3'。用DNA凝胶回收试剂盒对PCR产物进行切胶回收,用3730XL基因测序仪对PCR产物进行测序,由北京擎科生物科技有限公司完成。采用Sequencing Analysis 5.2软件对峰图数据进行分析,根据比对结果判读基因分型,并进一步进行比较分析。
1.3 统计学处理 采用SPSS 24.0统计软件。通过直接计数法对rs28383224位点基因型和等位基因频率进行计算。符合正态分布的计量资料以表示,组间比较采用t检验;不符合正态分布的计量资料以M(Q1,Q3)表示,组间比较采用Mann-Whitney U及Wilcoxon W秩和检验。计数资料比较采用 χ2检验。相关性分析采用logistic回归。P<0.05为差异有统计学意义。
2 结果
2.1 AQP4-IgG阳性、阴性亚组患者临床资料比较 见表1。
由表1可见,AQP4-IgG阳性亚组和AQP4-IgG阴性亚组患者一般资料比较,差异均无统计学意义(均P >0.05)。
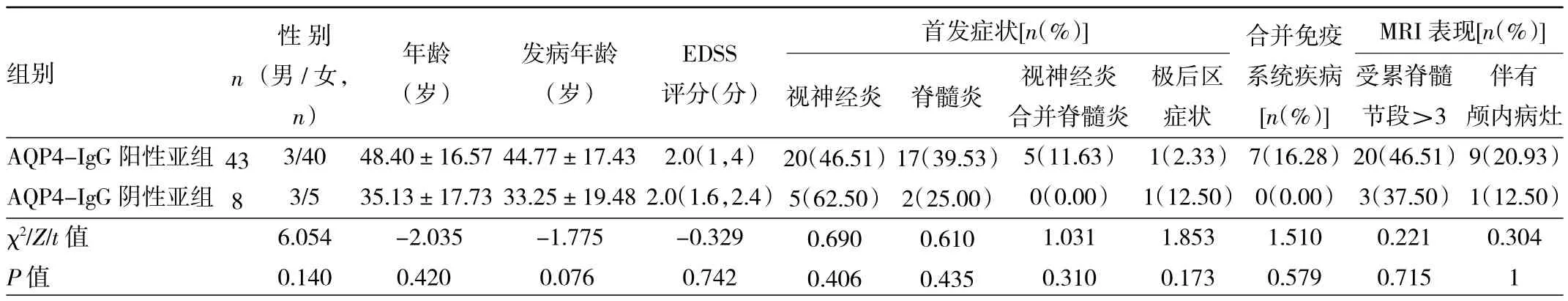
表1 AQP4-IgG阳性、阴性亚组患者临床资料比较
2.2 MRI检查结果 NMO患者组中51例均完成了头颅MRI、脊髓MRI。头颅MRI检查发现大脑异常信号改变9例,延髓异常信号改变3例。脊髓MRI扫描显示有不同程度的脊髓受累35例。NMO患者组中30例患者完成了视神经MRI检查,其中发现视神经信号异常改变19例。视神经、脊髓典型病变见图1-3。

图1 1例56岁女性患者的视神经和颈髓MRI图像[a:冠状位T2WI压脂序列,显示左侧视神经高信号(箭头所示);b:轴位T2WI压脂序列,显示右侧视神经肿胀,双侧视神经高信号(箭头所示);c:颈髓矢状位脂肪抑制成像序列,显示C5~7平面脊髓增粗伴纵行条片状高信号影(箭头所示)]
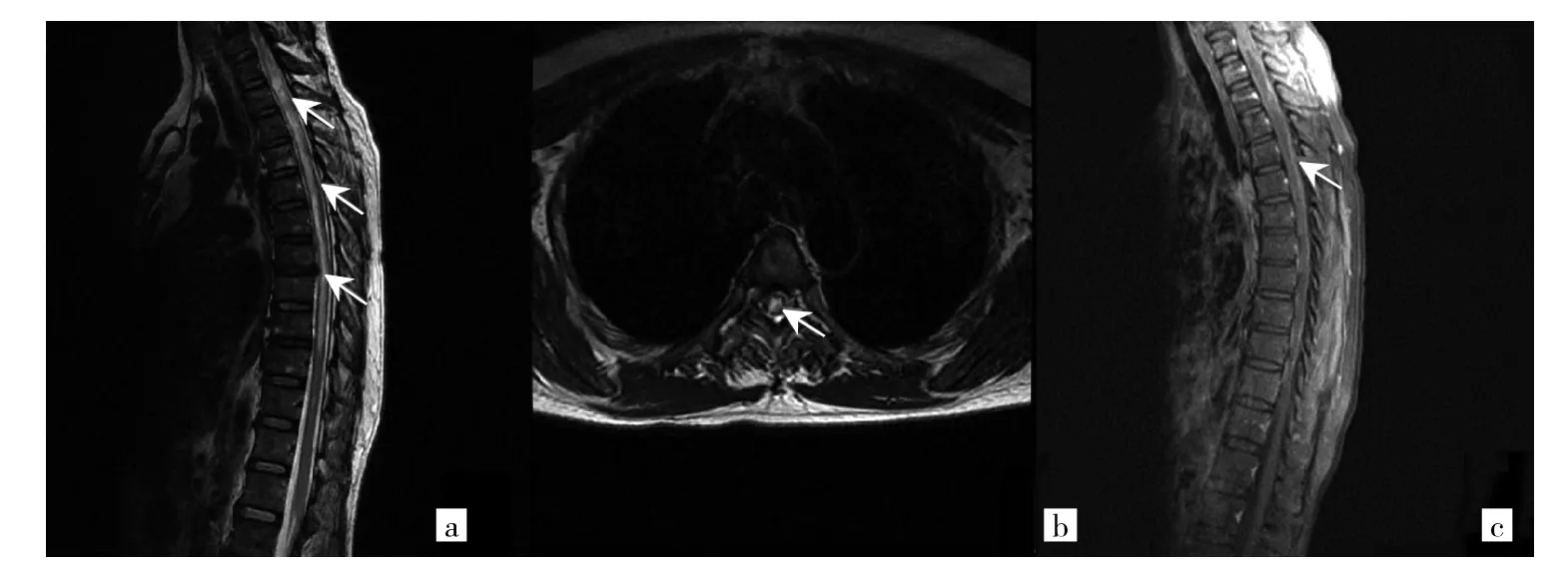
图2 1例54岁女性患者的胸髓MRI图像[a、b:T2WI序列,显示C4~T10平面脊髓广泛异常信号(箭头所示);c:增强MRI序列,显示胸髓不均匀强化(箭头所示)]
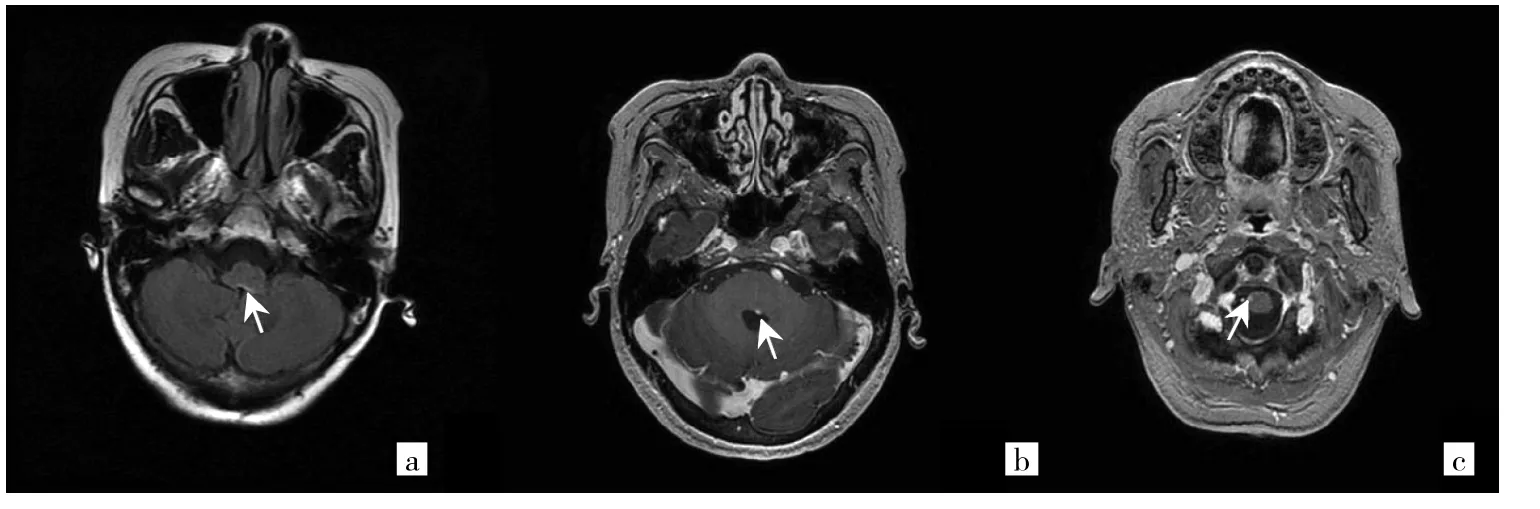
图3 1例62岁女性患者的头颅MRI图像[a:头颅T2水抑制反转回波成像序列,显示延髓极后区异常高信号(箭头所示);b、c:MRI增强序列,显示延髓极后区及颈髓多发斑点状、小片状强化影(箭头所示)]
2.3 NMO患者组和健康对照组rs28383224基因检测结果比较 NMO患者组和健康对照组DNA片段测序图见图4(插页)。两组对象rs28383224基因型频率和等位基因频率分布见表2。

图4 视神经脊髓炎(NMO)患者组和健康对照组DNA片段测序图(箭头所示为rs28383224多态性位点的基因型)
由图4可见,经Hardy-Weinberg遗传平衡检验,得出NMO患者组与健康对照组rs28383224位点的多态性基因型观测值与期望值检验符合Hardy-Weinberg(P>0.05),表明两组研究对象具有较好的群体代表性。
由表2可见,两组对象rs28383224基因型频率和等位基因频率分布差异均无统计学意义(均P>0.05)。
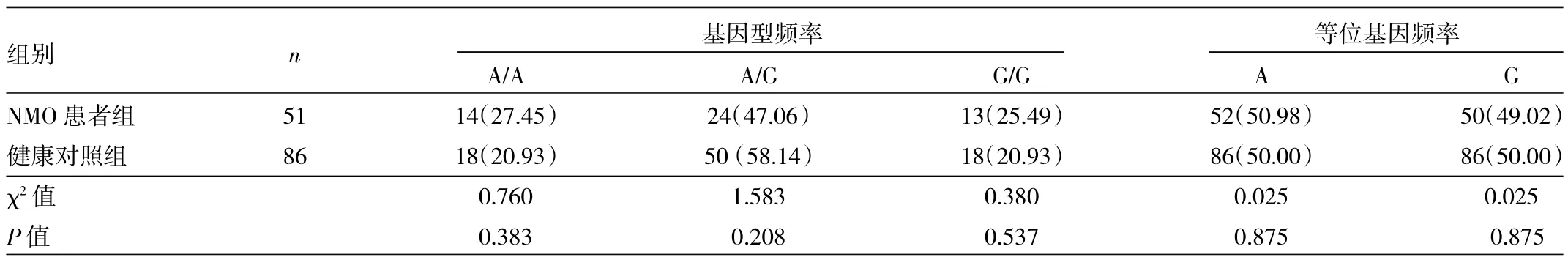
表2 NMO患者组和健康对照组rs28383224基因型频率和等位基因频率分布[例(%)]
通过logistic回归分析,提示rs28383224多态性与NMO发生风险无关联性(AG比AA:OR=1.028,95%CI:0.371 ~2.848,P=0.957;GG 比 AA:OR=0.672,95%CI:0.283~1.599,P=0.369,均 P >0.05)。
3 讨论
NMO是一种免疫介导的中枢神经系统炎性脱髓鞘疾病,以视神经或脊髓相继或同时受累为主要表现,将引起不可逆的损伤,是中青年常见的致盲致残性疾病。2004年,NMO特异抗体AQP4-IgG确定为NMO的特异抗体[6]。随着对AQP4-IgG认识的深入和应用推广,2015年新的NMO谱系病国际诊断标准[5],提出根据血清AQP4-IgG检测结果进行分层,包括AQP4-IgG阳性、AQP4-IgG阴性以及无法检测AQP4-IgG的NMO谱系病[7]。NMO的确切病因和发病机制尚未明确,目前认为其可能机制涉及免疫、遗传、环境等诸多因素,其中尤其是对遗传学因素研究甚少[8]。本研究比较了不同抗体类型NMO患者的临床特征,发现不同亚型患者临床症状有着明显差异,并对NMO的相关基因位点进一步深入研究。
目前NMO免疫学相关的病因错综复杂,其发病机制尚未完全阐明。人类主要组织相容性复合体通常被称为HLA,定位于人类第6号染色体短臂,呈高度多态性,有高度遗传多态性,各等位基因频率分布因不同种族、群体、地域而异,与许多自身免疫性疾病的遗传易感性密切相关,其基因多态性决定了HLA系统参与的免疫反应的多样性和复杂性。既往国内外关于NMO的遗传因素研究多集中于HLA基因。研究结果显示,90%以上的NMO患者与HLA等位基因DPB1*0501和DPB1*0301密切相关,其中亚洲人或黑种人NMO发病主要与DPB1*0501相关,而在白种人群中最常见的则是 DPB1*0301[9]。Wang 等[10]分析了 HLA-DRB1 和 HLADPB1等位基因在中国南方汉族人NMO发病中的作用,发现HLA-DRB1*0501与南方汉族人群AQP4-Ab阳性NMO发病风险相关。NMO易感性与不同HLA基因多态性相关可能由种族、地域不同所致,进一步支持了NMO的发病与遗传因素有关。
HLA-DQA1位于6p21.32,是一组免疫应答基因,Estrada等[2]对欧洲人的研究中发现HLA-DQA1和C4A/C4B位点与NMO存在密切相关性。同时后续有关HLADQA1与NMO的相关性研究如Ogawa等[11],在日本人群中检测到HLA-DQA1*05:03位点与NMO的发病存在正相关,而HLA-DQA1*01:01、HLA-DQA1*03:02未发现与NMO的发病相关,表明HLA-DQA1基因的单核苷酸多态在不同人群中与NMO的相关性有一定的差异,其是否为NMO的危险因素还需进一步扩大其他国家或地区的调查研究。目前关于中国NMO患者与HLA-DQA1基因多态性研究报道尚较少见。本研究选取了HLA-DQA1区域中与NMO相关性最强的rs28383224在汉族人中进行了验证,采用具有灵敏度高、准确性强的基因测序法对51例NMO患者和86例健康对照者作了HLA-DQA1区域rs28383224的基因型分析,本研究结果暂不支持rs28383224多态性是汉族人群NMO的危险因素,但不能就此排除HLA-DQA1基因参与NMO发病的可能性。本研究结果一方面可能是由地区或者种族差异引起,另一方面可能我们的研究样本量相对较小。
由于NMO的易感性与多基因相关,除AQP-4等已知易感基因外,HLA-DPB、CD40、IL-17和 TNFSF4等候选基因也可能影响患者NMO易感性[12-15]。因此,需要后期进行多中心、大样本、大规模研究来证实,同时进一步探索NMO新的易感基因及保护基因。随着对NMO遗传机制认识及研究的不断深入,从基因遗传学方面加深对AQP4-IgG阳性及阴性NMO的再认识,针对性地为临床治疗提供新线索。

