初诊高血压患者血清IL-18、hs-CRP、TNF-α水平与颈动脉内中膜厚度的相关性研究
骆丹越 孔敏刚 章晨 王利民
高血压是我国患病率最高的慢性病,《中国心血管病报告2012》显示,我国高血压患病率为24%,并且呈逐年增长的趋势[1]。相关研究指出,高血压患者致残和致死的重要原因是动脉粥样硬化,及早正确评估高血压患者动脉粥样硬化病变程度以及进行药物干预,对患者有重要意义[2]。颈动脉内中膜厚度(intima-media thickness,IMT)检测是评估患者动脉粥样硬化程度的有效手段,可作为动脉粥样硬化研究试验终点标记替代指标,但也有研究指出,IMT检测受设备和人员因素的影响,且在基层推广困难,不同人员操作以及不同设备检测存在差异[3]。IL-18是一种促炎因子,能促进炎性介质释放,参与动脉粥样硬化发展。超敏C反应蛋白(hypersensitive C-reactive protein,hs-CRP)是一种能有效反映炎症状况的敏感指标。江中林等[4]研究指出,hs-CRP水平与动脉粥样硬化有关。TNF-α具有体液免疫、细胞免疫等作用,参与炎症反应,与组织损伤有关。由于初诊原发性高血压患者的IMT多为正常[5-6],鲜有研究聚焦此类患者的炎症反应与IMT的相关性,为此本研究初诊原发性高血压患者血清IL-18、hs-CRP、TNF-α水平与IMT的相关性,现将结果报道如下。
1 对象和方法
1.1 对象 选取2015年7月至2020年7月在浙江大学医学院附属金华医院就诊的初诊原发性高血压患者130 例,男 68 例,女 62 例,年龄 40~78(52.7±4.7)岁。根据中国血管病变早期检测技术应用指南(2011第二次报告)[7],以IMT是否增厚,将高血压患者分为IMT正常(IMT≤0.8 mm)组60例和IMT增厚(IMT>0.8 mm)组70例。IMT正常组男 34例,女 26例,年龄 35~62(52.5±4.6)岁;IMT 增厚组男 44 例,女 26 例,年龄 34~65(52.8±4.5)岁。选取同时期健康体检者100例作为对照组,男56 例,女 44 例,年龄 40~78(52.5±4.3)岁。纳入标准:高血压患者均符合2012年《中国高血压防治指南》的诊断标准,2次非同日测定血压;收缩压>140 mmHg,舒张压>90 mmHg;所有患者均为初次诊断的原发性高血压,均未进行降压治疗。排除标准:继发性高血压、体位低血压;心、肺、肝、肾功能不全患者;合并痛风、风湿等自身免疫性疾病患者;恶性肿瘤患者;合并糖尿病、心肌梗死、心绞痛、心瓣膜疾病患者。本研究经院伦理委员会批准[审批文号:(2017)伦审第(95)号]。所有对象或其家属均签署知情通知书。
1.2 方法
1.2.1 IMT测量 采用荷兰飞利浦ie-elite型彩色多普勒超声检测仪,探头频率7.5 MHz,由专门操作人员进行操作:选择平卧头仰位,头偏向一侧,将患者充分暴露后,在患者在双侧颈总动脉(common carotid artery,CCA)的分叉1 cm位置,颈内动脉(internal carotid artery,ICA)起始1 cm位置检测IMT,计算患者左右CCA、ICA并求取IMT平均值。IMT增厚组、IMT正常组典型患者IMT超声检查结果见图1。将IMT增厚组依据评估标准[8]分为3个亚组,即<0.85 mm亚组、0.85~<1.50 mm亚组及≥1.50 mm亚组。
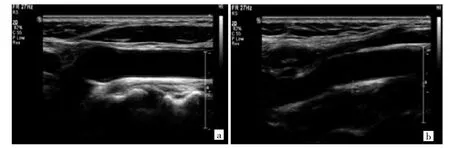
图1 内中膜厚度(IMT)增厚组、IMT正常组典型患者IMT超声检查结果[a:IMT增厚(1.5 mm);b:IMT正常]
1.2.2 血清指标检测 抽取3组对象清晨空腹静脉血3 ml,放置于干净的EP管中,经过冷凝处理后,2 500 r/min离心分离得血清,保存至-70℃的冰箱待测。采用中国迈瑞BS-800全自动生化分析仪检测TC、TG、LDL、FPG水平。采用ELISA检测3组对象及<0.85 mm亚组、0.85~<1.50 mm 亚组、≥1.50 亚组 IL-18、hs-CRP、TNF-α水平。
1.3 统计学处理 使用SPSS 20.0统计软件。计量资料以表示,组间比较采用重复测量设计的方差分析,组内两两比较采用LSD-t检验;计数资料比较采用χ2检验,相关性分析采用Pearson相关,P<0.05为差异有统计学意义。
2 结果
2.1 3组对象的一般资料比较 见表1。
由表 1 可见,3 组对象性别、年龄、BMI、TC、TG、LDL、FPG比较,差异均无统计学意义(均P>0.05)。

表1 3组对象的一般资料比较
2.2 3 组对象血清 IL-18、hs-CRP、TNF-α 水平比较见表2。
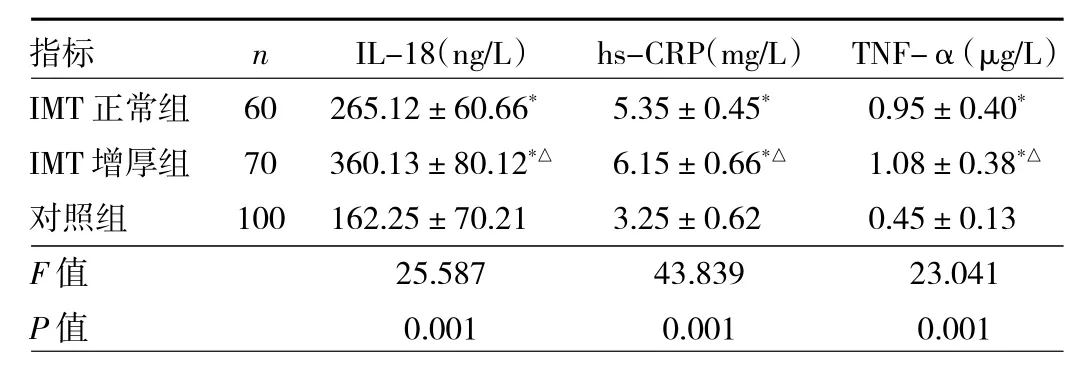
表2 3组对象血清IL-18、hs-CRP、TNF-α水平比较
由表2可见,与对照组比较,IMT正常组、IMT增厚组的IL-18、hs-CRP、TNF-α水平均较高,差异均有统计学意义(P<0.05)。IMT 增厚组的 IL-18、hs-CRP、TNF-α水平均高于IMT正常组,差异均有统计学意义(均 P<0.05)。
2.3 IMT 增厚组患者 IL-18、hs-CRP、TNF-α 水平比较 见表3。
由表3可见,0.85~<1.50 mm和≥1.50 mm亚组患者 IL-18、hs-CRP、TNF-α 水平均高于<0.85 mm 亚组,差异均有统计学意义(均P<0.05)。IMT≥1.50 mm患者 IL-18、hs-CRP、TNF-α 水平高于 0.85~<1.50 mm亚组患者,差异均有统计学意义(均P<0.05)。

表3 IMT增厚组患者IL-18、hs-CRP、TNF-α水平比较
2.4 初诊原发性高血压患者外周血IL-18、hs-CRP、TNF-α与IMT相关性分析 见图2-4。
由图2-4可见,Pearson线性分析显示,IL-18、hs-CRP、TNF-α 与 IMT均呈正相关关系(r=0.252、0.293、0.302,均 P<0.05)。
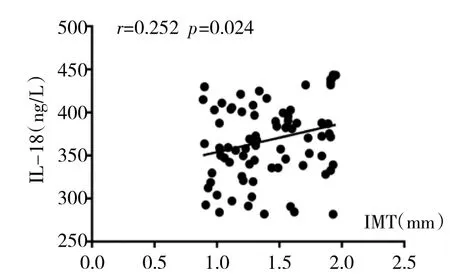
图2 初诊原发性高血压患者外周血IL-18与颈动脉内中膜厚度(IMT)相关性分析

图3 初诊原发性高血压患者外周血hs-CRP与颈动脉内中膜厚度(IMT)相关性分析

图4 初诊原发性高血压患者外周血TNF-α与颈动脉内中膜厚度(IMT)相关性分析
3 讨论
高血压是一种常见的慢性病,也是动脉粥样硬化的主要危险因素。高血压起病较为隐匿,患者早期自觉症状不显著,但其会对心、肾、脑等重要器官产生损伤,严重者可导致脑卒中和心肌梗死。高血压患者体内血流增加,随着剪切应力不断增加,对动脉内膜产生损伤。相关研究显示,动脉壁损伤、修复以及动脉粥样硬化过程伴随炎症反应发生,是动脉内膜类脂质沉积、各种炎性介质、细胞因子共同参与作用的结果[9-10]。相关研究指出,粥样斑块形成、内膜增厚和颈动脉管径狭窄甚至闭塞不仅引发高血压患者发生心脑血管意外事件,而且还造成预后不良[11]。IMT是上述病变的直观量化指标,因而临床常用作评估初诊原发性高血压严重程度及预后的重要指标,如Putcharoen等[12]研究认为,IMT不仅是一种强预测因子用来预测心血管事件发生,还是动脉粥样硬化重要的替代标志物。
IL-18主要由活化的巨噬细胞生成,是干扰素γ的诱导因子,也是一种多效能促炎症因子,不仅能合成和释放干扰素γ,还能通过激活单核巨噬细胞,促进基质金属蛋白酶分泌,促进更多的IL-18生成,进而调节更多的细胞因子,参与炎症反应,促进动脉粥样硬化形成[13-14],无病变的动脉组织缺乏巨噬细胞,因而不表达IL-18。Lu等[15]研究认为IL-18基因多态性促进心血管疾病发生,调控高血压发生,参与心源性猝死以及冠状动脉粥样硬化病变过程,万靖等[16]研究也指出,IL-18与2型糖尿病颈动脉粥样硬化患者IMT有相关性。本研究结果显示,IL-18参与了高血压的发生发展过程,与对照组比较,IMT增厚组患者的IL-18相对较高,且IMT越高,IL-18水平更高。与Arutyunov等[17]研究结果基本一致。
hs-CRP是一种重要的灵敏指标,反映低水平的炎症状态,与反应蛋白比较,其灵敏性较高。张明磊等[18]研究指出,hs-CRP在心脑血管疾病预测方面效果突出,通过反映患者动脉硬化斑块易损性,评估其斑块破裂可能性。hs-CRP可激活补体等多种机制损伤动脉内膜,参与高血压动脉粥样硬化发生,因此hs-CRP水平能有效体现动脉粥样硬化的稳定性,反映患者严重程度[19]。郭红霞等[20]研究认为,IMT与hs-CRP之间具有一定的相关性,患者颈动脉病变程度越重,患者hs-CRP水平越高,IMT与hs-CRP之间呈正相关。本研究结果也显示,hs-CRP越高,IMT也越高,hs-CRP水平越高,呈线性正相关,与以上文献报道相一致。
Liao等[21]研究结果指出,在动脉粥样斑块中局部巨噬细胞、单核细胞以及中性粒细胞均能促进合成TNF-α,患者动脉发生损伤或者斑块发生破裂以及溃疡时,促进TNF-α产生,增高的TNF-α可引起脂代谢紊乱,血小板聚集及血管平滑肌细胞痉挛,进而促进胆固醇浸润,促进动脉粥样硬化,患者预后较差[22]。TNF-α对内皮细胞上的相关因子具有上调作用,促进内皮细胞以及白细胞活化,有助于炎性细胞聚积,促进炎症递质释放[23]。研究结果显示,TNF-α可参与高血压患者发病,与IMT呈正相关关系,IMT联合TNF-α有利于提高评估高血压患者动脉粥样硬化程度,为制定干预措施,阻止病情恶化提供参考。
研究结果证实,IMT值越高,患者IL-18、hs-CRP、TNF-α水平增加越明显。Pearson直线相关性分析研究,患者血清IL-18、hs-CRP、TNF-α与高血压患者颈动脉IMT呈正相关,说明 IL-18、hs-CRP、TNF-α水平可间接反映高血压患者动脉粥样硬化程度。
综上所述,随着IMT增加,初诊原发性高血压患者外周血的 IL-18、hs-CRP、TNF-α水平逐渐升高,IMT与血清IL-18、hs-CRP、TNF-α呈明显的相关性,可见IL-18、hs-CRP、TNF-α参与高血压患者颈动脉粥样硬化发展过程,可作为评估动脉粥样硬化程度的有效指标。

