超声辅助提取花生红衣中原花青素
黄武,李亚杰,亢帅,蒲云峰,侯旭杰*,郭芹,王强*
(1.塔里木大学生命科学学院,南疆特色农产品深加工兵团重点实验室,新疆 阿拉尔 843300;2.中国农业科学院农产品加工研究所,北京 100193)
花生红衣是花生精深加工过程中的副产物,产量较大,除用作动物饲料以外,在其他加工领域未得到有效利用。经研究发现,花生红衣中主要成分有水分(5%~9%)、蛋白质(11%~18%)、脂肪(10%~14%)、粗纤维(37%~42%)、碳水化合物(12%~28%)、灰分(8%~12%)、单宁(7%)以及多种色素和硒、锌、钙、钾、铁等元素[1-2]。花生红衣中多酚类物质含量为90 mg/g~125 mg/g,包括白藜芦醇、原花青素、酚酸等物质[3-4],其中原花青素是在热、酸条件下能产生花色素的一种无色物质。原花青素是一种很强的抗氧化物质,它在人体内的抗氧化能力是维生素C的20倍,维生素E的50倍,可用作安全无毒的新型天然抗氧化剂[7-8]。若能充分利用花生红衣中的原花青素,将会获得较可观的经济效益[9]。
利用超声波、微波破碎植物细胞壁,可有效提升植物中功效成分的提取效率[10-12]。尤其是超声辅助提取技术在植物有效成分提取中有较为广泛的应用,在花生红衣的活性成分提取方面也有相应的研究,王菲等[13]、陈洋[14]、童愈元[15]、管文荻[16]用超声辅助提取花生红衣中原花青素;林樱姬等[17]、任虹等[18]用超声辅助技术对花生红衣中多酚进行提取,并取得较好的结果,证明此技术适用于花生红衣活性成分的提取。因此,本研究在超声辅助提取的基础上,结合水浴浸提以提高提取效果,并用正交试验优化原花青素的提取工艺,为花生红衣这一副产物的高值化开发利用提供一定参考依据。
1 材料与方法
1.1 材料与试剂
花生红衣:产地为山东,品种为四粒红;无水乙醇、甲醇:天津市北联精细化学品开发有限公司;香草醛(纯度≥99%):天津市科密欧化学试剂有限公司;4%香草醛-甲醇溶液:精确称取4.00 g香草醛用甲醇溶解并在100 mL容量瓶中定容;盐酸:四川西陇化工有限公司;原花青素标准品(纯度≥98%):合肥博美生物公司。试剂均为分析纯。
1.2 仪器与设备
水浴恒温振荡器(SHA-B):江苏金怡仪器科技有限公司;旋转蒸发器(RE-3000A):上海亚荣生化仪器厂;数控超声波清洗器(SB-5200DT):宁波新芝生物科技股份有限公司;循环水式多用真空泵(SHB-Ⅲ):郑州长城科工贸有限公司;微型旋涡混合仪(WH-3):上海沪西分析仪器厂有限公司;数显恒温磁力搅拌水浴锅(EMS-20):金坛市科顺仪器厂;电子天平(LE203E/02):梅特勒-托利多仪器(上海)有限公司;高速冷冻离心机(TGL-20br):上海安亭科学仪器厂;紫外可见光分光光度计(UV-2450):岛津公司。
1.3 方法
1.3.1 花生红衣中原花青素的提取方法
称取干燥花生红衣粉碎成粉末状。用适量石油醚对红衣粉末进行脱脂:常温下浸泡24 h,间歇搅拌,抽滤、烘干,得到花生红衣脱脂粉末。精确称取1.0 g脱脂后的花生红衣粉末与乙醇溶液(体积分数40%~80%)按比例[1∶20(g/mL)~1∶60(g/mL)]混合,在 30 ℃~70 ℃下超声处理10 min~50 min。参考王菲等[13]的方法,将超声处理后的样液转入30℃~70℃水浴浸提30 min~70 min。然后将得到的溶液在4 000 r/min条件下离心10min,将上层澄清液取出,用无水甲醇定容至100mL。从中吸取1 mL样液,用无水甲醇定容至10 mL,得到原花青素样品待测液[19-22]。数据均为3次平行试验所得平均值。
1.3.2 原花青素提取率的测定
1.3.2.1 原花青素的测定方法
盐酸-香草醛法测定原花青素:准确吸取3 mL香草醛-甲醇溶液、1.5 mL浓盐酸于试管中,再吸取样品液0.5 mL,迅速混匀,在避光条件下进行20 min显色反应,测定吸光度[23]。
1.3.2.2 原花青素最大吸收波长的确定
精确称取原花青素标准品配制成浓度为0.1mg/mL标准溶液,按照盐酸-香草醛法的条件反应后,在紫外可见分光光度计下进行光谱扫描,选择最大吸收波长。
1.3.2.3 标准曲线的绘制
精确称取50 mg原花青素标准品,用无水甲醇于50 mL容量瓶定容,得到1 mg/mL的标准液,之后分别稀释成 0.5、0.4、0.3、0.2、0.1 mg/mL(注:如由 1 mg/mL得到0.1 mg/mL稀释液,取1 mL 1 mg/mL标准液,再加入9 mL无水甲醇)这5个梯度,准确量取0.5 mL各梯度标准品溶液,分别加入含3 mL香草醛-甲醇溶液、1.5 mL浓盐酸的混合液中,快速混匀,避光条件下反应20 min,于500 nm波长下测定吸光度,空白对照为无水甲醇,绘制标准曲线。
1.3.2.4 原花青素提取率的计算
适当稀释原花青素提取液,按照1.3.2.1中方法测定吸光度。根据标准曲线函数计算出样品中原花青素的质量浓度(mg/mL),按照公式(1)计算出原花青素的提取率。
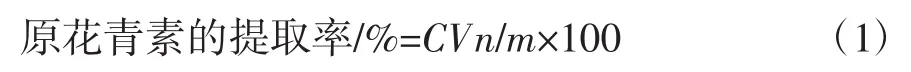
式中:C为原花青素质量浓度,mg/mL;V为提取液体积,mL;n为稀释倍数;m为花生红衣粉末质量,g。
1.4 正交试验优化花生红衣中原花青素提取工艺
在单因素试验的基础上,对料液比、乙醇体积分数、超声温度、超声时间进行四因素三水平正交试验,选择最佳工艺,因素水平如表1所示。

表1 正交试验L9(34)因素水平Table 1 Factor and levels of the orthogonal experiment L9(34)
2 结果与分析
2.1 最大吸收波长选择
在紫外可见分光光度计下进行光谱扫描,原花青素最大吸收波长光谱图见图1。

图1 原花青素最大吸收波长光谱图Fig.1 Spectrogram of the maximum absorption wavelength of procyanidin
如图1所示,选择出最大吸收波长为500 nm。
2.2 标准曲线绘制
根据原花青素标品所测结果得出标准曲线如图2所示。
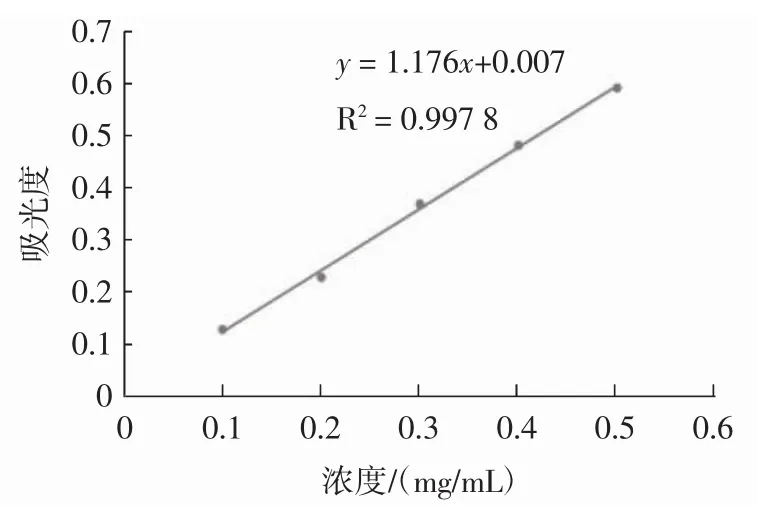
图2 原花青素标准曲线Fig.2 Standard curve of procyanidins
原花青素其标准曲线函数为:y=1.176x+0.007,相关系数R2=0.997 8。式中:x为样品中原花青素质量浓度,mg/mL;y为吸光度。
2.3 单因素试验
2.3.1 水浴温度对原花青素提取率的影响
称取1 g脱脂花生红衣粉末,固定料液比1∶50(g/mL)、超声时间 30 min、超声温度 30 ℃,乙醇体积分数60%,水浴时间50 min,考察水浴温度对原花青素提取效果的影响,见图3。

图3 水浴温度对原花青素提取率的影响Fig.3 Influence of water bath temperature on extraction rate of procyanidins
如图3所示,在30℃~50℃时提取率随温度升高而上升,50℃之后随温度上升提取率几乎呈直线降低,原因可能是当温度超过一定数值时,原花青素结构受到破坏,使提取率下降,且水浴温度越高所需能耗越大。因此,最适水浴温度选择为50℃。
2.3.2 水浴时间对原花青素提取率的影响
称取1 g脱脂花生红衣粉末,固定料液比1∶50(g/mL)、超声时间 30 min、超声温度 30℃,乙醇体积分数60%,水浴温度60℃,考察水浴时间对原花青素提取效果的影响,见图4。
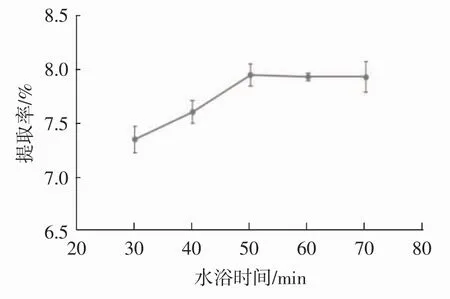
图4 水浴时间对原花青素提取率的影响Fig.4 Influence of water bath time on extraction rate of procyanidins
如图4所示,水浴时间在30 min~50 min期间,提取率随时间增加而增加,时间达到50 min后,提取率随时间变化不显著,且略有下降趋势。其原因可能是在水浴时间达到50 min后,原料中原花青素提取达到上限,因此提取率不随时间增长而增长,同时浸提液中原花青素在60℃下发生少量分解使提取率略有降低。综上所得,水浴时间为50 min最佳。
2.3.3 乙醇体积分数对原花青素提取率的影响
称取1 g脱脂花生红衣粉末,固定料液比1∶50(g/mL)、超声时间 30 min、超声温度 30 ℃、水浴温度60℃、水浴时间50 min,考察乙醇体积分数对原花青素提取效果的影响,见图5。
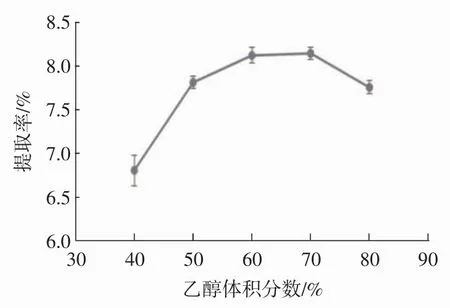
图5 乙醇体积分数对原花青素提取率的影响Fig.5 Effcect of ethanol concentration on the extraction rate of proanthocyanidins
如图5所示,随着乙醇体积分数增高,原花青素提取率呈上升趋势,在体积分数达到70%后,提取率开始降低。可能是由于随乙醇体积分数增加,极性增大,原料中醇溶性和脂溶性成分溶出率增加,使原花青素与乙醇-水分子结合率降低,从而使原花青素提取率降低。另外,高浓度乙醇使原料中蛋白质等生物大分子变性沉淀,使原花青素溶出阻力增大,降低提取效果。体积分数在60%和70%时,提取率无显著差异,综合考虑,确定乙醇体积分数为60%。
2.3.4 料液比对原花青素提取率的影响
称取1 g脱脂花生红衣粉末,固定乙醇体积分数60%、超声时间30 min、超声温度30℃、水浴温度60 ℃、水浴时间50min,考察料液比1∶20、1∶30、1∶40、1∶50、1∶60(g/mL)对原花青素提取效果的影响,见图6。
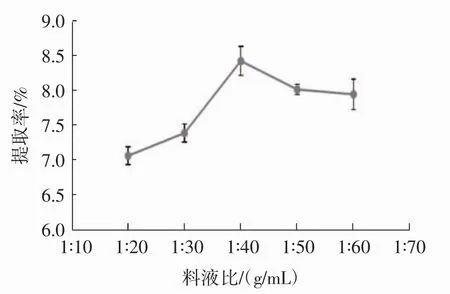
图6 料液比对原花青素提取率的影响Fig.6 Effcect of solid-liquid ratio on the extraction rate of proanthocyanidins
如图6所示,原花青素提取效果随料液比的增加呈先增大后降低趋势,料液比为1∶40(g/mL)时提取率最高。随着溶剂含量上升,溶质不断从原料中析出,当料液比达到1∶40(g/mL)时,溶质析出呈最高水平,继续增加溶剂则使原料中各种杂质析出,使原花青素提取率下降,另外,原花青素含量一定时,溶剂体积增加使原花青素在溶液中浓度下降,使得提取率降低。因此,选择料液比为1∶40(g/mL)最佳。
2.3.5 超声温度对原花青素提取率的影响
称取1 g脱脂花生红衣粉末,固定料液比1∶40(g/mL)、乙醇体积分数60%、超声时间30 min、水浴温度60℃、水浴时间50 min,考察超声温度30、40、50、60、70℃对原花青素提取效果的影响,见图7。
如图7所示,原花青素提取率随温度变化趋势为先升高后降低,在40℃时达到最高。其原因可能是,温度升高,分子动能增大,原花青素快速大量溶出;温度过高,部分原花青素被破坏,使提取率降低。由此确定最佳超声温度为40℃。
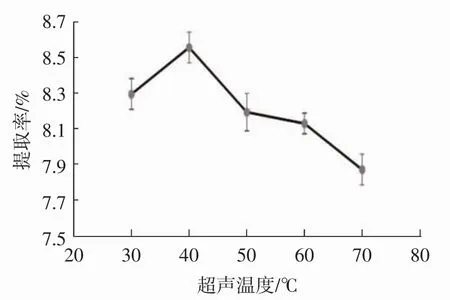
图7 超声温度对原花青素提取率的影响Fig.7 Effect of ultrasonic temperature on the extraction rate of proanthocyanidins
2.3.6 超声时间对原花青素提取率的影响
称取1 g脱脂花生红衣粉末,固定料液比1∶40(g/mL)、乙醇体积分数60%、超声温度40℃、水浴温度 60 ℃、水浴时间 50 min,考察超声时间 10、20、30、40、50 min对原花青素提取效果的影响,见图8。
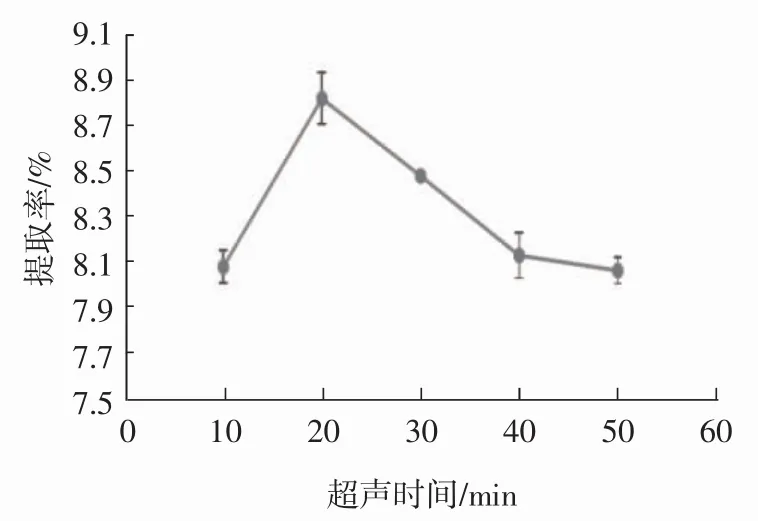
图8 超声时间对原花青素提取率的影响Fig.8 Effcect of ultrasonic time on the extraction rate of proanthocyanidins
如图8所示,原花青素提取率在超声时间为20min时达到最高,此时原花青素已基本提取完全。超声处理时间过长,可能导致原花青素结构被破坏,同时,原花青素长时间暴露空气中易受氧化,使提取率下降。且长时间超声处理,增加能耗,延长提取周期,增加提取成本,因此20 min为最佳超声时间。
2.2 正交试验优化提取工艺
在单因素试验的基础上,对料液比、乙醇体积分数、超声温度和超声时间4个因素进行四因素三水平正交试验。探究各因素对原花青素提取效果的影响情况,并对提取条件进行优化。正交试验结果如表2、表3所示。
如表3所示,F检验结果表明,4个因素对原花青素提取率的影响都不显著。究其原因可能是本例试验误差过大且误差自由度小(仅为2),使检验的灵敏度低,从而掩盖了考察因素的显著性。由于各因素对提取率的影响都不显著,因此不必再进行各因素水平间的多重比较。可直接进行直观分析。直观分析法又称极差分析方法,通过比较各因素水平极差的大小,确定各因素主、次地位及最佳水平,极差越大,对原花青素提取率的影响越大[24]。如表2所示,极差分析结果表明,在ABCD这4个因素中,影响主次为C>D>A>B,说明超声时间(C因素)对原花青素提取率的影响最大,占影响因素43.38%,其次为乙醇体积分数(D因素),占影响因素28.68%,料液比(A因素)和超声温度(B因素)影响较少,分别占17.65%和10.29%。最优条件为 A3B1C1D2,即料液比为 1∶45(g/mL)、超声温度 35℃、超声时间15 min、乙醇体积分数60%。按照最优工艺条件进行验证试验,经过3次平行试验得到原花青素提取率平均值为9.07%。与正交试验最优组结果相比有所增加,因此所得最佳提取工艺具有参考价值。

表2 正交试验结果直观分析Table 2 Results and analysis of orthogonal test
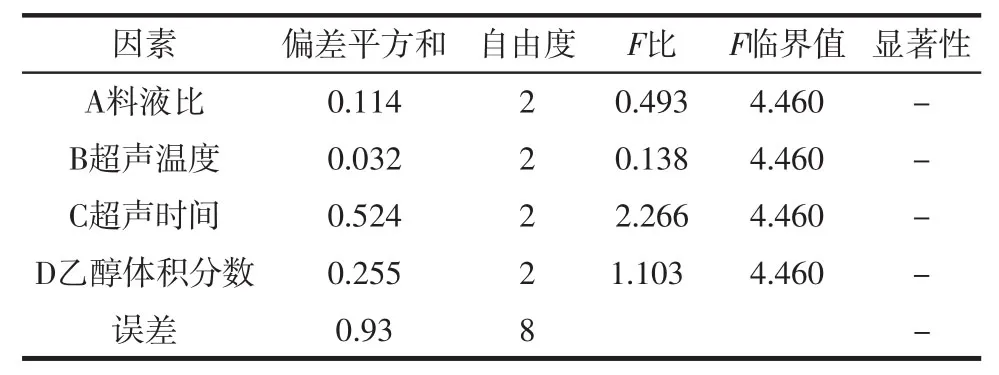
表3 各因素结果方差分析Table 3 Variance analysis of the results of various factors
3 结论
本研究在经过超声波辅助提取后,再利用水浴浸提进一步提高提取效果,并用正交试验对原花青素的提取工艺进行优化。综合单因素试验和正交试验结果,最终确定各因素对原花青素提取效果的影响主次依次为:超声时间>乙醇体积分数>料液比>超声温度;最佳提取条件为:超声时间15 min、乙醇体积分数60%、料液比 1∶45(g/mL)、超声温度 35℃、水浴温度50℃、水浴时间50 min。在此条件下,原花青素最大提取率为9.07%,试验结果较单独使用超声提取或水浴浸提皆有所提高。本研究为花生红衣这一副产物高质化利用提供一定参考依据,具有较好的应用前景。

