南极磷虾油中虾青素分子种组成及其消化吸收特性研究
周庆新,黄子倩,谷彩霞,张志轩,李 璐,周瑾若,李玉环
(1.日照职业技术学院海洋工程学院,山东日照 276826;2.日照市海洋食品资源高效利用重点实验室,山东日照 276826;3.山东省海洋甲壳类资源综合利用工程技术研究中心,山东日照 276826;4.西北农林科技大学食品科学与工程学院,陕西杨凌 712100)
南极磷虾油是以南极磷虾为原料提取得到的复合功能脂质产品[1],具有降脂[2]、抗炎[3]、提高学习和认知能力[4]等多种功效。其中富含的重要功能伴随物—虾青素赋予了南极磷虾油特有的深红色外观,被誉为“海洋中的红宝石”,开发应用潜力非常大[5]。研究表明,虾青素具有卓越的抗氧化活性,其抗氧化能力是其他类胡萝卜素(如玉米黄质、叶黄素、番茄红素、β-胡萝卜素)的10 倍以上,是α-生育酚的100倍以上[6]。南极磷虾油中虾青素的含量范围为40~5000 mg/kg,其含量主要取决于磷虾原料、磷虾油提取和纯化精制方法等[7−9]。目前,有机溶剂法提取南极磷虾油已有大量报道,且因其成本低、工艺简单而被广泛应用于产业化[10]。但现有研究多以磷虾油得率为指标进行工艺条件优化,在富虾青素与富磷脂南极磷虾油的提取溶剂选择方面却鲜有报道。
生物可接受率(Bioaccessibility)表示活性成分从食品中释放出来可供肠细胞吸收的最大量,是评价功能因子生物学效价的重要指标[11]。虾青素作为一种脂溶性类胡萝卜素,在摄取后能否发挥生物活性的关键因素在于其被吸收利用或储存在人体中的比例。研究显示,类胡萝卜素的生物可接受率主要受分子结构、在食物中的物理结合方式、膳食中脂肪含量以及胃肠道中胰酶和胆盐的含量等因素影响[12]。南极磷虾中虾青素分子种组成复杂多样,且其中富含磷脂、多不饱和脂肪酸等多种脂质成分[13]。目前,对于南极磷虾油中虾青素的消化吸收情况尚缺乏直观系统的研究数据来阐明。因此,在探究富虾青素磷虾油提取溶剂选择和分子种组成基础上,研究磷虾油中虾青素在模型动物体内的消化吸收行为,对磷虾油的应用开发具有重要意义。
综上所述,本实验通过测量分析虾青素含量、磷脂含量和磷虾油得率等指标,综合考察不同溶剂体系对磷虾油提取效果的影响,优选体系条件;然后对此优选体系条件下制备的磷虾油中虾青素分子种组成进行了定性定量表征;并选取ICR 小鼠作为试验模型研究南极磷虾油中虾青素在其体内的消化、排泄和生物可接受率情况,以期为南极磷虾油在功能食品中的科学应用提供数据支持。
1 材料与方法
1.1 材料与仪器
SPF 级ICR 雄性小鼠 体重20~25 g,北京维通利华实验动物技术有限公司(许可证号:SCXK(京)2016-0011),实验开始前自由饮水摄食,适应性饲养一周;南极磷虾粉 山东辰亚生物科技有限公司提供;雨生红球藻虾青素油 总虾青素含量≥10.0%,云南爱尔发生物技术股份有限公司;全反式虾青素标准品(all-trans-astxanthin) 纯度为95.8%±0.5%,德国Dr.Ehrenstorfer 公司;甲基叔丁基醚(MBTE) 色谱纯,Burdick &Jackson;甲醇 色谱纯,德国Merck 公司;无水乙醇、丙酮、氯仿、正己烷 分析纯,国药集团;玉米油(脂肪酸组成为:15wt%饱和脂肪酸,30.8wt%单不饱和脂肪酸,54.1wt%多不饱和脂肪酸) 山东西王食品有限公司;小鼠基础饲料 北京科澳协力饲料有限公司。
YMC-Carotenoid-C30色谱柱(4.6 mm×250mm,5μm) 日本YMC 株式会社;Millipore Q 纯水机 美国Millipore 公司;MS 3B-S25 型电动高速匀浆器 德国IKA 公司;HH-4 数显恒温水浴锅 国华电器有限公司;CP100MX 型高速冷冻离心机 日本日立公司;SD-50 型制冰机 上海雪人机电设备有限公司;DW-86L486 型立式超低温保存箱 青岛海尔特种电器有限公司;N-EVAP1 12 氮吹仪 美国Organomation Associates 公司;UV-800PC-DS2 型紫外可见分光光度计 上海美谱达仪器有限公司;1260 型液相色谱仪,配二极管阵列检测器(DAD) 美国Agilent 公司;G6410B 三重四极杆质谱仪,配大气压化学电离源(APCI) 美国Agilent 公司;KQ-300E超声波清洗机 昆山市超声仪器有限公司。
1.2 实验方法
1.2.1 南极磷虾油的提取工艺 通过前期预实验,确定南极磷虾油的提取方法如下:准确称取100.00 g(精确至0.01 g)南极磷虾虾粉于三角瓶,加入2000 mL提取溶剂,在冰浴(0 ℃)条件下超声辅助提取90 min,提取结束后过滤,收集提取液,经真空旋转蒸发浓缩至无溶剂流出,得南极磷虾油。
1.2.2 不同提取溶剂对南极磷虾油提取效果的影响 按照1.2.1 南极磷虾油的提取方法,分别选择95%乙醇-水、无水乙醇、10%正己烷-乙醇、20%正己烷-乙醇、40%正己烷-乙醇、60%正己烷-乙醇、80%正己烷-乙醇、正己烷作为提取溶剂制备南极磷虾油。测定其中总虾青素、磷脂含量和虾油得率。
1.2.2.1 样品中总虾青素含量的测定 根据Zhou 等[14]研究报道,本试验可通过在489 nm 下测定不同样品溶液的吸光度值来计算出总虾青素的含量。具体测定方法:称取南极磷虾油样品15.00 mg(精确至0.01 mg),置于带有刻度的具塞玻璃离心管中,并向离心管中加入二甲基亚砜和醋酸的混合溶液(量取2.5 mL 醋酸溶液,将其添加到100 mL 二甲亚砜溶液中,得到二甲亚砜和醋酸混合溶液)2 mL,摇匀后,于70 ℃水浴条件下震荡保温5 min,然后将液体转移至100 mL 容量瓶中,用二甲亚砜和醋酸混合溶液定容至刻度,测定其在489 nm 波长下吸光度值,记为A。以二甲基亚砜和醋酸的混合溶液来做空白。按式(1)计算样品中的总虾青素含量。

式中:X 为虾青素的总含量,mg/kg;A489为样品在489 nm 下的吸光度值;V 为提取样品的体积,mL;A 为稀释倍数;1908 为消光系数;m 为样品质量,g。
1.2.2.2 样品中磷脂含量的测定 抗坏血酸-钼蓝比色法。参照孙甜甜[15]测定方法,准确称取2.00 g(精确至0.01 g)样品,加25 mL 的浓硝酸与高氯酸混合溶液(4:1,V/V)浸泡,冷消化2 h,再进行灰化,在抗坏血酸存在的条件下与钼酸铵反应生成钼蓝,测定其在650 nm 下的吸光度,通过标准曲线法来测算磷虾油中磷脂的含量。磷脂的标准曲线方程为:Y=3.707X−0.026,r=0.9999。
1.2.2.3 样品南极磷虾油的得率 采用称重法计算南极磷虾油的提取得率,得率按照式(2)计算:

式中:M1为浓缩后所得南极磷虾油的重量,g;M2为南极磷虾虾粉重量,g。
1.2.3 南极磷虾油中虾青素分子种组成研究 参照文献[14]报道方法,制备纯化南极磷虾油中的总虾青素。称取优选条件下制备的南极磷虾油100.00 mg(精确至0.01 mg),加5 mL 正己烷重新溶解,使用正己烷活化SEP-PAK 正相硅胶柱进行纯化。取1 mL溶解液上样,依次用正己烷/丙酮(100/0→95/5→90/10→0/100,V/V)进行洗脱纯化,并利用薄层层析(TLC)和HPLC 对洗脱组分进行检测,收集并合并虾青素双酯、虾青素单酯和游离态虾青素洗脱液,氮吹后再用3 mL 丙酮复溶,即得纯化后的总虾青素样品溶液,经0.22 μm 滤膜过滤,采HPLC-MS 对其中虾青素分子种组成进行定性定量分析。
HPLC 条件:流动相A:甲醇;流动相B:甲基叔丁基醚;线性梯度洗脱:0~15 min:B 为0%;15~22 min:B 由0%升至为22%;22~48 min:B 维持在22%;48~56 min:B 由22%升至40%;56~76 min:B 为40%。流速为1.0 mL/min;检测波长:476 nm;柱温:35 ℃;DAD 全波长扫描范围:200~800 nm;进样量为20 μL。
MS 条件:对质谱主要参数进行了优化,最终确定APCI 源,正离子模式,一级质谱的质量扫描范围为m/z 300~1400。雾化气压力 60 psi;干燥气(N2)流速 5 L/min,干燥气温度350 ℃,离子源温度450 ℃。毛细管压力3.7 kV,电晕电流4 μA。二级质谱采用母离子扫描及子离子扫描模式,碎裂电压100 V,碰撞能量25 eV,质量扫描范围 m/z 100~1500。质谱数据处理采用Mass Hunter 软件,利用解卷积(分子特征提取算法)功能,提取色谱峰信息并处理。
1.2.4 南极磷虾油中虾青素在小鼠体内消化吸收情况测定
1.2.4.1 南极磷虾油灌胃液的制备 准确称量一定量(0.01 mg)的南极磷虾油样品,将其分散于适量的玉米油中,在冰浴和氮气保护下超声波震荡5 min,使其充分分散均匀,按照后续试验设定的灌胃剂量和灌胃体积,分别配制成浓度为10、30 和50 mg/mL 的南极磷虾油-玉米油灌胃液。
1.2.4.2 小鼠粪便中虾青素排泄情况试验 试验小鼠按照体重随机分为2 组,分别为南极磷虾油组和对照组,每组6 只小鼠。饲料和水自由摄取,适应喂养一周,实验前,禁食不禁水10 h。南极磷虾油组试验小鼠按照南极磷虾油300 mg/kg·体重的剂量和10 mL/kg·体重的灌胃体积灌胃1.2.4.1 方法制备的灌胃液,对应虾青素的当量灌胃剂量为0.078 mg/kg·体重;为考察灌胃南极磷虾油是否影响试验小鼠的排便量,进而影响虾青素的排泄情况,特设立对照组试验,对照组按照10 mL/kg·体重灌胃体积灌胃玉米油。灌胃结束后正常进食进水,并分别于灌胃后2、4、6、8、10、12、14、16、18、20、22 和24 h 收集对照组和南极磷虾油组小鼠粪便,真空冷冻干燥,分别称量,计算各试验组排便量;称重后,将南极磷虾油组小鼠粪便进行研磨,−80 ℃冰箱保存,利用HPLC 分析其中虾青素存在形态及含量。
1.2.4.3 灌胃剂量对南极磷虾油中虾青素生物可接受率的影响试验 考虑到安全性与有效性,根据目前南极磷虾油的日推荐服用量3 g 进行相应换算,分别制定100、300 和500 mg/kg·体重三个灌胃剂量。实验时,将试验小鼠按照体重随机分为4 组,每组6 只小鼠。饲料和水自由摄取,适应喂养一周,实验前,禁食不禁水10 h。分别按照南极磷虾油0 mg/kg·体重(对照组)、100 mg/kg·体重(低剂量组)、300 mg/kg·体重(中剂量组)和500 mg/kg·体重(高剂量组)的剂量和10 mL/kg·体重的灌胃体积灌胃1.2.4.1 方法制备的灌胃液,对应虾青素当量灌胃剂量分别为0、0.026、0.078 和0.13 mg/kg·体重,灌胃结束后正常进食进水。收集24 h 内的小鼠粪便,真空冷冻干燥,称量,研磨,−80 ℃冰箱保存,利用HPLC分别测定其中总虾青素含量。
1.2.4.4 小鼠粪便中总虾青素的检测及生物可接受率计算方法 将粪便样品充分研磨并混匀,精确称取60 mg 于15 mL 离心管中,加入3 mL 氯仿/甲醇溶液(2:1,V/V),超声5 min 后静置10 min,然后以3500 r/min 离心30 min,小心吸取上层有机相,重复提取3 次并合并提取液,氮吹后用1 mL 甲醇/MBTE(1:1,V/V)复溶,使用0.22 μm 有机膜过滤2 次后按1.2.3 中色谱条件进行HPLC 分析,并根据标准曲线计算总虾青素量及各形态虾青素相对含量。
参照Failla 等[16]学者提出计算生物可接受率的方法,生物可接受率的计算公式如下:

式中:灌胃量为灌胃样品中总虾青素量,mg;排泄量为灌胃后24 h 内粪便中总虾青素量,mg。
1.2.5 南极磷虾油和雨生红球藻藻油中虾青素的生物可接受率比较 试验小鼠按照体重随机分为3 组,每组6 只小鼠。饲料和水自由摄取,适应喂养一周,实验前,禁食不禁水10 h。以20%(V/V)正己烷-乙醇溶剂提取的南极磷虾油和雨生红球藻藻油为试验样品,按照1.2.4.1 的方法制备灌胃液,使灌胃液中的总虾青素当量浓度为0.06 mg/mL。按照10 mL/kg·体重的灌胃体积灌胃样品,灌胃结束后正常进食进水。收集24 h 内的小鼠粪便,真空冷冻干燥,称量,研磨,−80 ℃冰箱保存,利用HPLC 分别测定其中总虾青素含量,按照1.2.4.4 方法计算虾青素的生物可接受率。
1.3 数据处理
实验数据以平均值±SD 表示,采用SPSS 19.0软件进行单因素方差One-way ANOVA 分析,并采用Tukey’s 法进行两两比较分析,以P<0.05 为显著水平。
2 结果与分析
2.1 溶剂组成对南极磷虾油中虾青素提取效果的影响
南极磷虾中虾青素类化合物属于一类低极性脂溶类胡萝卜素,依据提取溶剂与提取目标物相似相溶的原理,分别考察了8 种溶剂体系对南极磷虾油提取效果的影响情况,如表1 所示。
鉴于目前行业把虾青素和磷脂含量作为衡量南极磷虾油品质的重要指标,本试验在设计时,同时考察了不同提取溶剂体系对虾青素、磷脂和得率的影响情况。由表1 可知,60%正己烷-乙醇提取所得的南极磷虾油中虾青素含量最高,约为268.6 mg/kg。而20%(V/V)正己烷-乙醇溶剂提取得到的南极磷虾油中磷脂含量最高,约为44.2%,显著高于其他试验组(P<0.05)。据Lambertsen 等[17]报道,南极磷虾油中虾青素主要以酯化态形式存在,其含量约占总虾青素的90%以上。由于酯化态虾青素分子与脂肪酸相链接,使其分子整体极性低于游离态虾青素。故根据相似相溶原理和表1 结果可以得出,在正己烷体积分数≤60%(V/V)范围内,随着正己烷含量的增加,溶剂的整体极性降低,提取得到的南极磷虾油中虾青素的含量不断升高,且以60%正己烷-乙醇提取所得的南极磷虾油中虾青素含量最高,而当正己烷体积分数为80%和100%时,提取得到的南极磷虾油中虾青素的含量有所降低。在试验过程中值得关注的是,当提取溶剂中正己烷体积分数高于80%(V/V)时,提取液会出现一定程度的分层现象,这可能是因为南极磷虾虾粉原料中所含的部分水分所致,高浓度正己烷体系与水分不互溶,提取时溶剂难以充分渗透到虾粉原料内部,致使虾青素类化合物无法被有效的浸提出来[18−19]。另外,表1 结果显示,95%乙醇-水溶剂提取得率较高,而正己烷溶剂的提取率显著低于其它试验组(P<0.05),原因可能是95%乙醇-水溶剂将南极磷虾虾粉中部分极性相对较高的物质提取出来,而正己烷仅能提取低极性脂[20]。试验过程也发现,95%乙醇-水提取得到的南极磷虾油粘稠,流动性差,杂质较多。综上所述,该部分试验结果可以为南极磷虾油的定向化提取提供参考,行业可根据产品对虾青素和磷脂含量的不同需求,选择合适的提取溶剂组成进行南极磷虾油的提取。

表1 溶剂组成对南极磷虾油中总虾青素、磷脂含量以及虾油得率的影响Table 1 Effects of solvents composition on astaxanthin,myelin content and extraction of astaxanthin
2.2 南极磷虾油中虾青素分子种组成分析
为了进一步分析制得南极磷虾油中虾青素的分子种组成,选用60%(V/V)正己烷-乙醇提取得到的南极磷虾油为样本,经HPLC-MS 分析检测和峰面积归一化处理,得到其中虾青素各分子种组成及相对含量如表2 所示,采用60%(V/V)正己烷-乙醇提取所得南极磷虾油中虾青素主要以单酯和双酯形态存在,酯化态虾青素约占虾青素总量的98.38%,游离态虾青素仅占1.62%。其中虾青素双酯共鉴定出12 种,总体相对含量达73.5%,远超虾青素单酯及游离态虾青素;虾青素单酯共鉴定出5 种,相对含量为24.88%。从虾青素酯的分子种组成来看,在南极磷虾油中与虾青素相链接脂肪酸主要为C14:0、C16:0、C16:1、C18:1、C20:0、C20:5和C22:6,该分析结果与Grynbaum等[21]研究相吻合。另外需要指出的是,前期Lambertsen 等[17]研究报道的南极磷虾中虾青素双酯、虾青素单酯和游离态虾青素相对含量分别为51%、43%和6%,其中酯化态虾青素的相对百分含量约为94%。而本试验结果中酯化态虾青素的相对百分含量为98.3%,略高于Lambertsen 等[17]的报道。这主要是因为酯化态虾青素的分子极性要低于游离态虾青素,根据相似相溶原理,随着提取溶剂中正己烷比例的增大,溶剂整体极性降低,对酯化态虾青素的亲和性逐渐增强,而对游离态虾青素的亲和性逐渐下降,当提取体系中正己烷-乙醇体积分数到达60%时,相比游离态虾青素而言,更多的酯化态虾青素被提取出来,与Foss 等[22]和 Yamaguchi 等[23]的研究报道相一致。
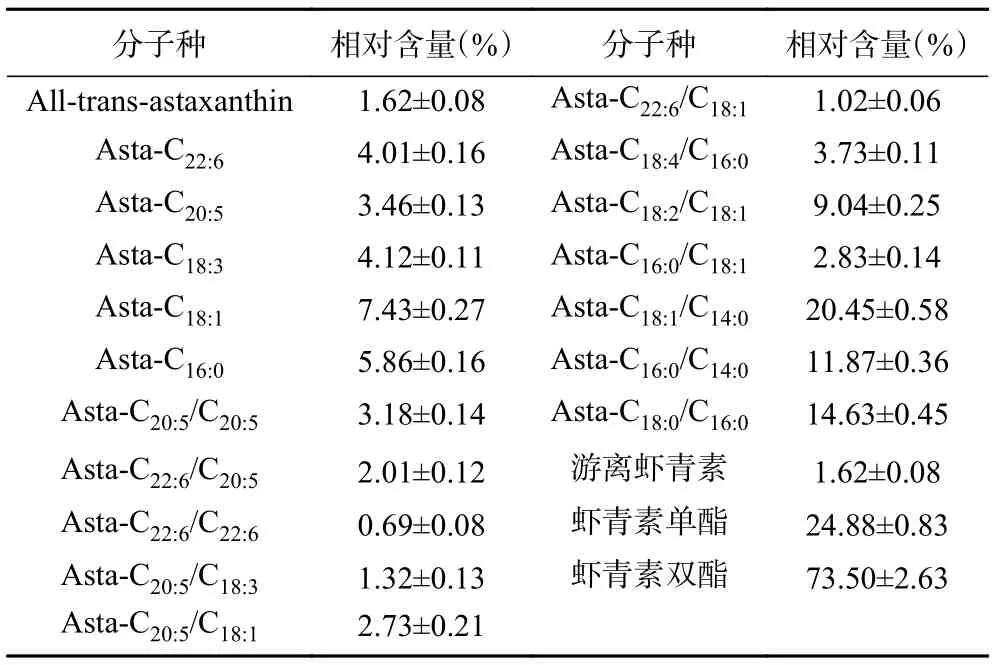
表2 南极磷虾油中虾青素各分子种组成及相对含量Table 2 Composition and relative content of astaxanthin in Antarctic krill oil
2.3 南极磷虾油中虾青素在小鼠体内消化吸收情况
2.3.1 小鼠粪便中虾青素的分子形态组成随时间变化 为考察南极磷虾油中虾青素在小鼠体内的消化吸收过程,该部分考察了灌胃南极磷虾油后,不同时间点小鼠粪便中游离态虾青素、虾青素单酯、虾青素双酯相对含量的变化情况,结果如图1 所示。

图1 小鼠粪便中虾青素分子形态随时间的变化Fig.1 Morphological changes of astaxanthin in mouse feces
图1 试验结果表明,灌胃后2~4 h 南极磷虾油中虾青素在小鼠体内开始代谢。虾青素双酯在4 h达到最大值,达64.54%,随后其相对含量迅速下降,至14 h 已不足2%,24 h 时仅有0.61%;虾青素单酯自2 h 开始不断上升至8 h 达到最大值,随后略有下降,但14 h 时又出现回升并保持相对稳定;游离态虾青素自2 h 开始相对含量逐渐上升,至12 h 达到最大值,随后略有下降并保持相对稳定。自14 h 开始小鼠粪便中虾青素主要以游离态和虾青素单酯形式存在,且相对含量差别不大。同时,在试验过程中发现,南极磷虾油组和对照组小鼠在排便量随时间变化方面无显著差异(图2 所示),说明灌胃南极磷虾油对试验小鼠的排便量无明显影响。

图2 不同试验组24 h 排便量比较Fig.2 Faeces amount comparison of different group in 24 h
据前述试验结果可知,南极磷虾油中虾青素主要以双酯形式存在,其次为单酯,游离态虾青素含量很低。故可以推测,虾青素双酯在小鼠体内被分解转化为虾青素单酯和游离态虾青素进而被吸收利用,该结果与前期研究报道的雨生红球藻虾青素酯消化吸收特性结果一致[24−25]。
2.3.2 南极磷虾油中虾青素的生物可接受率 运用Failla 等[16]提出的生物可接受率概念,评价不同灌胃剂量条件下南极磷虾油中虾青素的生物利用情况。图3 为灌胃不同剂量南极磷虾油后,根据计算公式得到的南极磷虾油中虾青素的生物可接受率。结果显示,低、中、高剂量试验组中,南极磷虾油虾青素的生物可接受率差异不显著,数值上约为74%。这可能系试验时按照目前南极磷虾油的推荐日入量分别设计了100、300 和500 mg/kg 体重三个灌胃剂量组,而南极磷虾油总虾青素含量约为260 mg/kg 虾油,故三个剂量组对应的虾青素当量灌胃剂量分别仅约为0.026、0.078、0.13 mg/kg 体重,剂量相对较低,从而致使三个剂量组在生物可接受率方面表现出不明显差异,该结果与周庆新等[24]研究报道一致。

图3 不同试验组虾青素生物可接受率比较Fig.3 Bioaccessibility comparison of astaxanthin in different test group
2.4 南极磷虾油和雨生红球藻藻油中虾青素的生物可接受率比较
根据Capelli 等[26]研究推荐的常规成人每日虾青素摄入剂量为4 mg,换算到相对应的小鼠灌胃剂量为0.6 mg/kg 体重。图4 为灌胃南极磷虾油源虾青素与雨生红球藻源虾青素后,得到的不同试验组虾青素的生物可接受率比较图。结果显示,南极磷虾油源虾青素的生物可接受率明显高于雨生红球藻源虾青素,约为雨生红球藻源虾青素生物可接受率的1.25 倍。据研究报道[27−29],类胡萝卜素类化学物的生物利用率受其结构、溶解特性和基质效应等因素的影响。因此我们推测,这可能是由于南极磷虾油中存在的磷脂类等两性物质[30],有助于南极磷虾油中酯化态虾青素水解成游离态虾青素,并促进其进入混合胶束,从而使虾青素在消化道内表现出更好的吸收特性。

图4 南极磷虾油和雨生红球藻藻油中虾青素的生物可接受率比较Fig.4 Bioaccessibility comparison of astaxanthin from Antarctic krill oil and Haematococcus pluvialis oil
3 结论
本文系统研究了不同浓度正己烷-乙醇溶剂对南极磷虾油提取效果的影响,并通过体内动物试验,考察了南极磷虾油中虾青素在模型动物体内的消化吸收情况。结果表明:60%(V/V)正己烷-乙醇溶剂提取虾青素的效果最佳,所制得的南极磷虾油中共检测出酯化态虾青素17 种,其中虾青素双酯12 种,相对含量占73.5%,虾青素单酯5 种,相对含量占24.88%,游离态虾青素相对含量约占1.62%;虾青素双酯在小鼠体内被分解为虾青素单酯和游离态虾青素;灌胃24 h 后,低、中、高剂量组虾青素的生物可接受率差异不显著,其生物可接受率约为74%;南极磷虾油源虾青素的生物可接受率明显高于雨生红球藻源虾青素,约为雨生红球藻源虾青素生物可接受率的1.25 倍。本研究为下一步研究南极磷虾油中虾青素在生物体内的吸收代谢转运机理奠定了基础,并为南极磷虾油的产业定向化提取应用以及膳食营养特性评价提供了科学依据。

