TG-DHA 脂质体对高脂饮食小鼠食欲的调节作用
杨瑞利,刘 芳,张 慧,周赛楠,王志广,卢 娜,唐庆娟
(中国海洋大学食品科学与工程学院,山东青岛 266003)
随着居民生活方式和饮食结构的不断变化,中国人的超重率和肥胖率日益上升[1]。2016 年英国著名医学杂志《柳叶刀》发表的关于全球成年人体重调查报告显示:中国肥胖人群已突破9000 万,超越美国成为全球肥胖人口最多的国家[2]。由肥胖带来的一些并发症:高血压病、糖尿病、脂代谢紊乱、心脏病、恶性肿瘤等严重危害着人类的健康[3]。近年来,改善肥胖的方式主要有饮食调整,药物、手术治疗,体育运动干预等[4]。而饮食调控成为了近些年全世界关注的焦点[5]。
下丘脑是控制食物摄入和能量平衡的神经中枢,可以接受整合外周激素和脑-肠轴传递的信号,发放到效应器官,从而促进或抑制摄食[6−7]。瘦素和胰岛素是参与食欲调控最主要的两种外周激素。瘦素是一种由脂肪组织分泌的蛋白类激素,可以通过调节神经肽Y(Neuropeptide Y,NPY)和阿黑皮素原(Proopiomelanocortin,POMC)的的合成和释放,从而抑制食欲[8]。胰岛素是有胰岛β细胞产生,调节食欲的机制与瘦素相似[9]。脑-肠肽包括促进食欲的脑-肠肽促生长素(ghrelin)和抑制食欲的脑-肠肽胆囊收缩素(Cholecystokinin,CCK),肽YY(Peptide YY,PYY),胰高血糖素样肽-1(Glucagon-like peptide-1,GLP-1)[10]。脑-肠肽可以通过迷走传入神经元将信号传递给下丘脑调节食欲,或者通过血脑屏障,直接作用于下丘脑中的特异性受体,从而调节食欲[11−12]。二十二碳六烯酸(Docosahexaenoic acid,DHA)属于n-3 多不饱和脂肪酸,具有降脂减肥,控制食欲,调节脂质代谢,调节肠道菌群等功效[13]。刘新丽等[14]的研究表明n-3 多不饱和脂肪酸可以减少肥胖小鼠NPY、POMC 等食欲调节因子的表达。Golub 等[15]的研究表明,膳食补充DHA 会影响食欲或摄食量的调节。江亚娟[13]的实验也表明N-3 多不饱和脂肪酸改善能量代谢,控制小鼠体重可能与调控小鼠饮食相关神经肽基因和解耦联蛋白UCP 的表达有关。
实验室前期研究发现DHA 可以通过食欲改善高脂饮食小鼠体脂蓄积。由于DHA 属于多不饱和脂肪酸,具有6 个双键,极易受光、热的影响,同时极易发生氧化和酸败。来源于鱼油和藻油的DHA 多为甘油三酯型(Triglyceride,TG),尤其是鱼油中TGDHA 含量较为丰富,但其带有令人难以接受的鱼腥味。限制了其在食品工业领域的开发利用。因此人们采用多种方式对它进行保护。脂质体作为一种新型微胶囊包埋技术,由于其两亲性,较高的生物相容性,稳定性等受到广泛关注[16]。很多文献都曾报道,脂质体可以掩盖鱼油腥味[17]。杨梅等[18]的研究表明高磷脂酰胆碱(Phosphatidylcholine,PC)的磷脂更适合作为制备脂质体的壁材。目前的研究主要集中在鱼油脂质体的制备,关于其对食欲调控的研究相对较少,这在很大程度上限制了鱼油产品的开发利用。
本实验以98%的PC 为壁材制备TG-DHA 脂质体,探究TG-DHA 脂质体对高脂饮食小鼠食欲调节因子表达的影响,为开发相关的高附加值产品提供理论依据。
1 材料与方法
1.1 材料与仪器
10/70 TG-DHA 金枪鱼油 浙江舟山新诺佳生物技术有限公司;98%大豆磷脂酰胆碱(98% PC) 西安艾诺医药科技有限公司;SPF 级6 周龄雄性C57BL/6J 小鼠 济南朋悦实验动物繁育有限公司;瘦素(Leptin)试剂盒、胰岛素(Insulin)试剂盒、阿黑皮素原(Proopiomelanocortin,POMC)试剂盒 苏州卡尔文生物科技有限公司;TRIZOL 试剂 美国Invitrogen 公司;RNA 纯化试剂盒 天根生化科技有限公司;5X All-In-One RT 裂解反转录一体试剂盒、EvaGreen Express 2X qPCR MasterMix 加拿大abm 公司;10%低脂饲料(饲料代码TP23522)、45%高脂饲料(饲料代码TP23220) 南通特洛菲饲料科技有限公司,饲料配方见表1;其他试剂均为国产分析纯。
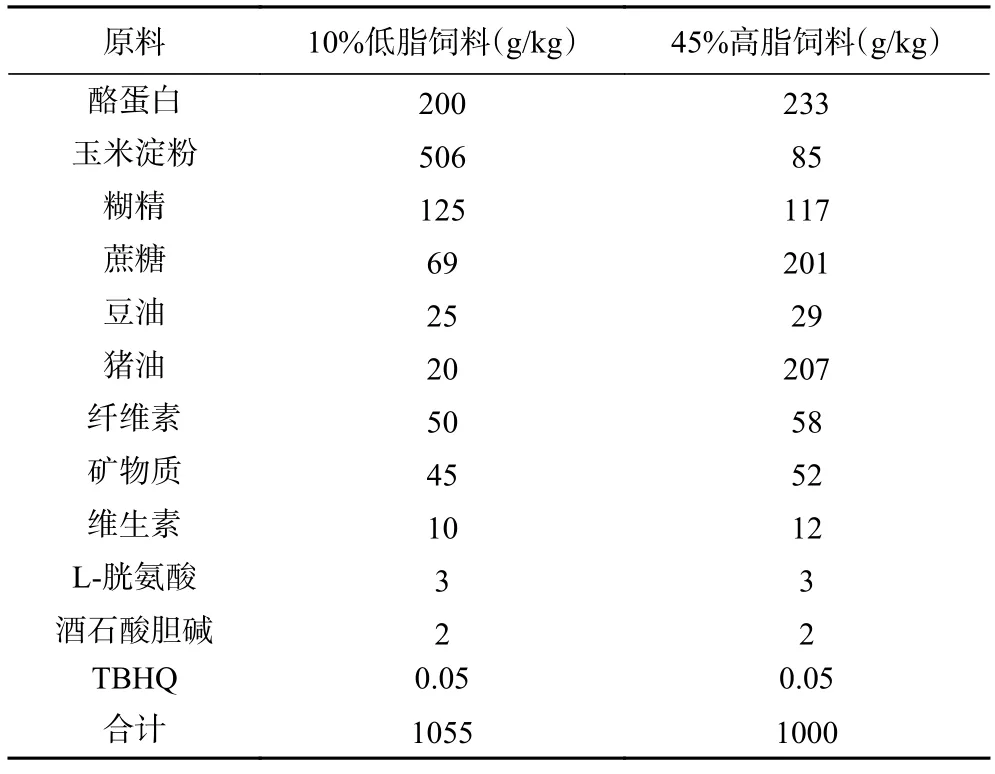
表1 饲料配方Table 1 Feed formula
DF-101S 集热式恒温加热磁力搅拌器 上海力辰邦西仪器科技有限公司;RE-2000A 旋转蒸发仪 上海亚荣生化仪器厂;Model680 型酶标仪 美国BioRAD 产品;JY92-IIN 超声波细胞粉碎机 宁波新芝生物科技股份有限公司;HT-7800 透射电子显微镜 天美中国科学仪器有限公司;SP-2500 紫外分光光度计 上海光谱仪器有限公司;TGL-16G 型台式离心机上海安亭科学仪器厂;IQ5 Realtime PCR仪 美国Bio-RAD。
1.2 实验方法
1.2.1 TG-DHA 脂质体的制备 称取10/70 TG-DHA金枪鱼油和98%大豆磷脂酰胆碱,用95%食用酒精溶解。旋转蒸发、减压浓缩(40 ℃,100 r/min)除去有机试剂,室温静止冷却30 min,冷却后加超纯水洗膜,然后过200 nm 聚碳酸酯膜,即可得到TG-DHA鱼油脂质体浑浊液[19]。
1.2.2 TG-DHA 脂质体包封率的测定
1.2.2.1 吸收波长的确定 分别将10/70 TG-DHA金枪鱼油-石油醚和98%大豆磷脂酰胆碱-石油醚配制成0.6 mg/mL 的溶液。以石油醚为空白对照,分别用紫外分光光度计在200~400 nm 波长范围内扫描两种溶液,以确定最佳波长。
1.2.2.2 标准曲线 配制0、0.2、0.4、0.6、0.8、1.0 mg/mL 的6 种不同浓度的鱼油石油醚溶液,以石油醚为空白对照,在1.2.2.1 测得的最佳波长处测定鱼油石油醚溶液的吸光度,以鱼油石油醚浓度为横坐标,吸光度为纵坐标绘制标准曲线。
1.2.2.3 包封率测定 取适量TG-DHA 脂质体样品,离心(8000 r/min)20 min。加入正己烷除去游离鱼油。从下层溶液中取鱼油脂质体样品,用10%TritonX-100 甲醇溶液为破乳剂,超声破壁(100 W)30 min,加石油醚提取,4000 r/min 离心6 min。取上清液用石油醚定容,在1.2.2.1 测得的最佳波长处测其吸光度,TG-DHA 鱼油脂质体的吸光度为A,空白脂质体的吸光度为A0,计算△A=A−A0,根据1.2.2.2得到的标准曲线计算包封率[20]。
包封率(EE):指包埋在脂质体里鱼油质量占添加鱼油质量的百分比

式中:Win 为包封的鱼油质量,g;Wtot 为添加的鱼油质量,g。
1.2.3 TG-DHA 脂质体形态学检测 运用负染色法对脂质体悬浮液进行透射电子显微镜(TEM)观察。取鱼油脂质体样品稀释至10 mg/mL,将样品滴在碳支持膜铜网上,然后用滤纸吸去多余液体;再将2%磷钨酸滴在碳支持膜铜网上,滤纸吸干多余液体,室温干燥。在放大倍率60000×,工作电压75 kV的透射电镜下观察脂质体的形态[21]。
1.2.4 动物饲养与取样 30 只SPF 级的雄性C57BL/6J小鼠暂养一周后,按体质量随机分为三组,对照组(C),模型组(M),TG-DHA 脂质体组(L-DHA),除C 组喂养10%低脂饲料,其他两组均喂养45%高脂饲料。4 周后开始灌胃,L-DHA 组灌胃TG-DHA 脂质体,C 组和M 组灌胃生理盐水,灌胃剂量1000 mg/kg.bw。实验小鼠养在普通环境下,单笼单只,室温23±2 ℃,湿度55%~58%,12 h/12 h 光暗循环,饲养期间所有动物均自由摄食和饮水。12 周后,摘眼球取血脱颈椎处死小鼠,取小肠,下丘脑等组织,−80 ℃保存。
1.2.5 小鼠体重增长率及能量摄入量的测定

能量摄入量(kcal)=平均摄食量×能量系数
式中,10%低脂饲料能量系数:3.58;45%高脂饲料能量系数:4.73。
1.2.6 血清食欲激素的测定 取上述各组小鼠血清,试剂盒法检测血清中瘦素、胰岛素、POMC 的浓度,具体方法按照试剂盒说明书进行操作。
1.2.7 RNA 提取与qRT-PCR 使用提取试剂Trizol提取小肠、下丘脑中的总RNA,严格按照试剂盒说明书进行操作。使用RNA 纯化试剂盒去除蛋白质、无机盐离子和有机杂质等。使用5X All-In-One RT裂解反转录一体试剂盒将RNA 反转成cDNA。使用表2 所示引物,以β-actin 为内参基因,实时荧光定量PCR 按照 EvaGreen Express 2X qPCR MasterMix试剂盒说明书进行设置。使用IQ5 型荧光定量PCR 仪进行测定mRNA 的相对表达量,扩增条件:95 ℃,10 min;95 ℃,15 s,60 ℃,20 s,95 ℃,15 s(45个循环);5 ℃升温至95 ℃(0.5 ℃/10 s),mRNA 相对表达量用2-ΔΔCT 法计算[22]。引物由上海生工生物工程有限公司合成;引物序列见表2:
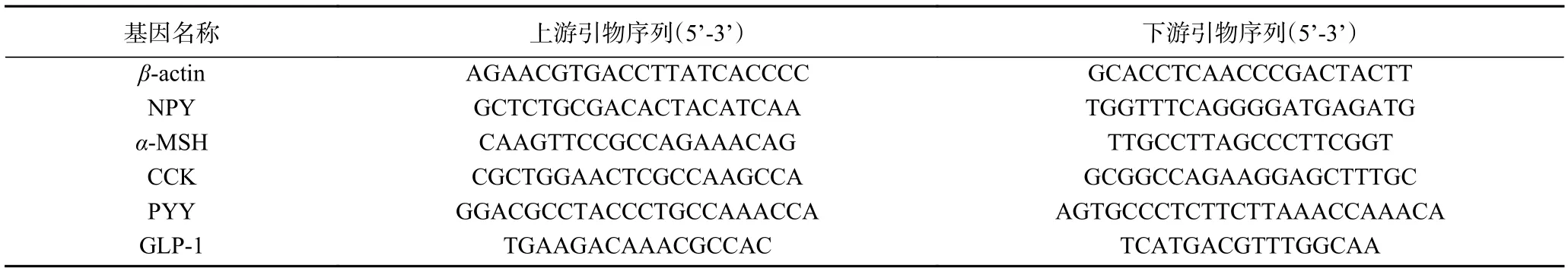
表2 引物设计序列表Table 2 Primer sequences used for PCR
1.3 数据处理
所有实验数据均用SPSS 25.0 软件进行统计分析,结果以平均值±SD 表示,组间差异采用单因素方差分析(One-Way ANOVA),以P<0.05 表示差异有统计学意义。
2 结果与分析
2.1 TG-DHA 脂质体包封率的测定
由图1 可见,鱼油-石油醚溶液在274 nm 处有最大吸光度,且在此波长处大豆磷脂酰胆碱-石油醚溶液无吸收波长,因此可以以274 nm 作为TGDHA 脂质体的最佳吸收波长。在274 nm 处测得标准曲线:A=0.9219X+0.0125,R2=0.9922;在此条件下测得TG-DHA 脂质体的包封率为85.83%,其包埋效果良好。

图1 紫外扫描曲线图Fig.1 Ultraviplet scanning spectrum
2.2 TG-DHA 脂质体形态学测定
由图2 可见,TG-DHA 脂质体的形状为圆形或椭圆形。外观平滑完整,颗粒饱满,分布均匀,脂质体边缘几乎没有油脂,说明包埋效果良好。

图2 TG-DHA 脂质体形态图Fig.2 Morphology of TG-DHA liposome
2.3 TG-DHA 脂质体对高脂饮食小鼠能量摄入量的影响
体重增长率常作为高脂饮食诱导肥胖程度的常用指标,能量摄入量通常作为食欲变化的常用指标。如图3A 所示,在第72~80 d,L-DHA 组实验小鼠体重显著低于M 组实验小鼠体重。在饲养第44 d 之后,M 组小鼠能量摄入量一直高于C 组和L-DHA组小鼠(由图3B 可见)。统计了实验小鼠饲养过程中各组小鼠的体重增长率和能量摄入量,发现与C 组小鼠相比,M 组小鼠体重增长率(P<0.0001)和平均能量摄入量(P<0.01)极显著升高。而与M 组小鼠相比,TG-DHA 脂质体的摄入极显著降低了高脂饮食小鼠体重增长率(P<0.001)和能量摄入量(P<0.01)。表明TG-DHA 脂质体可能会通过调控高脂饮食小鼠的食欲从而降低高脂饮食小鼠的体重。

图3 TG-DHA 脂质体对高脂饮食小鼠体重和能量摄入量的影响(n=10)Fig.3 Effects of TG-DHA liposomes on body weight and energy intake in high fat diet-fed mice(n=10)
2.4 TG-DHA 脂质体对高脂饮食小鼠血清食欲激素的影响
瘦素、胰岛素、POMC 都是参与调控食欲的激素。瘦素主要通过作用于下丘脑的代谢调节中枢,发挥抑制食欲的作用;胰岛素是一种促进食欲的激素;POMC 神经元通过释放阿黑皮素原的剪切产物促黑激素(α-MSH)起到抑制食欲的作用。由图4A 和图4C 可见,高脂饮食极显著降低了实验小鼠血清中的瘦素(P<0.01),POMC(P<0.001)水平。且M 组小鼠出现了能量摄入量明显增加的现象(P<0.01)。而TG-DHA 脂质体的摄入极显著升高了实验小鼠血清瘦素(上调了23.03%)、POMC(上调了1.30 倍)水平(P<0.0001),说明TG-DHA 脂质体或许可以通过增加高脂饮食小鼠体内的瘦素和POMC 的含量从而抑制其食欲[23]。有文献报道补充DHA 会增加实验动物体内POMC 水平的增加且会降低实验动物摄食量[24]。如图4B 所示,与C 组相比,高脂饮食极极显著升高了实验小鼠血清中胰岛素水平(P<0.01),这可能是由于长期高脂饮食导致小鼠出现了胰岛素抵抗现象,而TG-DHA 脂质体的摄入,极显著降低了高脂饮食小鼠血清胰岛素水平(P<0.01)降低了约38.18%。这与Martin 等[25]的研究结果相一致。

图4 TG-DHA 脂质体对高脂饮食小鼠血清食欲激素水平的影响(n=10)Fig.4 Effect of TG-DHA liposome on serum appetite hormone in high fat diet-fed mice (n=10)
2.5 TG-DHA 脂质体对高脂饮食小鼠下丘脑食欲调节神经肽的影响
研究表明,血清食欲调节相关激素是通过作用于下丘脑,调节下丘脑促进食欲神经肽和抑制食欲神经肽的表达来调控食欲[26]。NPY 是促进食欲的神经肽,研究表明向下丘脑注射NPY,会显著增加实验动物的摄食量[27]。由图5A 可以看出,高脂饮食具有增加小鼠下丘脑NPY 表达的趋势,而TG-DHA 脂质体的摄入可以降低这一趋势,但并未达到显著水平(P>0.05)。α-MSH 是一种抑制食欲的神经肽,由图5B 可见,与C 组相比,高脂饮食降低了M 组实验小鼠下丘脑中α-MSH 的mRNA 相对表达量(P>0.05),而TG-DHA 脂质体的摄入极显著增加了高脂饮食小鼠下丘脑α-MSH 的相对mRNA 表达量(P<0.001),增加约1.60 倍。POMC 是合成α-MSH的前体物质[28]。这与血清中POMC 检测结果一致。

图5 TG-DHA 脂质体对高脂饮食小鼠下丘脑食欲调节神经肽的影响(n=10)Fig.5 Effect of TG-DHA liposome on Hypothalamic appetite regulating neuropeptides in high fat diet-fed mice(n=10)
2.6 TG-DHA 脂质体对高脂饮食小鼠肠道中脑-肠肽表达的影响
由于TG-DHA 脂质体消化吸收的部位主要在胃肠道[29]。DHA 通过小肠上皮细胞时很可能会对相关基因的表达产生影响。因此我们检测了实验小鼠小肠中脑-肠肽的表达,如图6 所示。CCK、PYY、GLP-1 都是抑制食欲的脑-肠肽。由图6 所示,高脂饮食具有降低高脂饮食小鼠小肠中脑-肠肽表达的趋势(P>0.05),而TG-DHA 鱼油脂质体的摄入显著增加了实验小鼠小肠中PYY(1.32 倍)、GLP-1(78.10%)的mRNA 相对表达量(P<0.05)。表明TG-DHA 脂质体改善高脂饮食小鼠食欲可能与调节肠道中脑-肠肽PYY、GLP-1 的mRNA 表达量有关。

图6 TG-DHA 脂质体对高脂饮食小鼠肠道中脑-肠肽表达的影响(n=10)Fig.6 Effect of TG-DHA liposome on the expression levels of brain-gut peptides of gut in high fat diet-fed mice (n=10)
3 讨论与结论
本研究显示,TG-DHA 脂质体的包埋效果良好,其包封率高达85.83%。透射电子显微镜观察,脂质体外观平滑完整,边缘几乎没有油脂,且颗粒饱满,大小相对均一。且本课题组之前的研究结果发现脂质体包埋后降低了己醛,2,4-庚二烯醛等会产生鱼油腥味的物质,且TG-DHA 脂质体具有良好的稳定性[30]。动物实验研究结果显示,TG-DHA 脂质体可以显著降低高脂饮食小鼠的体重和能量摄入量。瘦素、胰岛素、POMC 都是食欲相关激素。很多文献都曾报道,瘦素可以通过下丘脑中特定的瘦素受体使POMC能神经元激活,从而调节食欲和能量平衡[31]。与瘦素相似,胰岛素也可以通过与下丘脑受体结合激活POMC 能神经元,从而抑制摄食,调控能量平衡[32]。血清食欲相关激素的研究结果显示,高脂饮食显著增加了实验小鼠血清中胰岛素水平,这可能是由于长期高脂饮食导致小鼠出现了胰岛素抵抗[33]。而TGDHA 脂质体的摄入,显著降低了高脂饮食小鼠血清胰岛素水平。同时高脂饮食显著降低了血清中瘦素、POMC 水平,并未出现瘦素抵抗现象,这与王晓芳等[34]的研究结果相似。而TG-DHA 脂质体的摄入显著增加了高脂饮食小鼠血清中瘦素和POMC 水平水平。
下丘脑在摄食调控中发挥着重要作用[35]。食欲相关激素通过作用于下丘脑,促进促食欲神经肽与抑制食欲的神经元的表达来调节食欲[26]。NPY 是促进食欲的神经肽,α-MSH 是抑制食欲的神经肽,由POMC 神经元裂解产生的。本实验研究结果表明,高脂饮食具有升高NPY,降低α-MSH mRNA 表达的趋势,而TG-DHA 脂质体的摄入显著升高了α-MSH 的mRNA 表达,这与Schwinkendorf 等[36]的研究结果相一致。动物摄食后,营养物质接触胃肠道从而刺激脑-肠肽的释放。有文献报道,高脂饮食对肠道中脑-肠肽的分泌有所损伤[37]。CCK、PYY、GLP-1 都是抑制食欲的脑-肠肽。Batterham 等发现小鼠摄食高脂肪饮食后PYY 降低[38]。本研究结果表明高脂饮食降低了小鼠小肠中CCK、PYY、GLP-1 的mRNA 表达,TG-DHA 脂质体的摄入显著增加了实验小鼠小肠PYY,GLP-1 的mRNA 表达。
综上所述,本实验研究表明TG-DHA 脂质体或许可以通过控制食欲相关激素或胃肠道中的脑-肠肽作用于下丘脑,促进抑食欲神经肽的表达,从而起到抑制食欲的作用。本研究可以更加有针对性的开发鱼油新型食品,达到既经济安全又高效的调节食欲的目的,以食疗防治食欲异常,通过调控食欲缩小超重或肥胖人群的规模。

