自制电子鼻检测霉变大米
李 超,周 博
(1.江苏大学机械工程学院,江苏镇江 212000;2.盐城工学院机械工程学院,江苏盐城 224000)
中国是种植水稻最丰富的国家之一,超过半数的人口以大米为主食[1],大米是水稻经多道工序加工的成品,并含有蛋白质、脂类、碳水化合物等营养成分,是天然的微生物培养基。储粮大米中常见微生物有细菌、霉菌、酵母菌等,由于霉菌代谢活动所需要的水分和温度远低于其它微生物,所以大米最易受霉菌侵蚀,尤其是南方高温高湿地区。当满足霉菌生存的温湿度条件时,大米就会发生霉变。霉变大米会产生抗菌素、真菌毒素、有机化合物等次级代谢产物,其中黄曲霉、寄生曲霉等常见标准菌株会产生对人危害极大的黄曲霉毒素。一般情况下,大米霉变伴随着复杂的气味变化,其挥发物成分是微生物作用产生的羟基类、醛基类、硫化物等化合物[2]。大米在不同霉变程度下,微生物挥发的气体成分在种类和浓度上也会发生相应的变化,大米变质过程中会产生霉味、酸败味、酒味等气味[3],这使得通过气味变化快速鉴别大米受霉菌污染成为可能。
传统谷物品质检测方法主要依靠人工感官评审,该评定方法因误差较大已被淘汰。目前应用广泛的新型谷物霉变检测方法主要有近红外光谱技术[4]、机器视觉法[5]、高光谱成像技术[6]、电子鼻技术[7]等。近红外光谱技术因其谱带复杂易导致数据整理时产生误差,对最终结果有影响。机器视觉法主要依靠摄像头拍照识别,但大米初期霉变外观并无较大变化,所以并不适用。高光谱成像技术采用图像采集来反馈数据,能清楚的反映出农产品缺陷,但对于大米霉变检测不够准确和稳定。电子鼻作为一种新型气味检测器,由多种气敏传感器组成阵列,单一传感器对特定气味产生高响应,对其他气味不敏感,整个传感器阵列对不同气体产生不同的响应图案,根据响应图案可以识别多种气味。国内外已有多项研究证实电子鼻在检测和识别微生物方面的有效性,如沈飞等[8]成功验证电子鼻技术对糙米中黄曲霉毒素快速检测的可行性;Gu 等[9]利用电子鼻结合BPNN 为早期检测曲霉菌提供可行性,众多研究表明电子鼻可以作为谷物霉变检测的有效手段。
电子鼻技术是一种检测挥发性气体的新型技术,具有检测速度快、响应迅速、重复性好和无损检测等特点,在食品检测行业[10−11]已有广泛应用,如水果[12−14]、乳制品[15]、肉制品[16]、谷物[17−19]、酒类[20−22]等的品质检测。目前许多学者已经借助电子鼻技术进行谷物品质的检测,郭玉宝[23]利用电子鼻技术探寻大米陈化劣变程度指标,发现电子鼻对大米6 个月内气味变化可以明显区分,证明电子鼻可以用于大米品质鉴定。胡志全等[24]利用电子鼻对不同基因型大米挥发性物质进行检测,发现电子鼻应用于鉴别大米新陈和基因型的差异是可行的。熊作周[25]利用电子鼻系统鉴定多种稻米品种,并且阵列优化后分类准确性高。通过上述研究发现,电子鼻在大米研究中的应用主要集中在对于品种鉴别、风味品质鉴定等方面,对于大米霉变的相关研究较少。张红梅等[26]用电子鼻结合主成分分析法成功区分6 个霉变程度的大米,证明电子鼻用于霉变大米的检测是可行的。本文研究目的主要是研制一套满足大米霉变在线检测电子鼻系统,采用不同的模式识别方法分析,并通过BP 神经网络建立霉变大米预测模型,实现对掺入不同比例霉米的大米样品的分类识别,为解决大米霉变诊断问题提供新的方法。
1 材料与方法
1.1 材料处理
大米 品种为“道好牌”公正大米,将培养好的霉菌孢子液分别接种经辐照灭菌处理后的10 份大米样品,每份100 g,然后将混有菌液的大米放入30 ℃、95% RH 恒温恒湿箱培养3 d 供后续使用。分别设立四组对照组a、b、c、d,a 组为正常无霉变大米,b 组、c 组、d 组分别为掺入质量10%、20%、30%霉变大米的样品。每组大米共计1000 g,每隔2 d 进行一次测试。进行电子鼻检测时,样品称量过程采用同一规格的烧杯,结合乐琪精密电子秤的“去皮”称量,避免称量过程存在误差。每组取20 个样本,每一个样本(50 g)置干燥洁净的200 mL 小烧杯中,并用聚乙烯保鲜膜密封60 min(产生顶空的时间),以达到气体平衡。静置后分别检测每组样本,每组样本测试完成全部放回贴有标签的2 L 大烧杯中,并继续用保鲜膜密封,供后续测试。为避免污染,每次烧杯用完采用无菌水冲洗,放入烘箱(105oC)烘干待用。测试时间为60 s,传感器清洗时间为180 s。每2 d 测试1 次,分别测试第1、3、5、7 d 的不同比例霉变大米。
1.2 电子鼻装置
该研究采用自主研制的电子鼻系统,系统主要包括传感器阵列、NI 数据采集卡、检测气室及电源部分组成,电子鼻系统示意图如图1 所示。
图1 中传感器阵列由8 个金属氧化物传感器组成,分别为5 个费加罗半导体传感器和3 个北科电子MQ 系列传感器,各个传感器信息如表1 所示。所用采集卡为NI 数据采集卡USB6009,有8 路模拟输入通道和2 路模拟输出通道,负责将8 个气敏传感器采集到的模拟信号转化为数字信号发送到PC 机LabVIEW 平台。气室容量为1000 mL,所用气泵为佑诚至信机电的VN-C6,可抽取0.2 L/min 的气体,电源为君利来学生电源,支持2~16 V 直流稳压电源输出。
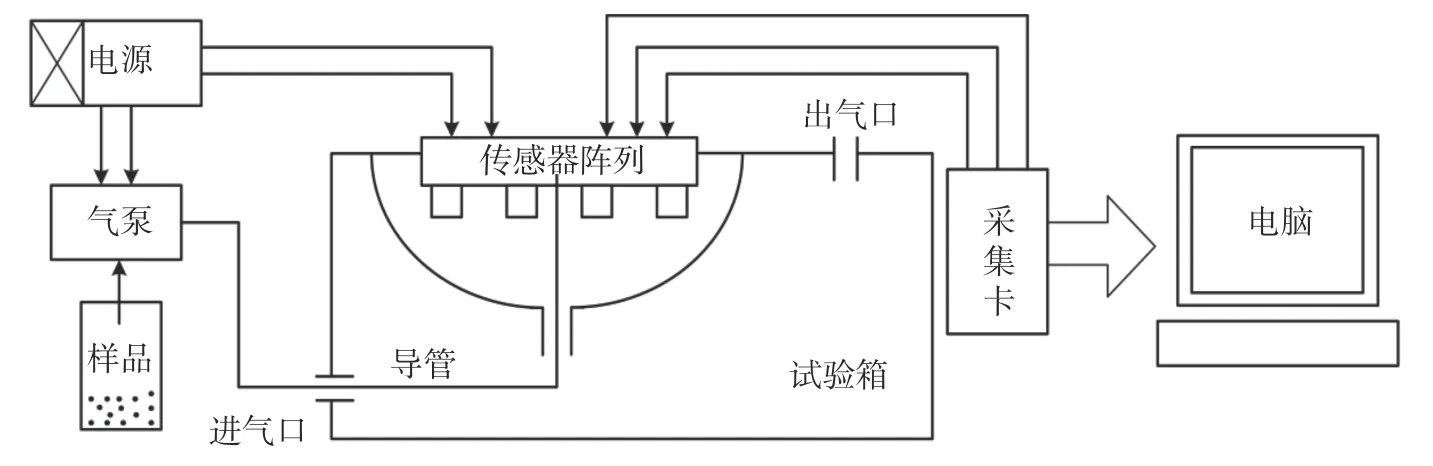
图1 电子鼻系统示意图Fig.1 Schematic diagram of electronic nose system
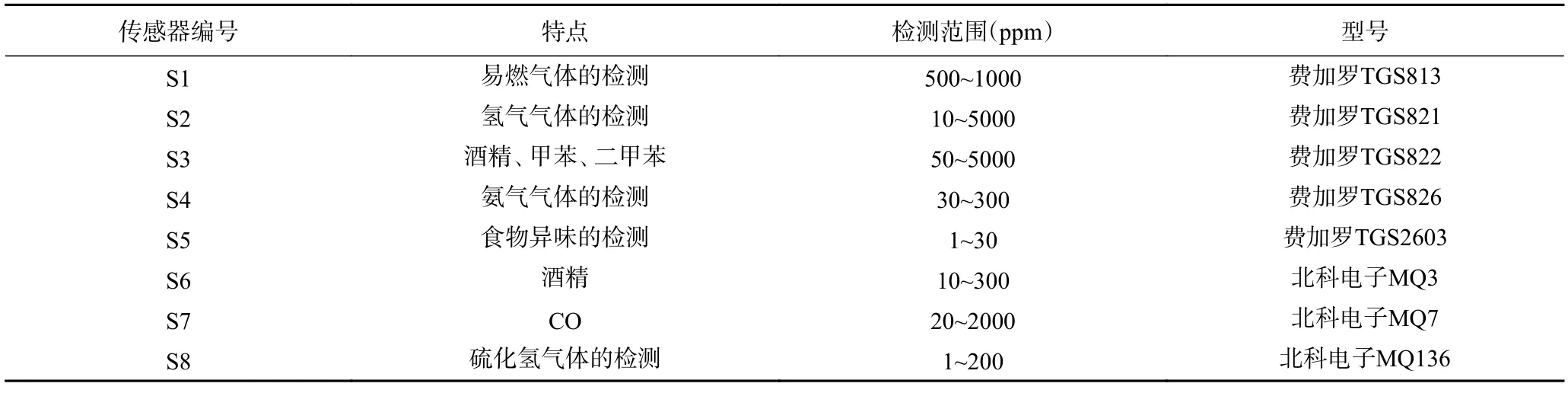
表1 传感器特点和检测范围Table 1 Characteristics and detection range of sensors
本系统是以LabVIEW 为基础开发检测平台,实现数据的采集、数据的保存等功能。数据采集通道依次对应采集卡NI USB-6009 的8 个模拟通道AI0~7,每个通道1 s 采集1 个数据,可选择和关闭任意传感器信号采集,按下开始测试即可将数字信号显示在波形图上,按下停止测试即可停止采集,按下保存按钮即可保存为Excel 表格数据(如测试60 s 则记录8×60 数据矩阵),电子鼻系统前面板如图2 所示。图中为8 个传感器未接入气体时的波形图。
图2 电子鼻数据采集平台前面板Fig.2 Electronic nose data acquisition platform front panel
1.3 菌落总数测定方法
菌落总数检验采用平板菌落计数法,并采用菌落形成单位(Colony Forming Units,CFU)计算菌落数。将黄曲霉3.17、寄生曲霉3.3950、赭曲霉3.6486分别接种于马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基,并置于恒温培养箱中(28oC、85%RH),14 d 后用无菌水冲洗PDA 培养基表面,制成浓度为105CFU/mL 的霉菌孢子悬浮液。检验标准参照GB/T 4789.15-2016《食品微生物学检验》菌落总数测定方法进行。
1.4 分析方法
本研究中采用主成分分析法(Principal Component Analysis,PCA)、线性判别分析法(Linear Discriminant Analysis,LDA)和反向传播神经网络(Back Propagation Neural Network,BPNN)对电子鼻数据进行分析处理。
PCA 是一种无监督模式识别技术[27],它是将多指标转化为少数几个能代表数据整体信息的综合指标,既能使多维数据降维,又能提取出最有价值的信息,从而客观的分析出样品之间的差异。本文采用Matlab®2018a 软件先对样本数据进行标准化处理,然后利用“Princomp”函数进行PCA 分析。
LDA 是一种有监督学习的降维技术,在模式识别领域有广泛的应用,和PCA 不同的是LDA 数据集的每个样本都是有类别输出的。本文采用IBM SPSS Statistics 25 软件的判别分析法对PCA 降维后的电子鼻数据进行分析,并按组平均值求得组质心。
BPNN 是一个用于模式分类的多层前馈网络,可实现从输入到输出的任意非线性映射。感知器网络结构依次为输入层、隐含层和输出层,样本从输入层穿过,通过所有隐含层逐层处理后传向输出层。如果当前输出不等于期望输出,则进入反向传播过程,误差信号经过正向传播的通路反向传回,通过依次调整每个隐含层神经元连接权系统得到期望输出。在建模过程中,输入和输出之间的数学方程无需定义,使得BPNN 操作非常方便[28]。本文所建立的BPNN模型包括三层,隐含层节点数从7 个开始增加15 个,对每个节点的BPNN 进行3 次训练,从9 个不同结构的神经网络中选择训练集准确率最高的一个来评价网络分类性能,采用非线性最小二乘算法Levenberg-Marquardt 算法,算法公式如式(1):
Axygen DNA提取试剂盒购于上海必横生物技术有限公司;rTaq酶,dNTP Mixture,10×PCR Buffer,琼脂糖(大连TaKaRa技术有限公司);TAE、PBS缓冲液购于上海双螺旋生物科技有限公司。
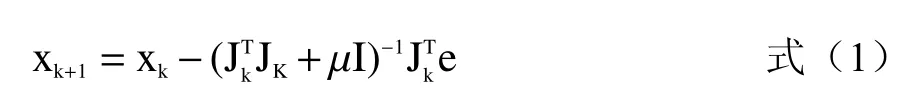
式中:e 为网络误差值;xk为k 次迭代各层之间的连接权值或者阈值;Jk为网络误差函数对权值和阈值一阶倒数雅克比矩阵;μ 为常数系数变量[29]。经过多次测试最终采用输入层8 个、隐含层12 个、输出层1 个的BPNN 模型,按照以下参数进行训练:训练误差为1e-3,最大训练次数2000,学习率0.01,最小梯度要求1e-10。
2 结果与分析
2.1 霉变时间及菌落总数
大米感染霉菌之后,霉菌在繁殖过程中不断消耗大米中的营养物质,并代谢产生醛、醇、酮、酸等小分子挥发性物质[30],导致大米霉变的优势菌属主要有黄曲霉、赭曲霉、寄生曲霉、黑曲霉、变幻青霉等,其中最常见的是黄曲霉(含量最多且毒性最大)、赭曲霉、寄生曲霉,实验用的霉变大米主要受这3 种霉菌侵染,霉米中菌落总数变化如图3 所示。由图3可知,3 种霉菌随时间递增变化趋势基本类似,0~3 d 时霉菌计数指标呈缓慢上升态势,此时大米表现为“出汗”现象,色泽灰暗,散发轻微的霉味;3~5 d 时菌落总数开始加速升高,此时霉变大米呈现黄绿色,散发糠酸味、霉味、酒味等;5~7 d 时霉菌霉菌增长率达到最大,此时霉变大米成团结块,散发腐败味。7 d后霉变大米严重发霉,米粒变形、大面积结块,此时大米失去使用价值。
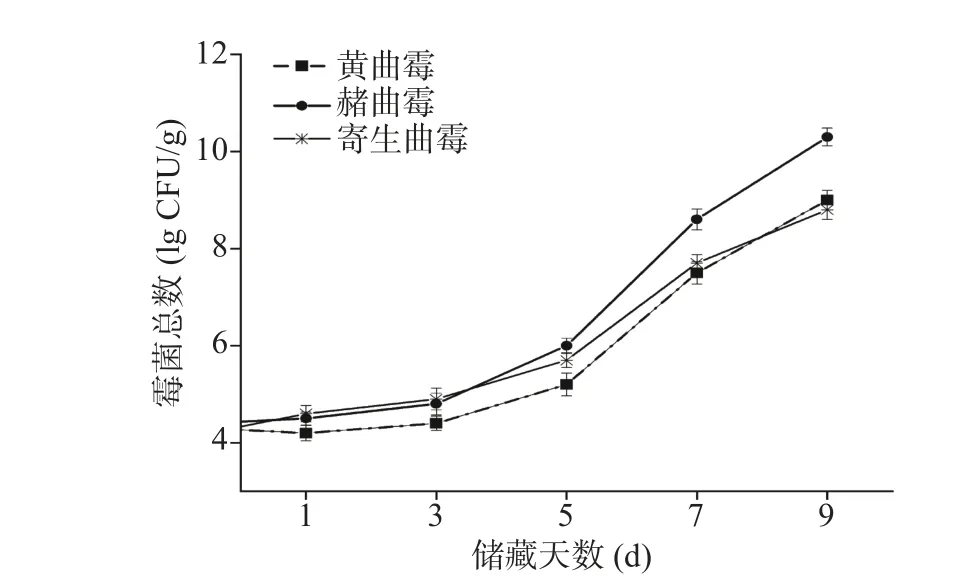
图3 霉菌感染大米样品菌落总数变化趋势Fig.3 Change trend of total bacterial colony of mildew infected rice samples
2.2 电子鼻指纹图谱分析
传感器每秒采集1 个响应值,一共采集70 s。如图4 所示,强度为检测样品气体与洁净空气的电阻比,每个传感器对特定气味有不同的响应曲线,随着传感器不断吸附样品挥发物的气体,响应曲线呈上升态势,当传感器表面完全吸附气体后(达到饱和状态),此时响应曲线达到平稳状态,选取8 个传感器60 s 后的稳态数据平均值作为特征值进行后续分析处理。

图4 掺入30%霉变大米的响应曲线Fig.4 Response curve of rice mixed with 30% moldy rice
2.3 大米霉变PCA、LDA 分析
分别对第1、3、5 和7 d 采集到的大米样品数据进行PCA 和LDA 分析。第1 d 霉变大米分析结果如图5 所示。由图5 可知,PCA 前两个主成分(PC1、PC2)和LDA 的前两个判别因子(LD1、LD2)贡献率之和分别为86.8%、99.0%,表明信息丢失量较少,其结果可以代表电子鼻响应信号对大米挥发物的区分情况。PCA 对于不同霉变程度的大米样品不能区分,霉变大米样品点发散程度大且样本存在部分重叠;LDA 不同霉变程度大米能很好地区分。

图5 第1 d 大米样品PCA、LDA 分析结果Fig.5 PCA and LDA analysis results of rice samples on the 1th day
第3 d 霉变大米分析结果如图6 所示,由图可知,PCA 前两个主成分和LDA 的前两个判别因子贡献率之和分别为89.0%、98.7%,其结果可以代表电子鼻响应信号对大米挥发物的区分情况。PCA 对于正常大米、10%霉米样品的点能很好地区分,20%霉米和30%霉米样品的点发散程度大且有重叠,区分有一定误差;LDA 不同霉变程度大米的点相对集中且能完美区分开来。
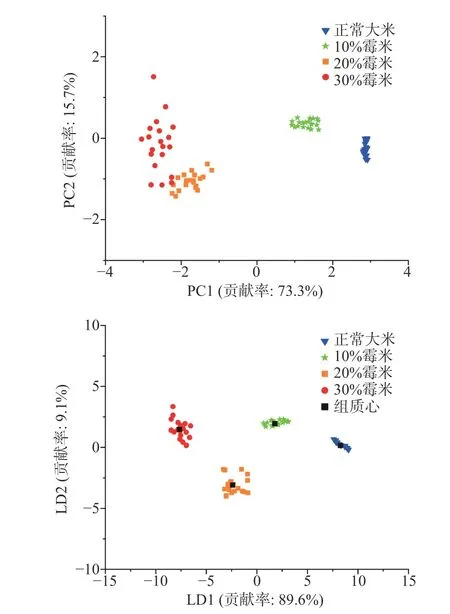
图6 第3 d 大米样品PCA、LDA 分析结果Fig.6 PCA and LDA analysis results of rice samples on the 3th day
第5 d 霉变大米分析结果如图7 所示,由图可知,PCA 前两个主成分和LDA 的前两个判别因子贡献率之和分别为92.9%、97.2%,其结果可以代表电子鼻响应信号对大米挥发物的区分情况。PCA 和LDA 都能区分不同比例的霉变大米,LDA 各个簇的集中性更好。

图7 第5 d 大米样品PCA、LDA 分析结果Fig.7 PCA and LDA analysis results of rice samples on the 5th day
第7 d 霉变大米分析结果如图8 所示,由图可知,PCA 前两个主成分和LDA 的前两个判别因子贡献率之和分别为88.3%、94.0%,其结果可以代表电子鼻响应信号对大米挥发物的区分情况。PCA、LDA都能很好的区分不同比例的霉变大米,PCA 各个簇的集中性更好。

图8 第7 d 大米样品PCA、LDA 分析结果Fig.8 PCA and LDA analysis results of rice samples on the 7th day
综合4 d 结果来看,第1 d 霉变大米样品的PCA分类结果误差较大,主要原因是霉菌培养时间短,掺入正常大米中的霉米比重较小,所以导致霉米释放的挥发物成分差异不大;从第3 d 开始,霉菌开始加速繁殖,第3 和5 d 霉变大米比例越大样品点越发散,这可能与霉菌的不同生长状况有关,比例大的霉米不同霉菌间的相互作用强烈,挥发性物质繁多,从外观表现来看10%霉米发霉速度明显慢于其余两组霉米;到了第7 d,样品点反而集中性较好,可能是该阶段霉菌已经大量繁殖,挥发物气味有所相似的缘故。第1、3、5 d PCA 结果霉变程度均有从右往左递增趋势,但到了第7 d 递增趋势转变,这可能是因为大米霉变晚期气味产生了复杂的变化所致。
2.4 BP 神经网络预测霉变程度
本研究采用BP 神经网络来建立霉变大米定量预测模型。电子鼻系统采集数据后,由于数据量过大,采用PCA 降维后的数据进行BP 神经网络分析。为了缩小数据范围差别,对数据采用式(2)进行[0-1]区间归一化预处理。

式中:y 为归一化后的结果;x 为传感器某一时刻的瞬态响应值;xmax、xmin分别为一个周期内传感器最大、最小响应值。
为保证建立的模型具有良好的泛化能力,尽量使训练集与测试集样本有近似的分布规律。最终建模时不考虑时间因素(由于第1 d 样本误差较大考虑去除),将第3、5、7 d(每天80 个样本)采集到的样品数据统一建立预测模型,所有电子鼻数据处理后总共240 个样本,分别划分为训练集(160 个样品)和测试集(80 个样品),模型的精度通过决定系数R²(the coefficient of determination)和均方根误差(MSE)来评价。
BP 神经网络模型预测霉变大米比例结果如图9所示,由图可知,正常大米和10%霉米预测结果准确性较高。分别将训练集、测试集数据输入模型,最终得到如下结果:模型的决定系数R²为0.9495,训练集和测试集的MSE 分别为3.36×10−2、9.42×10−2。训练集数据预测值和真实值的相关性为0.99076,平均相对误差为3.56%,最大相对误差为13.5%;测试集数据预测值和真实值的相关性为0.95346,平均相对误差为4.18%,最大相对误差为18.82%。综上所述,训练集和测试集的预测值与真实值拟合效果较好,所建立的模型对大米霉变程度表现出较好的预测能力。

图9 BP 神经网络训练结果Fig.9 BP neural network training results
为测试模型预测准确性,在模型超参数不变的条件下,重复3 次随机划分训练集、测试集进行训练,BP 算法识别结果如表2 所示(括号中的数字为误判数),由表2 结果可知,正常大米样本可以正确预测,训练集和测试集识别率均为100%,10%霉米预测准确性达到95%,可能原因是霉菌含量低,大米始终对微生物有着较强的抵抗性,霉菌繁殖受到新环境的制约,挥发性物质相似。而20%霉米、30%霉米误判错误率较高,可能原因是因为大米受霉菌侵染挥发物成分变化复杂,不同霉菌生长代谢所产生的挥发物气味变化可能存在相互干扰,这一点在Capuano Rosamaria 等[31]研究中已得到证实,菌株之间的差异会随着培养时间的变化而发生变化。

表2 BP 神经网络分类识别结果Table 2 Classification and recognition results of BP neural network
3 结论
该研究用自行设计的电子鼻系统检测霉变大米,针对不同时间的4 组大米进行分类,所有结果显示正常大米的PCA、LDA 均与霉变大米差异明显,不同比例霉米PCA 得分图结果具有沿第一主成分变化的规律,但不同比例霉米在PCA 得分图上区分有一定误差,LDA 分类效果更好且能做到完全区分。BPNN 测试集结果对于大米霉变程度预测准确性不高,但是建立的模型对于正常大米与霉变大米分类准确率为100%,轻微霉变大米(10%)也与正常大米差异明显,说明利用电子鼻结合BPNN 建立的模型是能发现早期大米发霉现象的。结果表明,电子鼻系统可以作为检测大米是否发霉及霉变程度预测的有效手段,这为快速无损检测霉变大米提供了一种新途径。

