响应面法优化黑化红枣三萜酸提取工艺及抗氧化活性研究
付亚玲,姚俊修,张仁堂,
(1.山东农业大学食品科学与工程学院,山东泰安 271018;2.山东省高校食品加工技术与质量控制重点实验室,山东泰安 271018;3.山东省林业科学研究院/山东省林木遗传改良重点实验室,山东济南 250014)
红枣(Ziziphus jujubaMill.)又称中华大枣,为鼠李科枣属植物,在我国的栽培历史已有4000 多年,主要在黄河中下游、西北和东部等地区分布[1]。红枣富含微量元素、维生素和多糖、黄酮、三萜类、多酚、生物碱等活性成分,在补虚益气、养血安神、健脾和胃等方面具有独特功效[2−3]。黑化红枣简称黑枣,是一种新型的红枣深加工产品,在不添加任何添加剂的情况下通过控制温度和湿度,由红枣经过一段时间的高温熟化形成[4]。与原红枣相比,黑枣在加工过程中颜色、香气、风味和营养成分发生各种物理化学变化,其生物活性物质还原糖、三萜酸类、酚类和黄酮等含量升高,并且新产生一种脯氨酸[5]。因此,研究黑枣中活性成分,对其产品开发和综合利用具有重要意义。
三萜酸类物质为枣中非常重要的一类化学成分,由30 个碳原子(含6 个异戊二烯单元)聚合而成的萜类化合物[6],具有抗氧化[7]、抗肿瘤[8−9]、降血脂[10]、抗菌保肝[11]和提高机体免疫力[12]等重要生物作用,被广泛应用于新型功能食品、药物、化妆品和保健品中。近年来,三萜酸类化合物的研究已成为天然产物开发的热点,但大多数都集中在人参、灵芝等名贵中草药材中,对枣中三萜酸类化合物的研究较少,目前国内外仅限于天然枣果。另外,以黑化红枣为试验材料并对其三萜酸类提取工艺及抗氧化分析相关性报道暂未见。
因此,本文以黑化后的红枣为原料,利用超声波法提取枣中三萜酸,通过单因素实验和响应面试验优化其提取工艺,并将粗提取物用大孔树脂纯化,进而探究黑化红枣三萜酸粗提物和纯化物的体外抗氧化能力,旨在为黑化红枣资源的研究和工业生产提供参考。
1 材料与方法
1.1 材料与仪器
原料大枣 品种为骏枣,产地新疆、山东泰安;黑化红枣 实验室自制(选取无病虫害、果形整齐的红枣复水1 h 后装袋密封,在温度75 ℃,湿度80%的恒温恒湿箱内加工大约55 h,制得黑枣,其含水量26%左右,颜色呈黑褐色,口味酸甜。黑化后剪成细瓣,60 ℃烘箱中烘干,小型粉碎机粉碎,40 目过筛备用);1,1-二苯基-2-三硝基苯肼(DPPH) 上海华蓝化学科技有限公司;2,2'-联氮基双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(ABTS) 合肥博美生物科技有限公司;齐墩果酸标准品 纯度≥98%,上海源叶生物技术科技有限公司;香草醛、高氯酸、冰乙酸 均为分析纯,天津市凯通化学试剂有限公司。
754N 紫外-可见分光光度计 上海奥谱勒仪器有限公司;KQ-500V 超声波清洗器 昆山市超声仪器有限公司;HH-6 数显恒温水浴锅 江苏省金坛市荣华仪器制造有限公司;101-ZES 电热鼓风干燥箱 北京市永光明医疗仪器厂。
1.2 实验方法
1.2.1 黑化红枣三萜酸的提取 精确称取黑化红枣粉末1.0 g,置于100 mL 锥形瓶中,加入溶剂超声辅助提取,提取完成后,抽滤,将抽滤后的溶液离心10 min(6000 r/min),然后残渣重提一次,合并两次上清液,定容至100 mL 容量瓶中得样品溶液,备用。
1.2.2 测定波长的确定 精密称取10.00 mg 干燥至恒重的齐墩果酸标准品于100 mL 容量瓶中,用无水乙醇溶解,定容至刻度,摇匀,即为浓度0.1 mg/mL的标准溶液。吸取1 mL 齐墩果酸标准溶液置于具塞试管中,水浴挥干溶剂,依次加入0.2 mL 5%香草醛-冰乙酸溶液和0.8 mL 高氯酸,混匀,60 ℃恒温水浴锅中加热15 min,取出后,立即用冷水冷却至室温,然后加入5 mL 冰乙酸,摇晃均匀,静置10 min,以空白试剂为参比,在450~700 nm 范围内进行全波长扫描,确定三萜酸最佳吸收波长[13]。
1.2.3 标准曲线的绘制 参考蔡天娇等[14]方法,略有改动。向具塞试管中分别加入体积为0.0、0.2、0.4、0.6、0.8、1.0、1.2 mL 齐墩果酸标准溶液,水浴挥干溶剂,按照1.2.2 方法操作,在吸收光谱的最大波长处测定吸光度,以齐墩果酸溶液浓度(μg/mL)为横坐标,吸光度为纵坐标,绘制标准曲线。
1.2.4 三萜酸提取量计算 分别精密吸取在不同条件下超声提取的黑化红枣样品溶液0.1 mL 置于具塞试管中,按照1.2.2 方法操作,测定其在547 nm 处的吸光值,根据回归方程计算黑化红枣中三萜酸的提取量,其计算公式见式(1)。
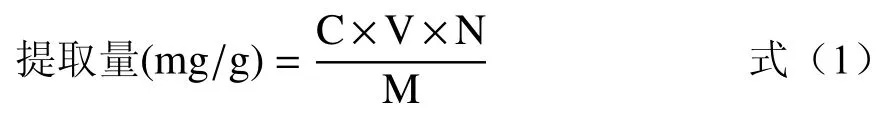
式中:C 为提取液中三萜酸的浓度,mg/mL;V 为三萜酸提取液的总体积,mL;N 为稀释倍数;M 为样品粉末质量,g。
1.2.5 单因素实验 准确称取一定量黑化红枣粉末于具塞三角瓶中,按照设定条件进行工艺提取,以三萜酸提取量为评价指标,固定液料比20:1 mL/g、提取温度60 ℃、提取功率300 W、提取时间30 min,考察乙醇浓度(40%、50%、60%、70%、80%)对黑化红枣三萜酸提取效果的影响;固定乙醇浓度50%、提取温度60 ℃、提取功率500 W、提取时间30 min,考察不同液料比(10:1、15:1、20:1、25:1、30:1 mL/g)对黑化红枣三萜酸提取效果的影响;固定乙醇浓度50%、液料比20:1 mL/g、提取功率300 W、提取温度60 ℃,考察不同超声时间(20、30、40、50、60 min)对黑化红枣三萜酸提取效果的影响;固定乙醇浓度50%、液料比20:1 mL/g、提取温度60 ℃,提取时间30 min,考察不同超声功率(100、200、300、400、500 W)对黑化红枣三萜酸提取效果的影响,每组试验重复3 次。
1.2.6 响应面试验 在以上单因素实验结果基础上,选取对黑化红枣三萜酸提取效果影响较大的乙醇浓度、液料比、超声时间为自变量,并依次编码为A、B、C,以三萜酸提取量(Y)为响应值,根据响应面Box-Behnken 设计原理,进行三因素三水平优化分析试验,试验因素与水平见表1。
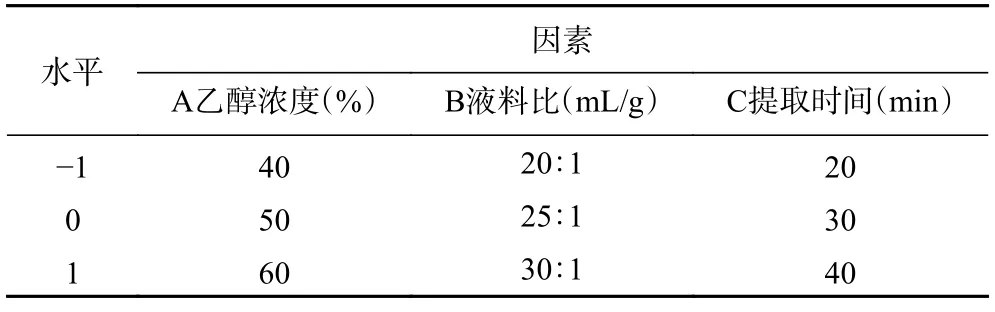
表1 响应面试验因素及水平表Table 1 Factors and levels of central composite design
1.2.7 三萜酸纯化 将提取的黑化红枣三萜酸粗样品用D-101 型大孔树脂进行纯化。按照1.0 mL/min的流速将配制好的三萜酸粗样品溶液上柱,待样液吸附后,以同样的流速用去离子水冲去可溶性糖类等水溶性杂质;然后先用40%乙醇进行洗脱,再用体积分数为95%的乙醇溶液以流速1.0 mL/min 进行洗脱,收集95%乙醇洗脱液[15]。将洗脱液中乙醇旋蒸浓缩后冷冻干燥,得到三萜酸干燥粉末,用于抗氧化活性的测定。
1.2.8 黑化红枣三萜酸纯化前后抗氧化活性研究
1.2.8.1 DPPH 自由基清除能力的测定 参考Fu 等[16]方法略有修改,用移液枪分别吸取不同浓度的样品溶液2 mL 置于试管中,加入2 mL DPPH(0.1 mmol/L,无水乙醇配制)溶液,振荡摇匀后,室温黑暗处反应30 min,在517 nm 波长下测定其吸光度A1;同时将等量乙醇代替DPPH 溶液测按照上述测定方法其吸光度为A2;再测定2 mL 无水乙醇和2 mL DPPH 混合溶液的吸光度A0。以VC为阳性对照,按照式(2)计算DPPH 自由基清除率:

1.2.8.2 ABTS+·清除能力测定 参考Liu 等[17]方法有所改动。ABTS 工作液是由7 mmol/L 的ABTS溶液与2.45 mmol/L 的过硫酸钾溶液等体积混合,室温避光条件下反应12~16 h 制得,使用前用乙醇稀释混合液,直到测得其在734 nm 处的吸光度为0.7±0.02。在6 支试管中依次加入不同浓度的样品溶液0.5 mL、ABTS 工作液3 mL,振荡均匀,黑暗下反应8 min,检测其在波长734 nm 处的吸光值A1;去离子水代替ABTS 工作液测得吸光值A2;同样用去离子水代替样品溶液测其吸光值A0,以VC作为阳性对照。根据式(3)计算ABTS 自由基清除率。

1.2.8.3 总还原能力测定 参考康宁等[18]的方法稍有修改,吸取适当稀释的样品溶液1.0 mL,加入2.5 mL 0.2 mol/L 的磷酸盐缓冲溶液(pH=6.6)和2.5 mL 铁氰化钾溶液(1%,w/v),在50 ℃下水浴反应20 min。取出后,加入2.5 mL 10%(w/v)的三氯乙酸,摇匀,离心,随后加入2.5 mL 去离子水及0.1%(w/v)三氯化铁溶液0.5 mL,涡旋混匀,静置10 min,测定反应体系在波长700 nm 处吸光度A1,以VC作为阳性对照。总还原能力计算公式见式(4):

式中:A0为空白组的吸光度;A1为样液的吸光度。
1.3 数据处理
采用Excle 2016 和Origin 2018 软件对数据进行处理及绘图;响应面试验运用Design-Expert 8.0.6 软件进行分析和设计。所有试验平行测定3 次,取平均值。
2 结果与分析
2.1 测定波长的选择
波长扫描结果如图1 所示,齐敦果酸标准品溶液的最大吸收峰在1 处(547 nm),因此,选择547 nm作为三萜酸的测定波长。
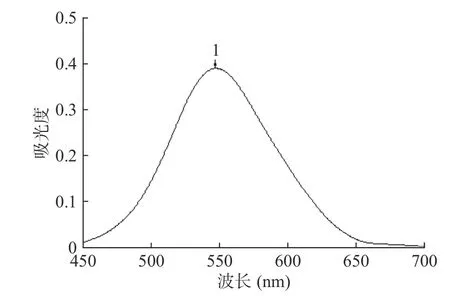
图1 齐墩果酸吸收光谱图Fig.1 Absorption spectrogram of oleanolic acid
2.2 标准曲线的绘制
标准曲线如图2 所示,其线性回归方程为Y=0.0409X−0.01,R2=0.9989,表明齐墩果酸溶液在0~20 μg/mL 范围内吸光值与浓度呈现良好的线性关系。

图2 齐墩果酸标准曲线Fig.2 Standard curve of oleanolic acid
2.3 单因素实验结果
2.3.1 不同乙醇浓度对三萜酸提取量的影响 由图3可看出,当乙醇浓度在40%~50%之间时,黑化红枣中三萜酸提取量呈现上升趋势,在50%处其提取量达到最高值1.176 mg/g;但当乙醇浓度超过50%后,三萜酸提取量随着乙醇浓度的升高反而下降。原因可能是乙醇浓度提高,使黑变红枣中一些醇溶性杂质、色素等成分溶出量增加[19],从而影响三萜酸提取量,因此乙醇浓度选择50%最佳。研究结果与张琼等[20]采用超声法提取“鲁枣1 号”枣果中三萜酸的提取量和乙醇浓度关系结果一致。
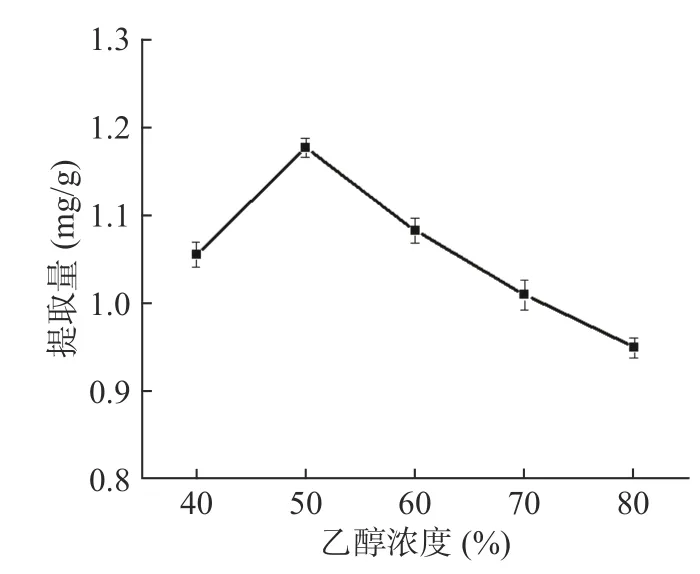
图3 乙醇浓度对三萜酸提取量的影响Fig.3 Effect of ethanol concentration on yield of triterpenoid acid
2.3.2 液料比对三萜酸提取量的影响 由图4 可知,黑化红枣三萜酸提取量随着液料比增加呈现先上升后下降的趋势。当液料比为20:1 mL/g 时,三萜酸提取量达到最大值1.286 mg/g。分析原因可能是液料比过小时,固液两相浓度梯度小,阻碍超声波在溶剂中扩散,不利于三萜酸有效物质全部溶出[21],因此三萜酸含量较小;当液料比继续增大时,物料与溶剂接触面积增加,三萜酸逐渐全部溶出,故目标分析物提取量增加[22];但当溶剂量过多会形成稀释效应,溶液中杂质也会随之增多,从而提取量下降[22−23]。综合考虑,液料比选择20:1 mL/g 为宜。

图4 液料比对三萜酸提取量的影响Fig.4 Effect of liquid-solid ratio on yield of triterpenoid acid
2.3.3 超声时间对三萜酸提取量的影响 由图5 可知,超声时间小于30 min 时,随时间增加黑化红枣三萜酸提取量不断上升,并且增加幅度相对较大,原因可能是由于在一定范围内,超声时间越长,超声波的空化作用和机械作用加速物料与溶剂充分接触[24],使三萜酸越容易溶出。当超声时间超过30 min 之后三萜酸提取量随时间增加而逐渐降低,出现此现象可能因超声时间过长,破坏了三萜酸的结构[25],或是溶出的杂质增多,从而影响了提取效果。故选择30 min为最佳超声时间,此时其提取量为1.299 mg/g。
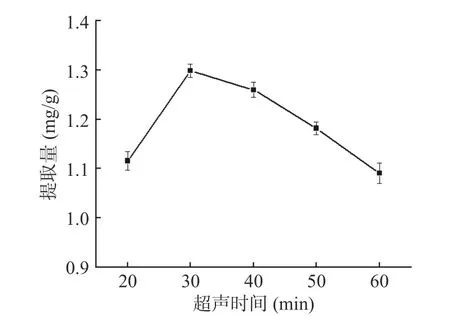
图5 超声时间对三萜酸提取量的影响Fig.5 Effect of ultrasonic time on yield of triterpenoid acid
2.3.4 超声功率对三萜酸提取量的影响 由图6 可以看出,超声功率在100~300 W 内三萜酸含量缓慢上升,当超声功率达到300 W 时三萜酸含量达到最高值1.193 mg/g,之后随着功率的增大含量稍有降低。这可能是由于超声功率过大使溶液中温度过高,造成目标物活性改变,同时产生的空化气泡增长过大,降低了空化作用的效果,阻碍超声波的传播[26],从而导致提取量降低。因此,选择超声功率为300 W。
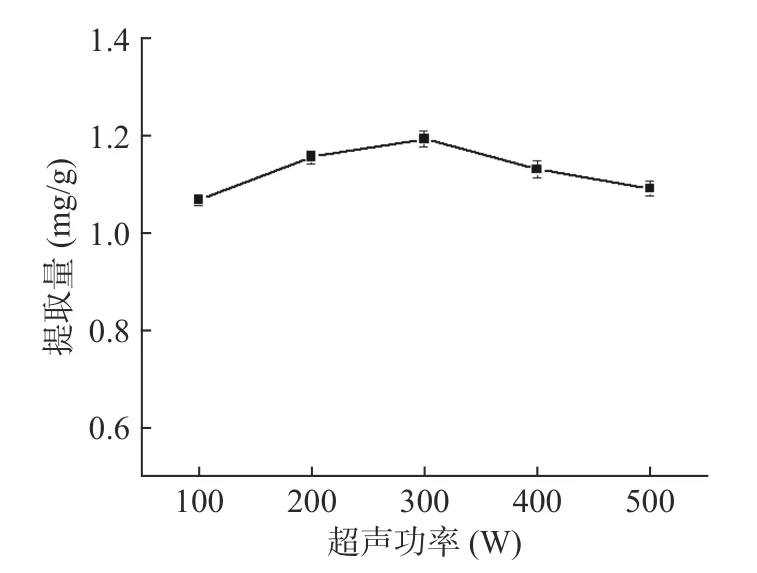
图6 超声功率对三萜酸提取量的影响Fig.6 Effect of ultrasonic power on yield of triterpenoid acid
2.4 响应面分析试验结果
2.4.1 建立回归模型及方差分析 根据单因素实验结果可得出,超声功率对黑化红枣三萜酸提取量的影响与其他三个因素相比较小,因此没有必要将其作为响应面设计的因素。根据Box-Benhnken 中心组合实验设计原理,选取乙醇浓度(A)、液料比(B)、超声时间(C)3 个因素进行响应面优化分析。试验设计与结果见表2。

表2 Box-Behnken 试验设计及结果Table 2 Box-Behnken design with experimental results
响应面试验设计结果如表3 所示。采用Design-Expert 8.0.6 软件对表2 试验结果进行多元回归拟合,得到二次多元回归方程:
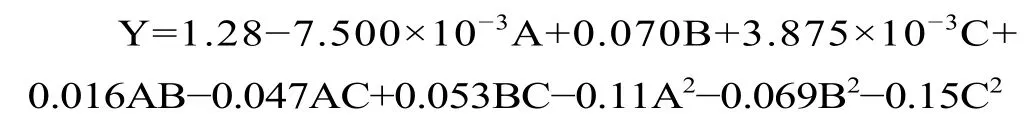
从表3 可看出,该回归模型的P<0.0001,说明模型是极显著;失拟项P=0.8991>0.05,失拟不显著,表示该模型对本试验拟合程度良好,在试验中产生的误差较小;模型的决定系数R2=0.9754,说明三萜酸提取量的变化有97.54%来自于所选试验因素,因此该回归方程可以很好地描述各试验因素与响应值之间的变化关系;校正决定系数RAdj2=0.9438,表明该模型能解释94.38%响应值的变化;模型变异系数CV=2.59%,说明重现性好,可用于黑化红枣三萜酸提取含量的分析和预测。回归方程各项方差中一次项B,二次项A2、B2、C2的P值均小于 0.01,影响达到极显著;交互项因素AC、BC 影响显著(P<0.05),AB 项不显著(P>0.05),这表明试验因素与黑化红枣三萜酸提取量之间不是简单的线性关系。通过比较F值可知,影响黑化红枣三萜酸提取量的各因素由大到小为B>A>C,即液料比>乙醇浓度>超声时间。

表3 回归方程方差分析结果Table 3 Results of variance analysis of regression equation
2.4.2 响应面交互作用分析 为了更直观地反映出两两因素交互作用对三萜酸提取效果的影响,根据回归方程绘制出其响应面图和等高线图,结果如图7所示。
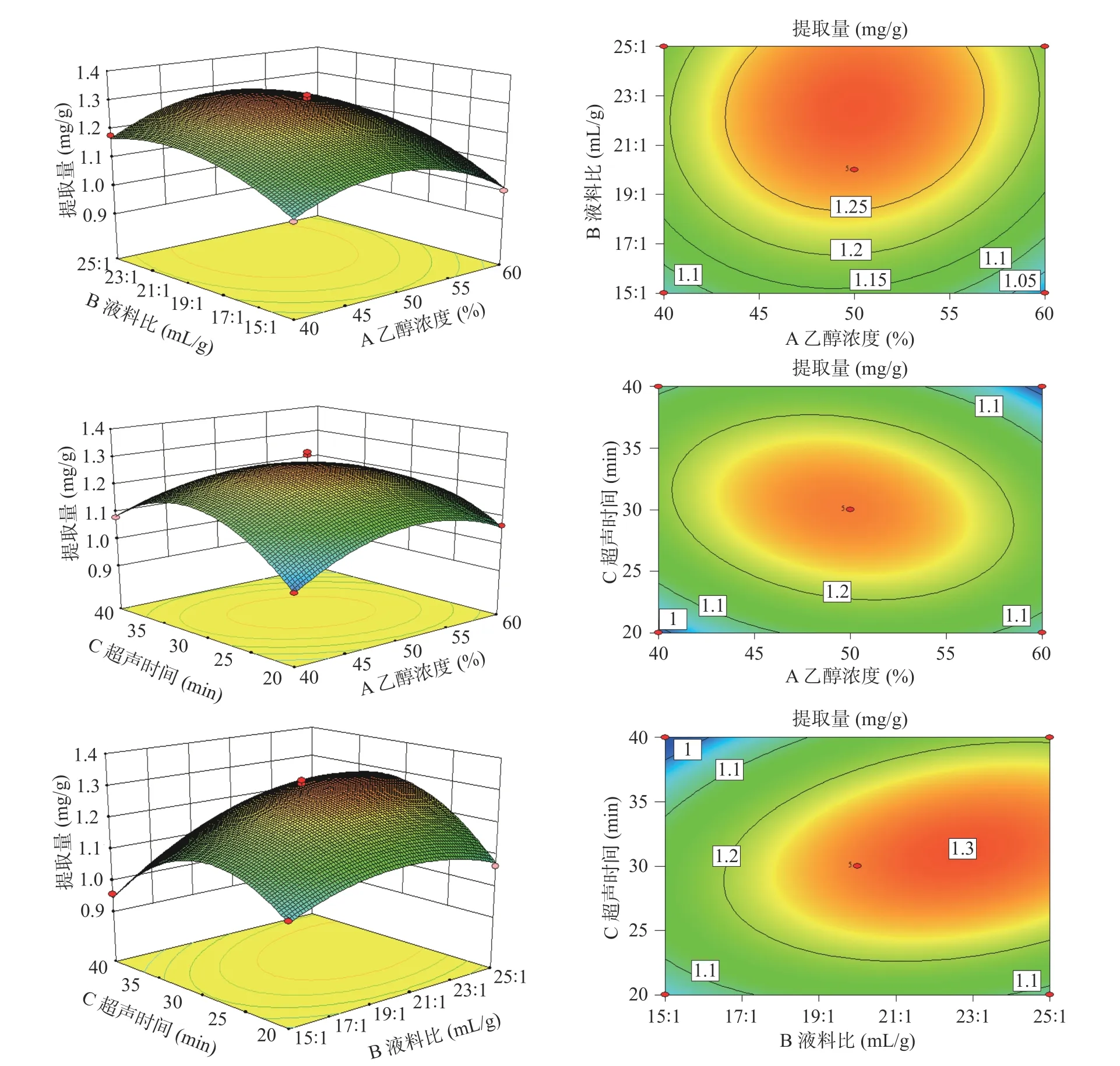
图7 各因素交互作用响应面及等高线图Fig.7 Response surface and contour plots showing the interactive effects of various factors
各因素交互作用对响应值影响程度的强弱与响应面坡度和等高线密集度有关。响应面坡度越陡峭,则黑化红枣三萜酸提取量受两两因素交互作用影响就越大,反之,影响就越小;等高线密集呈椭圆形,说明其交互作应对响应值的影响显著,等高线稀疏呈圆形,则表示其交互效应不显著[27]。由图7 可以看出,BC 交互作用的响应曲面坡度最陡峭,且其等高线图椭圆率高,表明液料比和超声时间的交互作用对黑化红枣三萜酸提取量影响最显著(P<0.01);乙醇浓度(A)和超声时间(C)影响相对显著(P<0.05),曲面较为陡峭,等高线图为椭圆形;AB 影响次之,即乙醇浓度和液料比,表现为曲面坡度变化较缓,且等高线图椭圆形状不明显,说明两者交互作用不显著。
2.5 验证实验
经Design-Expert 8.0.6 软件模型分析得出,黑化红枣三萜酸最优提取工艺为:乙醇浓度49.80%、液料比22.73:1 mL/g、超声时间31.15 min,此时三萜酸提取量理论预测值为1.300 mg/g。考虑到实际操作的方便性,将黑化红枣三萜酸提取条件调整为:乙醇浓度50%、液料比23:1 mL/g、超声时间30 min,在此条件下重复试验3 次,测得三萜酸提取量为1.313±0.01 mg/g,其RSD 为0.76%,结果与预测的理论相近,表明模型拟合良好,方法具有可行性。
2.6 黑化红枣三萜酸纯化结果
通过采用D-101 型大孔树脂对提取物进行初步纯化,结果得出,黑化红枣三萜酸粗提物与纯化物的纯度分别23.55%±0.60%和58.77%±0.52%,约为纯化前2.49 倍,表明该方法有效可行,适于黑化红枣三萜酸的纯化。
2.7 抗氧化分析
2.7.1 DPPH 自由基清除能力 由图8 可知,黑化红枣三萜酸粗提物、纯化物和VC都有清除DPPH 自由基的能力,并且与质量浓度呈正相关。在浓度0.5~1.5 mg/mL 范围内,粗提物对DPPH 的清除率仍保持着不断增加的趋势,而纯化物和VC增加趋势趋于平缓。当浓度为1.5 mg/mL 时,三萜酸纯化物对DPPH 自由基清除率达到最大值95.03%±0.83%,但稍弱于VC(97.10%±0.53%),与两者相比三萜酸粗提物效果最差,其清除率最高值为86.00%±0.30%。经线性拟合,黑化红枣三萜酸粗提物和纯化物对DPPH 自由基的IC50值分别为0.571、0.053 mg/mL,表明经纯化后三萜酸清除DPPH 自由基能力显著(P<0.05)高于纯化前。

图8 三萜酸DPPH 自由基清除效果Fig.8 DPPH radical scavenging effect of triterpenic acids
2.7.2 ABTS 自由基清除能力 从图9 可以看出,随着浓度的增加,黑化红枣粗提物、纯化物和VC都表现出较好的清除ABTS+·能力。在低浓度时,粗提物和纯化物抗氧化能力明显低于VC,尤其是粗提物。当质量浓度从0.01 mg/mL 上升到0.25 mg/mL 时,VC的清除率由46.50%±0.92%增至98.70%±0.60%,黑化红枣三萜酸粗提物和纯化物的清除率分别从5.70%±0.87%、12.67%±0.70%增至59.53%±0.93%、99.03%±0.52%。在质量浓度为0.25 mg/mL 时,三萜酸纯化物的清除效果稍高于VC,且显著(P<0.05)高于粗提取物。经线性拟合,其清除ABTS+·的IC50值分别为0.186、0.059 mg/mL,这说明黑化红枣三萜酸经过纯化后清除ABTS+·的能力增强。
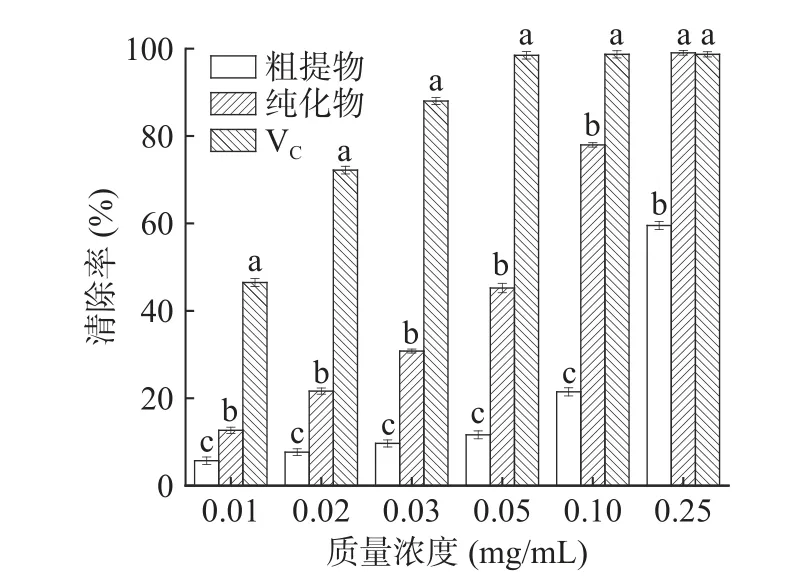
图9 三萜酸ABTS 自由基清除效果Fig.9 ABTS+· scavenging effect of triterpenic acids
2.7.3 总还原力 由图10 可以得出,在一定范围内,黑化红枣三萜酸粗提物、纯化物和VC的总还原能力都随浓度的增加而增大,样品浓度与活性呈现出明显的量效关系。当浓度增加到1.0 mg/mL 后,VC上升的趋势减缓。由图可知,两者与VC的还原能力排序为:VC>纯化物>粗提物,且三者在质量浓度为2.0 mg/mL时,总还原力分别达到最高值1.356、1.131 及0.72。表明黑化红枣三萜酸粗提物和纯化物具有一定的还原能力,但它的作用效果整体还是弱于VC。
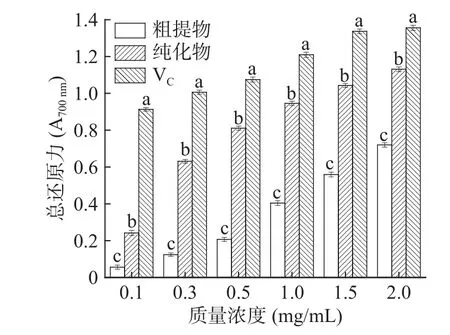
图10 三萜酸总还原力测定Fig.10 Determinatim of FRAP value of triterpenic acids
3 结论
本研究在单因素实验基础上,利用响应面法对超声辅助提取黑化红枣三萜酸条件进行了优化分析,并从二次回归模型方差分析对影响三萜酸提取量的因素之间相互作用进行了探讨,结果得出,液料比和超声时间影响极显著,乙醇浓度和超声时间交互作用显著,其余不显著;最佳提取工艺为:乙醇浓度50%、液料比23:1 mL/g、超声时间30 min、超声功率300 W,在此条件下黑化红枣三萜酸提取量达到了1.313±0.01 mg/g,与预测值结果相接近。说明此优化工艺参数可靠,提取效率高,操作简单可行。
通过抗氧化试验可知,黑化红枣三萜酸粗提物和纯化物对DPPH 自由基、ABTS 自由基的清除能力及总还原能力有较好的抗氧化活性,其对DPPH·清除率的IC50值分别为0.571、0.053 mg/mL,对ABTS+·清除率的IC50值分别为0.186、0.059 mg/mL,总还原力则随样品浓度升高而增大,经大孔树脂纯化后三萜酸抗氧化能力强于粗提物,说明其可作为天然的抗氧化剂。本实验初步研究了黑化红枣三萜酸提取及抗氧化活性,对于黑化前后红枣三萜酸的含量变化及组成特性尚未明确,因此,研究红枣黑化前后三萜酸变化特性及机理是今后需要解决的问题之一,为黑化红枣加工利用提供理论支撑,同时提高红枣产业原料的附加值。

