降解草酸盐乳酸菌株的筛选及其酸乳发酵特性
刘建利,何 旭,孙钦飞
(北方民族大学生物科学与工程学院,宁夏银川 750021)
食源性草酸在肠道的吸收和分解与高草酸尿症导致的草酸钙肾结石有密切关系[1−2],虽然理论上可以通过控制食源草酸的摄入来减少肠道对草酸的吸收,进而降低尿液中草酸的浓度,但许多常见的食物均含草酸,导致控制草酸摄入量这一途径难以实现。因此,加强肠道微生物对草酸的分解,是预防草酸钙结石较为理想的方法[3−4]。
对于草酸盐降解菌,目前研究最深入的是食草酸杆菌(Oxalobacter formigenes),该菌能以草酸盐作为其生长代谢的唯一或主要碳源,降解草酸效果显著[5−7]。但草酸杆菌不能很好地适应胃肠道环境,并且其生长必须有高浓度草酸,致使其胃肠道长期定植的难度大大增加。因此,只能在高草酸尿症治疗中使用[5,8]。
近年来,有研究表明乳酸菌能分解草酸盐作为碳源,但其生长不依赖草酸盐浓度,不以草酸盐作为唯一可利用碳源,是典型的兼性草酸营养型细菌,再加之乳酸菌在肠道内定植方面的天然优势,使其在预防高草酸尿症方面具有独特的优势[9−10]。已报道的能降解草酸盐的乳酸菌包括乳杆菌属(Lactobacillus)、双歧杆菌属(Bifidobacterium)、肠球菌属(Enterococcus)、明串珠菌属(Leuconostoc)、乳球菌属(Lactococcus)等[10−11]。通过酸乳摄入能定植于人体胃肠道的高效降解草酸盐乳酸菌是一种预防草酸钙肾结石的新途径,以往的研究只关注乳酸菌的草酸盐降解性能,鲜有涉及高效降解草酸盐菌株的酸乳发酵性能。因此,将这些高效降解草酸盐菌株应用于酸乳发酵,需要明确其酸乳发酵特性。
本实验通过检测从牧区自制酸奶、家庭自制泡菜、酵头等特色发酵食品分离的乳酸菌降解草酸盐能力、体外胃肠道耐受能力、发酵酸乳能力,以期获得既能高效降解草酸盐,又能耐受胃肠道环境,同时在酸乳中发酵特性优良菌株,为功能酸乳奠定基础。
1 材料与方法
1.1 材料与仪器
49 株乳酸菌(见表1) 北方民族大学生物科学实验示范中心保存;德氏乳杆菌保加利亚亚种(Lactobacillus delbrueckiisubsp.bulgaricus1805) 宁夏夏进乳业股份有限公司;胃蛋白酶(500 U/mg)、牛胆盐 Biotopped 公司;胰蛋白酶(250 U/mg) 北京拜耳迪生物公司;酵母提取物 英国Oxoid 公司;牛肉浸粉 青岛海博生物技术有限公司;纯牛奶 伊利利乐枕纯牛奶;葡萄糖、草酸钠、氯化钠、碳酸氢钠、酸氢二钾、无水乙酸钠、柠檬酸二铵、硫酸镁、硫酸钙、硫酸锰、吐温80 天津市大茂化学试剂厂;酸溶液参考鲍雅静等[12]、胆盐溶液等参考张丽[13]、人工模拟胃液参考杨续金[14]、人工模拟肠液参考张磊[15]和王立平[16]文献配制;草酸盐培养基:MRS 培养基[16]经高压蒸汽灭菌后,待温度冷却到约60 ℃时,在500 mL MRS 培养基中加入500 mL 使用0.22 μm滤膜过滤的20 mmol/L 草酸钠溶液,使其最终浓度为10 mmol/L。

表1 菌株编号及来源Table 1 Name and source of strains
SC-30 型恒温水浴锅 上海汉诺有限公司;UV765 型分光光度计 上海精科有限公司;TMSPRO 质构仪 配有不同规格的圆柱探头P/75,美国FTC 公司;UV-5500 紫外分光光度计 上海精密仪器仪表有限公司。
1.2 实验方法
1.2.1 高效降解草酸盐菌株的筛选
1.2.1.1 草酸盐标准曲线的制备 以草酸能催化铬酸钾氧化甲基红的原理,用分光光度法测量草酸盐浓度[17−18]。取7 个10 mL 的容量瓶分别加入0、0.8、1.6、2.4、3.2、4.0、4.8 mL 用1 mmol/L 草酸钠储备液稀释成为50 mol/L 草酸钠工作液,用蒸馏水定容到刻度后加入2.0 mL 0.4 mol/L 盐酸,2.0 mL 0.1 mmol/L甲基红溶液,4 mL 1.0 mmol/L 铬酸钾溶液,摇匀反应15 min,加入1 mL 1.0 mmol/L Zr(IV)摇匀终止反应。以蒸馏水做参比在515 nm 处测其硫酸钙吸光度值。以草酸钠浓度为横坐标,吸光度值为纵坐标,在Excel 中绘制标准曲线,回归方程y=−0.0189x+0.7701,决定系数R2=0.9912。
1.2.1.2 回收率实验 参考金朝霞[19]、董婷婷[20]的方法,取5 mL 含10 mmol/L 草酸钠的MRS 培养基,37 ℃ 100 r/min 摇床培养48 h,取1.5 mL 培养培养液,2500 r/min 离心10 min,取1 mL 上清液于10 mL的刻度试管中,加5 mL 蒸馏水,用少量0.25 mol/L NaOH 或者0.1 mol/L 盐酸调pH 至中性,蒸馏水定容至10 mL 再进行50 倍稀释,取10 mL稀释液于离心管中,加2.0 mL 饱和硫酸钙和20 mL 95%乙醇混匀。室温加盖静置3 h,2500 r/min 离心10 min,倒出上清液,沉淀即为草酸盐待测物。同标曲的方法,加入2.0 mL 0.4 mol/L 盐酸后做相同处理,以蒸馏水做参比在515 nm 处测吸光度值,代入标曲中计算获得检测液中草酸钠的浓度。
培养基中草酸钠浓度(mmol/L)=检测液中草酸钠浓度(μmol/L)×500/1000
式中:500 表示培养液到测定液的稀释倍数。
回收率(%)=对照培养基中草酸钠浓度×100/10
式中:10 表示培养基配制时加入的草酸钠浓度10 mmol/L。
1.2.1.3 菌株降解草酸盐能力测定 将保存在−80 ℃的乳酸菌菌种在常温中融化后,按接种量为2%的比例接种于5 mL MRS 培养基中、37 ℃100 r/min 摇床培养18~24 h 进行活化。取0.2 mL 活化菌液接种于5 mL 含10 mmol/L 草酸钠的MRS 培养基,37 ℃100 r/min 摇床培养48 h。以不接种乳酸菌,同样培养的空白草酸钠培养基为对照。当方法回收率在90%~110%时,测定试验菌株培养液和对照培养液的草酸钠浓度,计算各菌株草酸钠降解率。
降解率(%)=(1−菌株培养液草酸钠浓度/对照培养液草酸钠浓度)×100
1.2.2 菌株体外肠胃道耐受性测定 参考孙敏等[21]、赵瑞香等[22]、柏建玲等[23]和朱宏等[24]方法,稍作改动。将活化后的菌株按2%的比例接种于5 mL MRS 液体培养基中,37 ℃100 r/min 摇床培养24 h后,取培养液2 mL,12000 r/min 离心2 min 收集菌体,在超净工作台中倒掉上清液并加2 mL 灭菌生理盐水进行重悬;吸取菌悬液0.5 mL 分别加入到4.5 mL pH3.0 盐酸溶液、人工模拟胃液、胆盐溶液、人工模拟肠液和灭菌生理盐水中,37 ℃100 r/min 摇床培养4 h,取500 μL 上述处理液到5 mL 的MRS培养基中,37 ℃100 r/min 摇床培养8 h 后,在600 nm处测吸光度值,用以下公式计算菌株存活率,以保加利亚乳杆菌为对照(CK)。
存活率(%)=(B/A)×100
式中:A 表示生理盐水中培养吸光度值;B 表示各处理液中培养吸光度值。
1.2.3 菌株酸乳发酵特性评价
1.2.3.1 菌悬液的制备 将筛选出的乳酸菌按2%的比例接种到MRS 液体培养基中,37 ℃ 100 r/min摇床培养24 h,12000 r/min 离心2 min 收集菌体并调整菌悬液波长600 nm 出的吸光度值为2.5,用无菌蒸馏水清洗3 遍。
1.2.3.2 菌株发酵酸乳 参考袁凤霞等[25]方法,在纯牛奶中按15%的比例加入白砂糖,搅拌溶解后,在高压灭菌锅中95 ℃、120 Pa 灭菌5 min。准确量4 mL菌悬液加到灭菌的牛奶混合液中摇匀。在培养箱中40 ℃发酵8~12 h。以保加利亚乳杆菌发酵酸乳为对照(CK)。
1.2.3.3 酸乳品质感官评价 参照生庆海等[26]制作的感官评价表,随机选10 名16 级食品科学与工程班的学生对4 ℃冷藏12 h 后熟的酸乳,按感官评价标准从气味、质地、口感三个方面进行评价,计算平均值(表2)。

表2 酸乳感官评定标准表Table 2 Sensory evaluation standard of yoghourt
1.2.3.4 酸乳质构特性的测定 参考杨莹莹等[27]、徐鑫等[28]方法,选择TMS-75 mm 型号的测试探头测量酸乳的破裂力、硬度、内聚性、胶黏性、咀嚼性和弹性等质构指标。条件如下:最小触发力设置为0.3 N、采样速度10 Hz、两次压缩停留间隔为0 s、测前和测后速率为30 mm/min。
1.2.3.5 酸乳持水力测定 参考孙敏等[21]、袁凤霞等[25]方法,准确称取发酵后的酸乳15 g,4500 r/min离心10 min 后称取上清液的质量,并记录数据。持水力的计算公式如下所示:
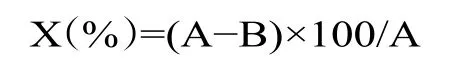
式中:X 表示持水力,%;A 表示样品质量,g;B 表示上清液质量,g。
1.2.3.6 酸乳滴定酸度和后酸度测定 参考孙敏等[21]、袁凤霞等[25]方法,取5 g 4 ℃贮存0、3、6 d的酸乳、40 mL 冷却煮沸水和5 滴5 g/L 酚酞酒精溶液,于三角瓶摇匀后,用已标定的NaOH 标准溶液滴定到微红色,且颜色在 30 s 内不消失即为滴定终点,记录消耗的 NaOH 标准溶液所用的毫升数。后酸度为第6 和第0 d 的酸度差。
1.2.4 菌株分子生物学鉴定 参照细菌基因组DNA提取试剂盒说明书;PCR 扩增16S rDNA,50 μL PCR 反应体系:25 μL 10×PCR Mix、1 μL 10 μmol/L的上下游引物(27F/1492R[29])、1 μL 模板DNA、22 μL ddH2O。PCR 反应程序为:预变性94 ℃ 10 min;变性94 ℃ 1 min;退火56 ℃ 1 min;延伸72 ℃ 1 min;30 个循环;后延伸72 ℃ 10 min,由南京金斯瑞生物公司进行测序。将测序序列在EZBioCloud 数据库中比对鉴定。分别以Weissella halotolerans(AB022926.1)和Lactobacillus bifermentans(M58809.1)16S rDNA序列为外群,利用MrBayes3.2.5 构建系统发育树。
1.3 数据处理
实验重复3 次,用Excel 作图,SPSS 21 软件对试验数据进行方差分析。
主成分分析法(PCA)评价[30]:采用SPSS21 软件将发酵酸乳品质指标进行主成分分析,取累计贡献率不低于85%且特征值大于1.00 的因子作为主成分。利用主成分对发酵酸乳进行综合评价,并将各主成分得分Fi 乘以相应权重后求和,就能得到综合评价函数。
2 结果与分析
2.1 高效降解草酸盐菌株筛选
49 株供试乳酸菌菌株表现出不同降解的效果,有7 株乳酸菌的培养基中草酸的降解率小于0,占总数的14.3%,在培养的过程中不仅没有降解草酸钠,甚至出现草酸盐含量增长的现象;23 株菌降解率0%~30%,占总数46.94%;降解率31%~69%的菌有10 株,占20.41%;只有菌株“天水A1”、“四川郫县A1”、“驼奶9”、“鲁青6”、“鄂温克”、“拉丝酸奶1”、“山南酸奶1”、“鲁济19”、“云南昆明A”等9 株菌的降解率在70%以上,占18.36%(图1),9 株菌中降解率最高的是菌株“拉丝酸奶1”,达86.96%(图2)。

图1 菌株草酸盐降解率Fig.1 Oxalate-degradation rate of strains

图2 降解率高于70%菌株Fig.2 Strains with oxalate-degradation rate more than 70%
2.2 菌株体外肠胃道耐受性
测定草酸盐降解率高于70%的9 株菌体外胃肠道耐受性,结果如图3,在pH3.0 的酸溶液中,9 株高降解菌的存活率在31%~67%之间,其中最高的菌株是“鲁青6”存活率为66.36%;在人工模拟胃液中,9 株菌的存活率在32%~61%之间,最高为菌株“鲁青6”,达60.13%;在胆盐溶液中,9 株菌的存活率在35%~73%之间,最高是菌株“拉丝酸奶1”,达72.19%;在人工模拟肠液中,各菌株的存活率均在69%~155%之间,菌株“鲁青6”、“鄂温克”的存活率在100%以上,分别为116.12%和153.26%。选取在各个溶液中的存活率耐受性均高于50%的3 株菌株“四川郫县A1”、“鄂温克”、“鲁青6”作为在胃肠道耐受性较好菌株。
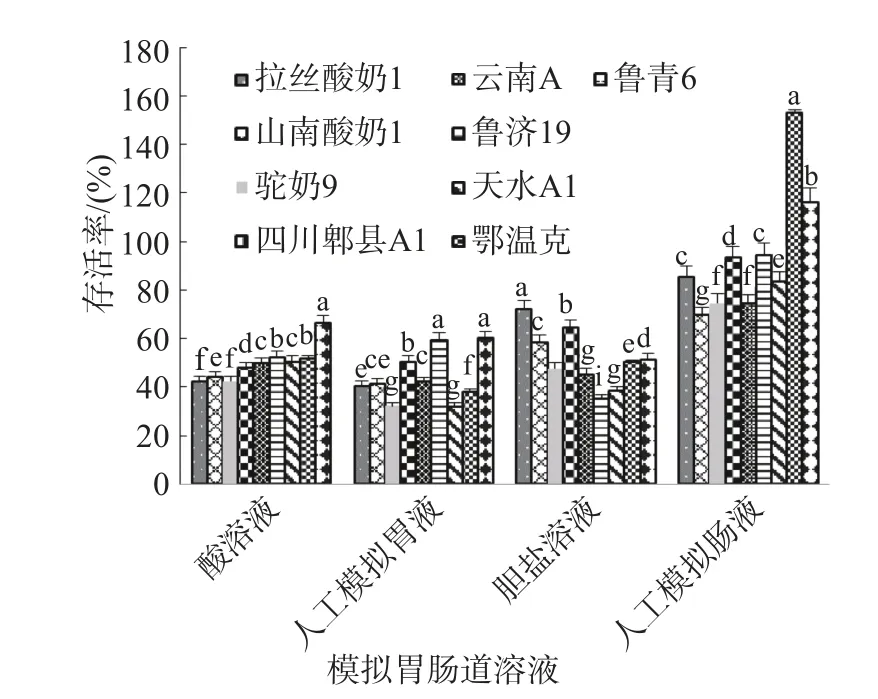
图3 高效降解草酸盐菌株模拟胃肠道耐受性结果Fig.3 Result of tolerance of strains with high efficient degradation oxalate in artificial simulated gastrointestinal tract environment
2.3 发酵酸乳特性评价
2.3.1 发酵酸乳品质感官评价 感官评价是发酵酸乳风味测评的一个重要手段,将体外胃肠道耐受性实验中筛选出的3 株菌以及对照菌用于制作酸乳,在后熟之后对酸乳的质地、气味以及口感三个方面进行评价。结果如表3,气味指标得分最高的是菌株对照保加利亚乳杆菌、菌株“四川郫县A1”和菌株“鄂温克”菌株发酵酸乳;质地和口感得分最高的是对照保加利亚乳杆菌、菌株“鲁青6”和菌株“鄂温克”菌株发酵酸乳;总计得分最高的是对照保加利亚乳杆菌和菌株“鲁青6”发酵酸乳,最低的是菌株“四川郫县A1”发酵酸乳。
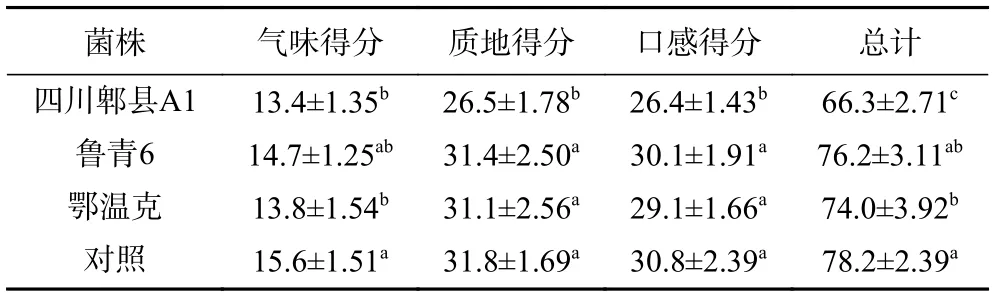
表3 各菌株发酵酸乳感官评价结果(分)Table 3 Sensory evaluation scores of yoghourts fermented with different strains (scores)
2.3.2 发酵酸乳持水力 酸乳持水力是指经过高速离心后,酸乳凝胶体系中总固形物对水分的保持能力,在酸乳持水力越高,说明大分子物质对水分子的作用力越强,稳定性也越好。各菌株发酵的酸乳的持水力在45%~75%之间(图4),其中持水力最大的是菌株“鄂温克”发酵酸乳,达到了75.61%,菌株“鲁青6”发酵酸乳次之,持水力最小的是菌株“四川郫县A1”的为47.73%。

图4 菌株发酵酸乳持水力Fig.4 Holding water capacity of yoghourt fermented with different strains
2.3.3 发酵酸乳酸度和后酸度 酸度是影响发酵酸乳口感的重要因素之一,后酸度对发酵酸乳贮藏期间的风味和贮藏时间有直接影响[31]。表4 可知,菌株“鄂温克”发酵酸乳的酸度最高,但保存6 d 后后酸度却最大,后酸度最小的是菌株“鲁青6”发酵酸乳,为10.66°T,其酸度也适宜。从发酵酸乳酸度和后酸度方面比较,菌株“鲁青6”发酵酸乳较好。
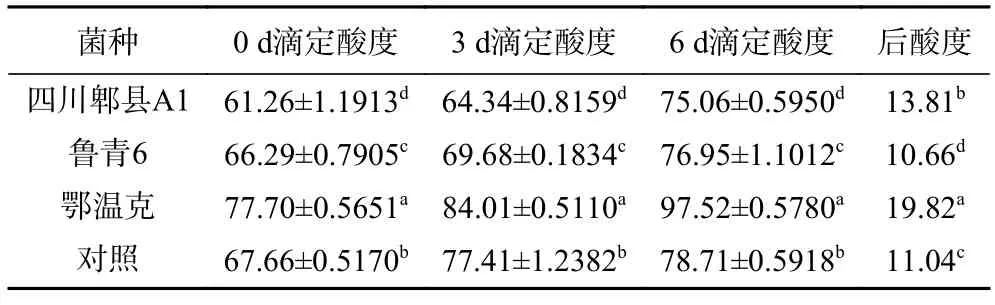
表4 菌株发酵酸乳酸度和后酸度(°T)Table 4 Titratable acidity and post-acidity of yoghourt fermented with different strains (°T)
2.3.4 发酵酸乳质构特性 质地是评价酸乳感官质量的重要指标之一,质构仪是一种测定食品质地的现代化精密仪器,可模拟人体口腔再以具体的数据客观地测评发酵酸乳质地,使分析的结果更准确。如图5、图6,4 株菌发酵酸乳的破裂力、咀嚼性、弹性以菌株“鲁青6”发酵酸乳的最高,硬度以菌株“鄂温克”发酵酸乳的最大,胶粘性和内聚力以菌株“鄂温克”和菌株“鲁青6”发酵酸乳最高。因此,菌株“鲁青6”发酵酸乳大多数质构指标较优。
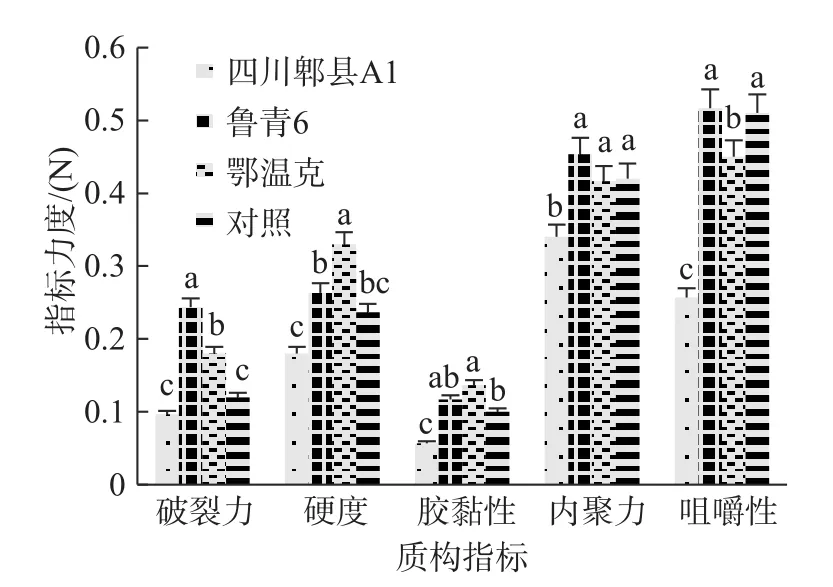
图5 菌株发酵酸乳的破裂力、硬度、胶黏性、内聚力、咀嚼性Fig.5 Rupture force,hardness,gumminess,cohesiveness and chewiness of yoghourt fermented with different strains

图6 高效降解菌株发酵酸乳弹性Fig.6 Springiness of yoghourt fermented with different strains
2.3.5 主成分分析法综合评价发酵酸乳品质 对酸乳的酸度、后酸度、持水力以及各质构指标进行主成分分析,根据特征值大于1、积累贡献率大于85%为标准能提取出两个主成分,如表5,这两个主成分的累计贡献率达到了85.538%,说明用这两个主成分能够反应原有变量的大多数数据的信息,其中,第一主成分的贡献率为63.224%,特征值为5.690;第二主成分的贡献率为22.314%,特征值为2.008。
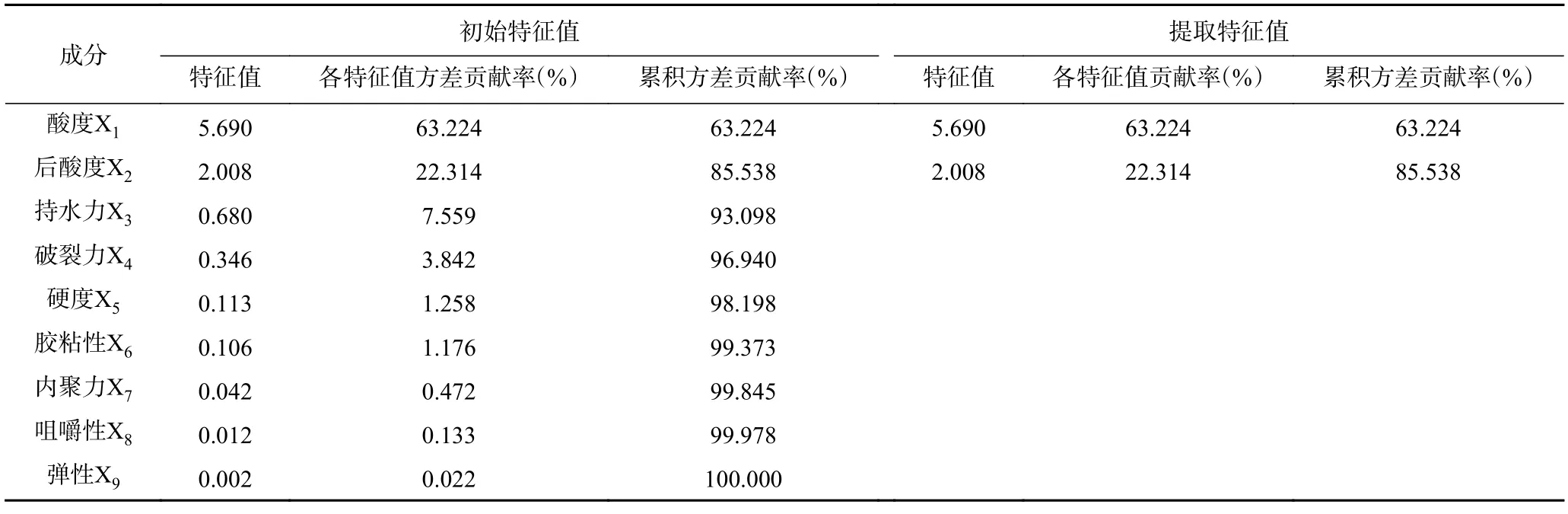
表5 总方差分解结果Table 5 Total variance explained
主成分旋转矩阵(表6),第一主成分里的高载荷指标有破裂力X4(因子载荷值为0.797)、内聚力X7(因子载荷值为0.882)、咀嚼性X8(因子载荷值为0.892)、弹性X9(因子载荷值为0.909);第二主成分包含的高载荷指标有酸度X1(因子载荷值为0.923)、后酸度X2(因子载荷值为0.879)、持水力X3(因子载荷值为0.736)、硬度X5(因子载荷值为0.807)、胶粘性X6(因子载荷值为0.667)。
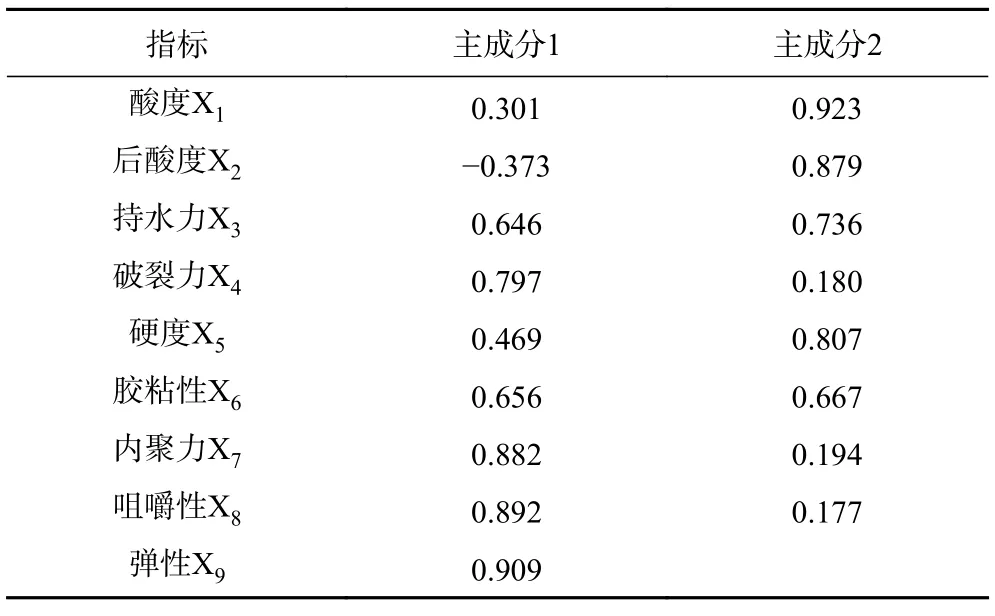
表6 主成分载荷矩阵Table 6 Principal component loading matrix of PCA
由表6 可得出各主成分的表达式:
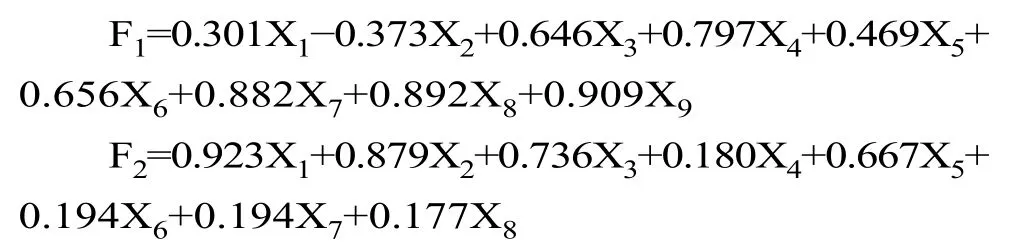
通过以上2 个主成分可构建出酸乳的综合品质评价模型F:
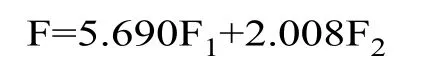
根据的综合品质评价模型可得各菌株发酵酸乳综合得分,如表7,菌株“鲁青6”和菌株“鄂温克”发酵酸乳得分较高,表明菌株“鄂温克”和菌株“鲁青6”发酵酸乳品质最好。
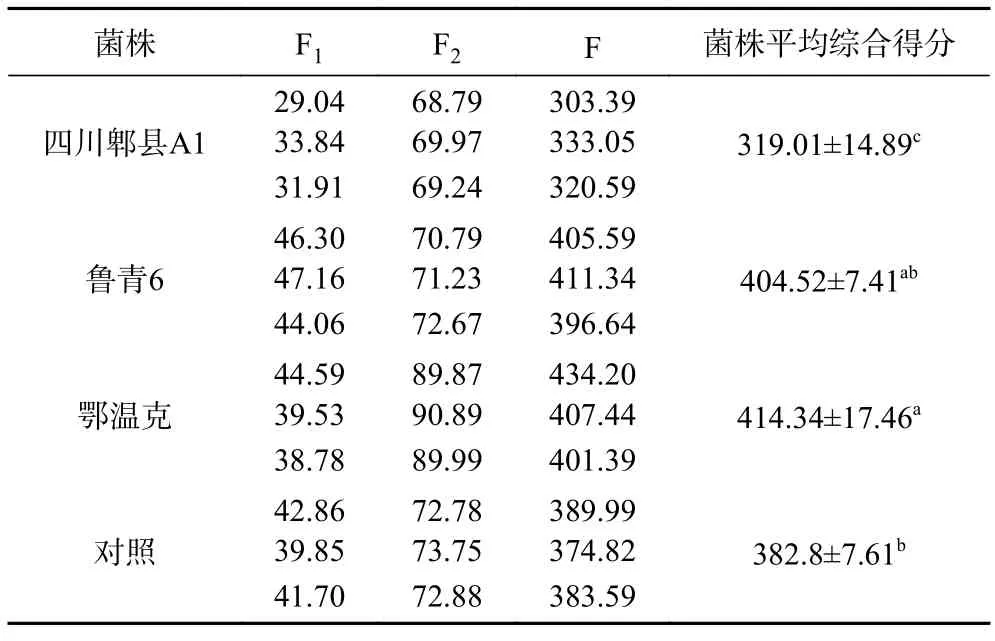
表7 高效降解菌株发酵酸乳的主成分得分和综合得分Table 7 Principal component scores and comprehensive scores of yoghourt fermented efficient degradation strains
2.4 菌株分子鉴定
菌株“鲁青6”和“鄂温克”既能高效降解草酸盐,又能耐受胃肠道,同时酸乳发酵特性优良。提取菌株基因组 DNA,采用 PCR 扩增16S rDNA 序列,获得约1500 bp 序列,测序后将序列在Ezbiocloud中比对,结果显示菌株“鲁青6”的16S rDNA 序列与Weissella cibariaKACC11862(Type)的 16S rDNA 序列(AEKT01000037)相似度高达100%,菌株“鄂温克”的16S rDNA 序列与Lactobacillus paracaseisubsp.toleransJCM 1171(Type)的16S rDNA 序列(D16550)相似度高达100%,将序列和属其他种的16S rDNA 用Bayes 法构建系统发育树上,显示“鲁青6”与食窦魏斯氏菌(Weissella cibaria)聚在一起(图7),“鄂温克”与副干酪乳杆菌(Lactobacillus paracasei)聚在一起(图8)。因此,菌株“鲁青6”为食窦魏斯氏菌,菌株“鄂温克”为副干酪乳杆菌。

图7 基于16S rDNA 用Bayes 法构建魏斯氏菌属系统发育树Fig.7 Phylogenetic tree of the genera Weissella based on 16S rDNA sequences

图8 基于16S rDNA 用 Bayes 法构建乳杆菌属系统发育树Fig.8 Phylogenetic tree of the genera Lactobacillus based on 16S rDNA sequences
3 结论与讨论
不同生境、不同种属的乳酸菌降解草酸盐的能力不同。Weese 等[32]报道来自犬粪便样品的37 株乳酸菌体外降解草酸盐活性最高65%。Federici等[33]报道动物双歧杆菌菌株(Bifidobacterium animalis)DSM10104 降解率为61%,而长双歧杆菌(Bifidobacterium longum)菌株MB 282 和青春双歧杆菌(Bifidobacterium adolescentic)菌株MB 238 的降解率分别为35%和57%,短双歧杆菌(Bifidobacterium breve)菌株MB 283 的降解率为38%。本实验49 株供试乳酸菌中,约38.77%降解率的菌株在30%以上,18.36%降解率的菌株在70%以上,降解率最高达86.96%。不仅具有降解能力的菌株比例高,部分菌株对培养基中的草酸盐的降解率也高于报道,提示我们中国民间传统发酵食品中蕴藏着丰富而独特的微生物资源,有待于进一步发掘。
本实验获得食窦魏斯氏菌菌株“鲁青6”和副干酪乳杆菌菌株“鄂温克”既能高效降解草酸盐,又能耐受胃肠道,同时酸乳发酵特性优良,但本实验仅进行了菌株体外降解草酸盐实验,后续开展2 株菌体内降解实验和菌株安全性评价实验取得较好结果后,2 株菌可作为功能酸乳开发候选发酵菌株。

