退化高寒草甸土壤细菌群落特征对补播的响应研究
尹亚丽,刘 颖,2,李世雄,2*
(1.青海大学畜牧兽医科学院,青海省畜牧兽医科学院,青海 西宁 810016;2.省部共建三江源区高寒草地生态教育部重点实验室,青海大学,青海 西宁 810016)
高寒草甸是在寒冷的环境下由青藏高原隆升后,特化形成的一种高寒植被类型,其植被物种丰富,群落结构简单,草层低矮,草质优良,为良好的天然牧场。近年来,受全球气候变化与人类活动的共同影响[1],加之不合理的放牧管理和家畜数量与草地资源的不当匹配,使得草地严重超载,草地环境日益恶化,大面积的优良草地出现不同程度退化[2]。草地退化,地面覆盖度降低,土壤侵蚀、水土流失,草地生产力下降,生态系统结构和功能严重受损,其不仅阻碍了牧区社会、经济和生态环境的可持续发展,还严重威胁到长江流域和黄河中下游地区的生态平衡与人类的生存发展[3]。补播是退化草地快速恢复治理的有效途径之一[4-5],通过播种适宜草种来调整草地群落结构,加强优良牧草竞争优势,以提高草地生产力和优质牧草比例,调节草地植被物种组成,提高草层高度,扩大草地植被盖度。
土壤细菌作为土壤微生物中含量最多、丰度最高的类群,具有最为丰富的遗传多样性,促进营养物质释放、有机质的分解,参与C、N等物质循环过程[6-7],在土壤生态过程中有着不可或缺的地位。然而,微生物生命周期短暂,其结构和功能对生存的微环境极其敏感,可对环境变化做出快速反应[6,8]。退化草地补播修复,原有的土壤微环境受到扰动,土壤质量和养分循环发生根本改变,逐渐形成了与之相适应的土壤微生物群落结构并发挥其相应功能[9]。近五年来,有关学者对土壤中微生物的原位生存状态的研究发现,传统的分离培养方法很难全面地估计土壤中微生物群落多样性,从土壤中简单提取、培养的方法只能反映极少数微生物的信息[10],随着高通量基因检测技术的发展与成熟,为生态系统中微生物的研究提供了新的手段。鉴于此,本研究采用高通量基因检测技术,对补播措施下高寒草甸土壤细菌群落特征进行研究,明确土壤细菌群落组成、结构及功能对补播措施的响应规律,以期为退化草地恢复治理提供科学支撑。
1 材料与方法
1.1 试验地概况
试验地位于青海省果洛藏族自治州玛沁县大武镇(100°12′49.6″ E,34°27′51.9″ N,海拔约3 740 m),属典型高原大陆型气候,干旱、多风,太阳辐射强,日照时间短,昼夜温差大。年均气温-3.9 ℃,最冷月平均气温为-12.6 ℃,最热月平均气温为9.7 ℃,冷季长、暖季短。年降水量513.2~542.9 mm,主要集中于5—9月,年蒸发量2 471.6 mm。牧草生长季约150 d,全年无绝对无霜期。草地为高寒矮嵩草(Kobresiahumili) 草甸,退化草地主要植物有莎草科、禾本科、菊科、龙胆科、蔷薇科、豆科及杂类草等;土壤为高山草甸土。
1.2 试验方法
参照马玉寿等[11]的分类标准,依据草地植被覆盖度、可食牧草及毒害草比例和草场质量等指标,将草地评定为中度退化草地。2006年利用青海草地早熟禾对中度退化草地进行补播处理,播种量3.75 kg/hm2,并以150 kg/hm2施用尿素,补播后未进行后续改良。2016年5月,在中度退化(Moderate-degradation,MD;MD-1和MD-2分别代表该草地0~10 cm和10~20 cm土层)及补播草地(Reseeding,RS;RS-1和RS-2分别代表该草地0~10 cm和10~20 cm土层),各划定4个试验小区为重复,每小区面积约200 m2。2017年8月,采用蛇形取样法,以直径3.5 cm的根钻在各小区采集0~10 cm 和10~20 cm土样,每小区5~8钻分层混合为1个土样,过2 mm筛,捡除枯物、石粒及植物根系等,装入自封袋,4 ℃运回实验室,充分混匀后装入10 mL离心管,干冰运输至广州基迪奥生物科技有限公司进行Metagenomic测序,测序和生物信息服务在Illumina PE250平台完成。
采用HiPure Soil DNA Mini Kit ( Magen公司,中国广州) 提取土壤DNA。取2 μL DNA样品,采用NanoDrop微量分光光度计(NanoDrop 2000,Thermo Fisher,USA)测定核酸的吸光度,检测核酸的纯度。采用琼脂糖(1% agarose)凝胶电泳检测核酸样品的完整性和蛋白污染程度。取2 μL DNA样品,采用Qubit荧光定量(Qubit 3.0,Thermo Fisher,USA)检测每一个样品的DNA浓度,并根据浓度计算样品DNA总量。采用微生物Marker基因高通量测序评估土壤细菌群落结构和多样性,细菌检测区为16S rRNA基因的V3+V4区。
测序得到的Raw reads通过过滤、Tags拼接、过滤、去嵌合体,对N50、N90 Tags由长到短加和,最终在有效Tags样本中随机选取(8.0~9.2)×104Tags开展OTU (operational taxonomic units)聚类分析。用Uparse软件对所有样品的全部有效Tags序列聚类,以97%的一致性将序列聚类成为OTUs结果,并计算出每个OTU在各个样品中的Tags绝对丰度和相对信息。采用Silva (Quast et al,2013)数据库进行物种注释(设定置信度的阈值为0.8~1.0),并根据注释信息统计每个样品在各个分类水平(界、门、纲、目、科、属、种)上的Tags序列数目。基于OTUs计数统计,利用Bray-Curtis距离系数分析土壤细菌群落差异,采用Faprotax数据库对土壤细菌生态功能进行预测。
1.3 测定指标
(1)Chao1指数在生态学中用来估计物种总数。Chao1=Sobs+F1(F1-1)/2(F2+1),式中:Sobs表示样本中观察到OTU数目,F1是样本中数量只为1的OTU数目(称为Singleton),F2是样本中数量只为2的OTU数目(称为Doubleton)。


1.4 数据处理
采用Excel 2010进行数据整理及单因素(one-way ANOVA)和T检验(α=0.05),Spass 17.0进行Wilcoxon秩和检验,采用R 3.5.2进行细菌物种组成、群落多样性及PCoA分析;利用Excel 2010和R 3.5.2软件作图,图表中数据为平均值±标准差。
2 结果与分析
2.1 补播对土壤细菌物种组成的影响
本试验从补播及退化草地土壤样品中读取的细菌序列属于10个门,包括浮霉菌门(Planctomycetes) 、酸杆菌门 (Acidobacteria)、变形菌门(Proteobacteria)、疣微菌门(Verrucomicrobia)、放线菌门(Actinobacteria)、芽单胞菌门 (Gemmatimonadetes)、绿弯菌门(Chloroflexi)、硝化螺旋菌门(Nitrospirae)、拟杆菌门 (Bacteroidetes)和厚壁菌门(Firmicutes)(图1)。
由图1可知,浮霉菌门、变形菌门、疣微菌门、酸杆菌门和放线菌门为退化及补播草地土壤优势细菌,五者在土壤细菌中占比超过75%。0~10 cm土层,浮霉菌门、变形菌门、疣微菌门、酸杆菌门和放线菌门优势细菌相对丰度在退化及补播草地分别为15%和30%、22%和17%、13%和 15%、23%和16%、10%和7%。T检验结果显示,酸杆菌门、硝化螺旋菌门和厚壁菌门细菌相对丰度在退化草地和补播草地间差异显著(P<0.05);10~20 cm土层,上述五者优势细菌在退化及补播草地分别为18%和27%、17.4%和16.7%、11%和 13%、20%和19%、9%和6%。两草地门水平土壤细菌T检验结果显示,绿弯菌门、硝化螺旋菌门和拟杆菌门细菌丰度在两草地间显著差异。即补播后优势细菌浮霉菌门、疣微菌门相对丰度升高,酸杆菌门、变形菌门和放线菌门相对丰度降低,补播改变了草地土壤细菌物种组成,且同一草地不同土层土壤细菌物种存在差异。

图1 补播及退化草地土壤细菌门水平相对丰度Fig.1 Relative abundance of soil bacteria phylum level in reseeding and degraded grassland
2.2 补播对土壤细菌群落多样性的影响
表1为补播对草地土壤细菌群落多样性的变化。由表1可知,退化及补播草地0~10 cm土壤细菌多样性指数均高于10~20 cm。在0~10 cm土层,补播后草地土壤细菌Simpson指数显著升高(P<0.05),而土壤细菌Shannon指数、Chao1指数无明显变化;在10~20 cm土层,补播草地土壤细菌Shannon和Simpson指数指数均显著升高,其中Shannon指数升高0.34,而Chao1指数在两草地间无显著差异(P>0.05)。即补播对草地表土层土壤细菌多样性影响较小,而对下土层土壤细菌多样性影响较大。

表1 补播对退化草地土壤细菌群落多样性的影响Tab.1 Effects of reseeding on the diversity of soil bacterial community in degraded grassland
2.3 补播对土壤细菌群落结构的影响
采用Bray距离对草地土壤细菌OTU进行主坐标分析(PCoA),由图2可知,PCo1对土壤细菌群落结构差异的解释度为46.45%,PCo2的解释度为16.73%,两轴解释度总和达63.18%。Wilcoxon秩和检验结果显示,同一草地不同土层土壤细菌群落结构无显著差异(P<0.05)。在0~10 cm土层,退化草地与补播草地间土壤细菌群落结构差异极显著(P<0.01);在10~20 cm土层,不同草地土壤细菌群落结构无明显差异(P=0.06>0.05)。即补播改变了草地表土层土壤细菌群落结构。

图2 补播对退化草地土壤细菌群落结构的影响Fig.2 Effects of reseeding on the structure of soil bacterial community in degraded grassland
2.4 补播对土壤细菌功能结构的影响
采用Faprotax对补播草地和退化草地土壤细菌群落进行生态功能预测,在退化及补播草地共注释功能菌62种,其中0~10 cm土层有47种在不同草地间表现差异;10~20 cm土层有59种在不同草地间表现差异(P<0.05)。对丰度前十的功能菌进行分析,由图3、图4可知,化能异养(包含有氧化能异养)、硝化作用、亚硝酸盐氧化及硫代谢作用细菌在草地土壤中起主要功能调节作用。T检验结果显示,在0~10 cm土层,硝化作用、亚硝酸盐氧化作用、硫及硫化物呼吸作用和动物寄生共生作用细菌在退化及补播草地间差异显著(P<0.05);在10~20 cm土层,化能异养作用、有氧化能异养、硝化作用、亚硝酸盐氧化作用、动物寄生共生作用、芳香族化合物降解作用及硝酸盐还原作用细菌在退化及补播草地间差异显著(P<0.05)。
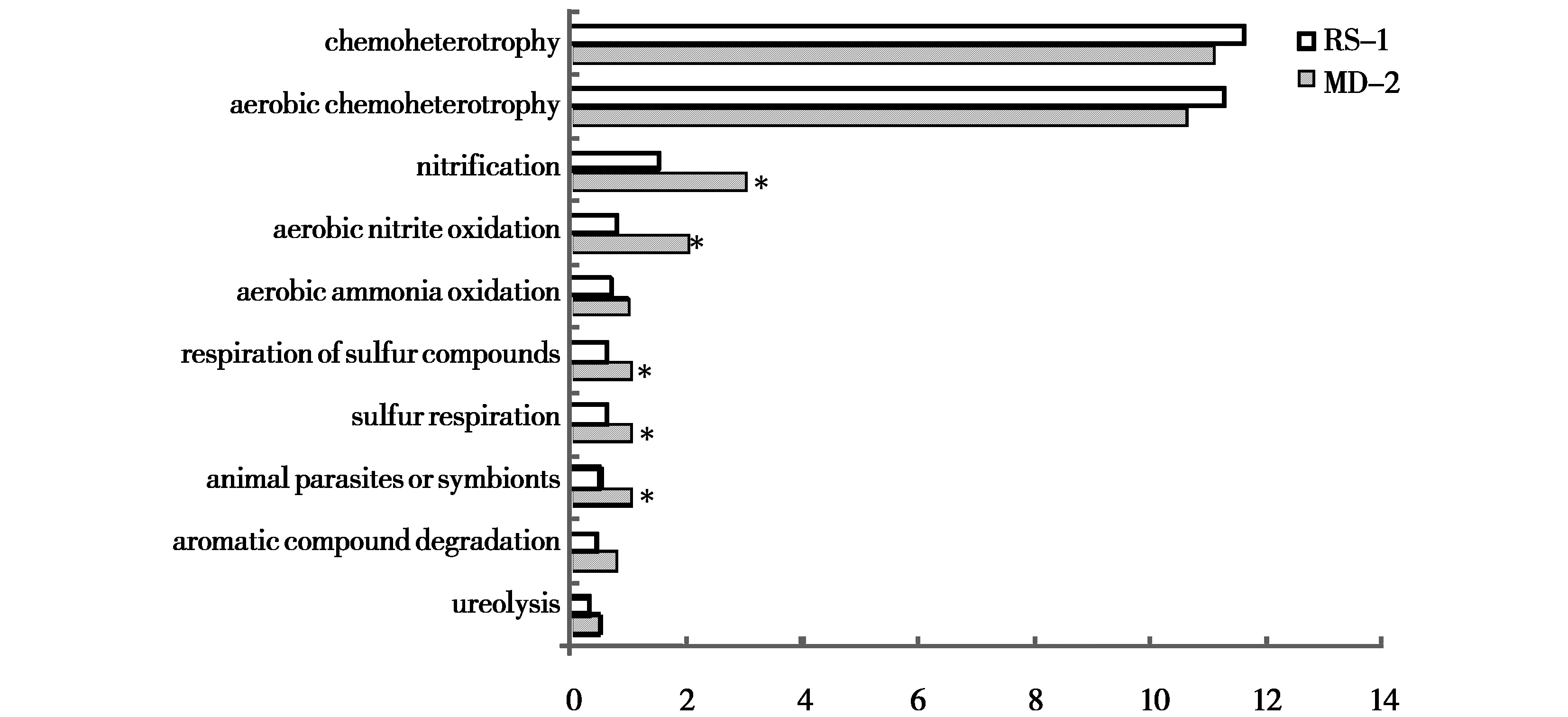
注:*表示两草地间差异显著,下同。化能异养(chemoheterotrophy);有氧化能异养(aerobic chemoheterotrophy);硝化作用(nitrification);亚硝酸盐氧化(aerobic nitrite oxidation);氨氧化作用(aerobic ammonia oxidation);硫化物呼吸(respiration of sulfur compounds);硫呼吸作用(sulfur respiration);动物寄生-共生作用(animal parasites or symbionts);芳香族化合物降解(aromatic compound degradation);尿解作用(ureolysis);下同。图3 补播对0~10 cm土层土壤细菌群落功能结构的影响Fig.3 Effects of reseeding on the functional structure of soil bacterial community in 0~10 cm soil layer
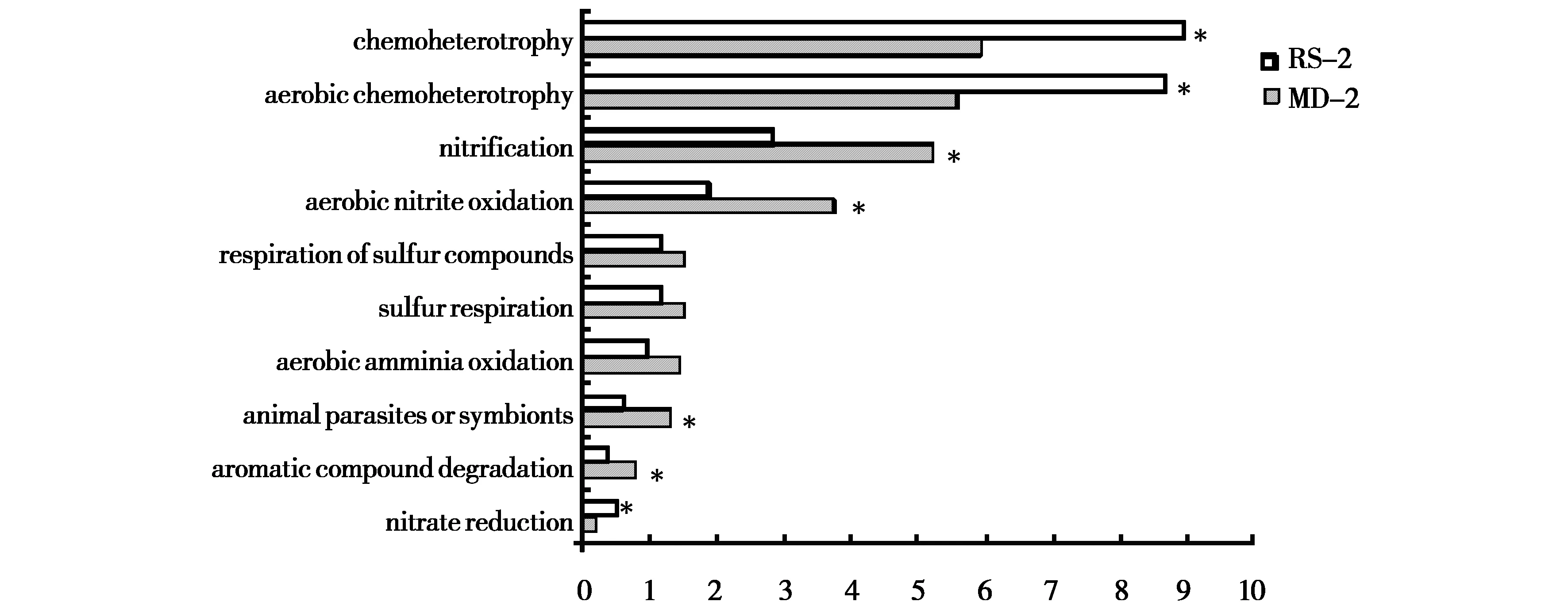
注:硝酸盐还原(nitrate reduction)。图4 补播对10~20 cm土层土壤细菌群落功能的影响Fig.4 Effects of reseeding on the functional structure of soil bacterial community in 10~20 cm soil layer
3 讨论与结论
土壤微生物是土壤中一切生态功能的媒介[12],作为草地地下生态系统最大的资源库,是土壤有机质和土壤养分等在土壤和大气圈双向循环和转化中的主要推动力,其生命周期短,对生存的微环境十分敏感,能对土壤生态变化和环境胁迫做出快速反应[13-15]。本研究表明,退化高寒草甸补播后草地土壤细菌物种组成发生明显改变,补播草地土壤浮霉菌门和疣微菌门细菌相对丰度升高,酸杆菌门、变形菌门和放线菌门细菌相对丰度降低。补播对草地表土层土壤细菌多样性影响较小,而对下土层细菌多样性影响较大。造成此结果的原因可能是因补播改变了退化草地地上植被物种组成,土壤中有机物质输入及土壤性质发生相应变化,加之土壤生物竞争、对物理和生物环境的扰动适应性等因素的共同作用[16-17],导致土壤细菌物种组成及群落多样性发生变化。
同一草地不同土层间土壤细菌群落结构差异不显著;但是在同一土层不同草地间土壤细菌群落结构表现显著差异,补播改变了草地0~10 cm土层细菌群落结构。化能异养(包含有氧化能异养)、硝化作用、亚硝酸盐氧化及硫代谢作用细菌在草地土壤中起主要功能调节作用,补播改变了退化草地土壤细菌功能结构。包明等[18]研究指出硝化作用、化能异养作用、氨氧化作用、亚硝酸盐氧化及硝酸盐还原作用功能类细菌在土壤中具有较高的丰度,这与本研究结果基本一致。补播后草地土壤亚硝酸盐氧化作用细菌显著减少,这一结果可能与微生物物种组成改变有关,新的优势物种与相关功能物种存在种间协同-竞争;同时与土壤性质变化有关,土壤性质的变化引致微生物生存环境改变[19-21]。此外,地上植被组成的改变可能会影响某些土壤微生物群落的发展和种群组成[22],土壤凋落物投入的改变导致微生物底物有效性的变化。Yang等[15]研究也指出土壤微生物群落功能结构的变化主要受地上植被、土壤碳氮比和铵态氮含量的控制。由此可知补播改变了退化高寒草甸土壤细菌群落及功能结构。

