PEG-6000模拟干旱胁迫及复水对鹰嘴豆种子萌发和芽苗生长的影响
司 诚,李宗仁,沈宁东
(青海大学农牧学院, 青海 西宁 810016)
鹰嘴豆(CicerarietinumL.)又名羊头豆、桃豆、脑豆子等,属豆科(Leguminosaes)鹰嘴豆属(Cicer),一年生的草本植物[1]。鹰嘴豆起源于亚洲西部、中东地区,主要分布在地中海沿岸、亚洲、美洲等,在中国的甘肃、新疆等地种植较多[2]。鹰嘴豆营养成分全,籽粒含蛋白质、碳水化合物、脂肪及丰富的脂肪酸等,具有解毒、养颜等多种功效,是一种可供糖尿病、高血糖患者和中老年人长期食用的低淀粉、高蛋白、纯天然的食品[3-4]。目前,国内有关鹰嘴豆的研究主要集中在对其所含营养成分提取、栽培技术、食品加工、药用价值以及种子萌发等多个方面,其次在其抗盐、引种等方面也有少数研究[5-7]。干旱作为影响植物生长的非生物因子之一,常常会引起植物对于干旱的不同响应,如膜透性,脯氨酸含量等的变化。不同植物对于干旱的抵抗能力、复水后植物自身的补偿效应等都有所差异,鹰嘴豆根系发达,具有较强的耐旱性,而目前国内外关于模拟干旱及复水对鹰嘴豆种子萌发及芽苗生长影响的研究鲜少报道。鉴于此,本研究采用PEG-6000模拟干旱的方法,研究鹰嘴豆种子萌发时抵制和忍耐渗透胁迫的生理生态机制,结果可为鹰嘴豆的抗性研究、灌溉栽培等提供基础材料,同时为其在干旱地区育种、引种等提供理论依据。
1 材料和方法
1.1 试验材料
供试鹰嘴豆种子由乌鲁木齐市广泰峰糖酒有限公司提供,产地为新疆维吾尔自治区木垒县。
1.2 试验设计
1.2.1 PEG-6000干旱胁迫处理及种子萌发试验
先将鹰嘴豆种子用0.5%高锰酸钾消毒5 min,用蒸馏水冲洗干净,分别以浓度为0%、5%、10%、15%、20% 的PEG-6000处理,0%即以蒸馏水处理,作为对照CK。在25 ℃恒温培养箱中,于90 mm培养皿中培养,以2层滤纸作为发芽床。经PEG-6000胁迫处理后,发芽的第5天,测定芽苗形态指标和各项生理指标。
1.2.2 复水试验
各浓度的PEG-6000干旱胁迫5 d后,开始复水试验,分别于复水1、3、5 d测鹰嘴豆芽苗生理指标的变化。并在复水5 d时,观测鹰嘴豆芽苗的形态。
1.3 测定指标与方法
1.3.1 种子萌发指标测定[8]
萌发时滞(h):即萌发开始时间,自萌发试验开始到第1粒种子开始萌发所持续的时间。
发芽率(GR)=(5 d内正常发芽的种子数/供试种子总数)×100%。
发芽指数(GI)=∑(Gt/Dt),式中:Gt表示在第t天种子的发芽数,Dt代表相应的发芽天数。
活力指数(VI)=GI×S,式中:S为第5天测得的整株幼苗鲜重(g)。
1.3.2 芽苗形态指标的测定
分别在干旱胁迫处理第5天及复水后第5天时测定芽苗形态,从各个培养皿中随机选取10株,洗净并用吸水纸吸干水分,测定其最大根长(root length,RL)、芽长(bud length,BL)、鲜重(fresh weight,FW)等指标。
1.3.3 生理指标的测定
(1)游离脯氨酸(Pro)含量测定。脯氨酸含量用茚三酮比色法测定[9],试验前,制作脯氨酸的标准曲线:Y=73.612 5x+0.412 7(R2=0.999 76,Y:脯氨酸浓度(μg/mL),x:吸光值),样品用分光光度计在520 nm波长处测定吸光值。根据公式计算脯氨酸含量:脯氨酸含量(μg/g)=(脯氨酸浓度×3%磺基水杨酸用量)/样品鲜重。
(2)丙二醛(Malondialdehyde,MDA)含量测定。丙二醛(MDA)含量测定参照Velikova的TBA(硫代巴比妥酸)检测法[10],其计算公式:MDA含量(μmol/g)=[6.452×(A532-A600)-0.559×A450]×Vt/(Vs×W),式中:A为吸光值,Vt为提取液总体积(10 mL),Vs为测定时提取液的体积(2 mL),W为样品重(g)。
(3)可溶性糖含量的测定。采用蒽酮法[11]测定可溶性糖含量,标准曲线:Y=158.381 7x-2.503 5 (R2=0.996 7,Y:可溶性糖浓度(μg/mL),x:吸光值),测定时称取试验材料0.200 g左右,剪碎放入三角瓶内加入25 mL沸水,将三角瓶放入水浴锅沸水浴10 min,冷却后过滤定容至50 mL。根据公式计算样品中可溶性糖的含量:可溶性糖含量(μg/g)=(w×V1) /(V2×W),式中:w为可溶性糖浓度(μg/mL),V1为提取液体积(50 mL),V2为测试液体积(2 mL),W为样品重(g)。
(4)可溶性蛋白质含量测定。选用考马斯亮蓝G-250法[9]测定蛋白质含量,根据595 nm波长下测得的标准牛血清白蛋白溶液的吸光值,标准曲线:Y=232.558x+0.279(R2=0.999 3,Y:蛋白质浓度(μg/mL) ,x:吸光值)。根据公式计算样品蛋白质含量:蛋白质含量(ug/g)=A×V1/(V2×W),式中:A为蛋白质浓度(μg/mL),V1为提取液总体积(10 mL),V2为测定取用体积(0.1 mL),W为样品重(g)。
所有试验结果均设3次重复,取平均后对试验结果进行统计分析。
2 结果与分析
2.1 不同浓度PEG-6000处理对于种子萌发的影响
不同浓度PEG-6000处理对鹰嘴豆种子萌发的影响如图1所示,空白对照及PEG-6000浓度为5%和10%干旱胁迫处理的鹰嘴豆种萌发时滞为1 d,PEG-6000浓度为15%和20%干旱胁迫处理的种子萌发时滞为2 d,表明轻度干旱胁迫对鹰嘴豆种子的萌发时滞影响不大,而重度干旱胁迫会使种子的萌发时滞明显延长。不同浓度PEG-6000处理的鹰嘴豆种子,同一天内,随着PEG-6000浓度的升高,发芽率逐渐降低,其中对照种子的发芽率明显较高,并且发芽迅速整齐。较对照5%的轻度干旱胁迫对于鹰嘴豆种子发芽率的影响差异不大,两者的曲线趋势走向近乎相同,第1天发芽率较低,第2天种子吸水充足,发芽率明显提高,随着胁迫时间的延长,发芽率没有显著变化。PEG-6000浓度为10%的干旱胁迫对其发芽率的影响曲线与5%的相似,但发芽率在第3天以后近乎稳定,相较于对照和5%,时间上有所滞后。PEG-6000浓度为15%的鹰嘴豆种子在第1天种子发芽率近乎为零,3 d后发芽率呈现直线的增长,4 d后发芽率趋于稳定。20%的重度干旱对鹰嘴豆种子的发芽率影响较大,发芽第2天,其发芽率仍然只有3.33%,之后呈现缓慢的增长。
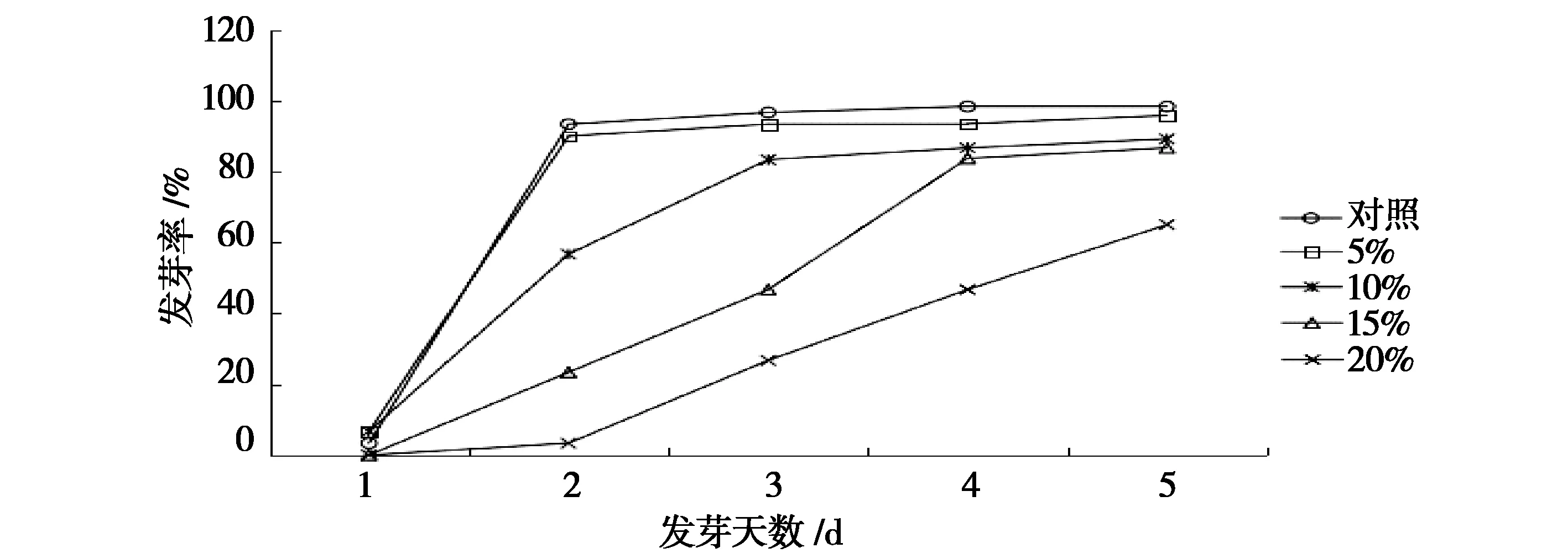
图1 不同浓度PEG-6000处理对种子发芽率的影响Fig.1 Effects of different concentrations of PEG-6000 treatment on the seed germination rate
不同浓度PEG-6000处理第5天对鹰嘴豆种子发芽的影响如表1所示,经过方差分析得到P=0.000 1<0.01。从发芽率来看,对照与PEG-6000浓度为5%干旱胁迫处理的鹰嘴豆种子发芽率无显著性差异,与10%胁迫处理的鹰嘴豆种子发芽率差异显著(P<0.05),与15%、20%重度干旱胁迫处理的鹰嘴豆种子发芽率存在极显著差异(P<0.01)。从发芽指数来看,对照与PEG-6000浓度为5%、10%胁迫下的鹰嘴豆种子发芽指数没有显著性差异,与15%、20%重度胁迫处理的发芽指数有极显著差异(P<0.01),说明重度干旱下,鹰嘴豆种子的发芽能力以及种子活力都受到了极显著抑制。从活力指数来看,各浓度处理间的种子活力指数都有显著性差异(P<0.05),其中对照和5%、5%和10%、10%和20%处理间的种子活力指数都有极显著差异(P<0.01)。综上可知,随着PEG-6000浓度的升高,发芽指数受到极显著抑制。

表1 不同浓度PEG-6000处理第5天对鹰嘴豆种子发芽的影响Tab.1 Effects of different concentrations of PEG-6000 treatment on the germination of Cicer arietinum L.seed on the 5th day
2.2 不同浓度PEG-6000处理及复水对芽苗生长的影响
不同浓度PEG-6000处理及复水对鹰嘴豆芽苗生长的影响如表2所示,在复水前干旱胁迫5 d时,不同浓度PEG-6000处理下,鹰嘴豆芽苗生长指标都不同程度的受到了抑制,其根长、芽长、鲜重相较于对照都下降了,其中PEG-6000浓度为10%、15%、20%干旱胁迫处理的芽苗生长受抑情况较为明显。不同浓度PEG-6000处理下的鹰嘴豆芽苗根长存在极显著差异(P=0.000 3<0.01),其中对照组芽苗的根长与5%处理相比无显著性差异,但却极显著的高于10%、15%、20%处理。不同浓度PEG-6000处理下的鹰嘴豆芽苗芽长存在极显著差异(P=0.000 1<0.01),对照和5%处理的芽苗芽长极显著地高于10%、15%和20%处理,10%处理的芽苗芽长又极显著地高于15%和20%处理,但浓度为15%和20%的处理间,芽苗芽长没有显著差异。不同浓度PEG-6000处理下的鹰嘴豆芽苗鲜重存在极显著差异(P=0.000 1<0.01),对照的芽苗鲜重显著高于10%、15%、20%处理,5%浓度处理又极显著高于20%处理。

表2 不同浓度PEG-6000处理及复水对鹰嘴豆芽苗生长的影响Tab.2 Effects of different concentrations of PEG-6000 treatment and rehydration on thegrowth of Cicer arietinum L.sprout
在复水5 d后,各处理下的鹰嘴豆芽苗生长指标都有了恢复性增长。其中5%处理经过复水,鹰嘴豆芽苗生长状态相对较好。复水5 d后的根长,经过方差分析得到P=0.017 2<0.05,对照与5%、10%、15%处理的根长无显著性差异,与20%处理有显著性差异。复水5 d后的芽长,方差分析得到P=0.004 4<0.01,对照与浓度为5%处理存在极显著性差异,与10%、20%处理的鹰嘴豆芽长之间均无显著性差异,与15%的处理间存在显著差异。复水5 d后的鹰嘴豆芽苗鲜重,方差分析得到P=0.013 2<0.05,5%处理的鹰嘴豆芽苗与10%胁迫处理有显著差异,与15%、20%胁迫下的鹰嘴豆鲜重有极显著差异。
2.3 不同浓度PEG-6000干旱胁迫及复水对鹰嘴豆芽苗生理指标的影响
2.3.1 干旱胁迫对鹰嘴豆芽苗生理指标的影响
在干旱胁迫第5 天时,不同浓度PEG-6000处理对鹰嘴豆芽苗各项生理指标的影响(表3)。由表可知,不同浓度PEG-6000处理鹰嘴豆种子之后,随着干旱胁迫程度的增加,脯氨酸含量逐渐增加,经方差分析得到P=0.000 1<0.01。对照与各处理间均存在显著或极显著性差异,20%处理的鹰嘴豆芽苗中脯氨酸含量极显著地高于其他处理,但浓度为5%处理和10%处理间没有显著差异。

表3 不同浓度PEG-6000处理对鹰嘴豆芽苗各项生理指标的影响Tab.3 Effects of different concentrations of PEG-6000 treatment on the physiologicalindexes of Cicer arietinum L.sprout
丙二醛含量随着PEG-6000浓度的增加逐渐增加,经方差分析得到P=0.002 6<0.01,可见各处理间的丙二醛含量存在极显著差异,其中对照与各个处理间均有显著或极显著差异,20%处理的丙二醛含量极显著地高于5%处理和对照,而浓度为5%处理和10%处理间没有显著差异。
可溶性糖含量随着PEG-6000浓度的升高而逐渐增加,经方差分析得到P=0.000 8<0.01,20%处理下的可溶性糖含量极显著高于其他处理,对照与15%处理有显著差异,5%和10%轻度干旱胁迫间没有显著差异。
蛋白质含量测定中,随着PEG-6000浓度的增加鹰嘴豆芽苗中蛋白质含量无明显变化,对照与各个处理间差异较小,经方差分析后得到P=0.561 7>0.05,可见各处理间均无显著差异。
2.3.2 干旱胁迫后复水对鹰嘴豆芽苗生理指标的影响
不同浓度PEG-6000处理后进行复水试验,不同浓度PEG-6000干旱胁迫后复水时间对鹰嘴豆芽苗脯氨酸含量的多重比较如表4所示,不同浓度PEG-6000处理后的鹰嘴豆芽苗经过复水1 d后,其脯氨酸含量随着胁迫程度的增加呈升高趋势,对照与10%、15%、20%处理均有极显著差异(P<0.01),但与5%处理无显著性差异(P>0.05)。复水3 d后,20%处理与其他处理下的脯氨酸含量均有极显著差异(P<0.01)。复水5 d后,随着复水时间的延长,脯氨酸含量逐渐降低,各处理间脯氨酸含量差异减小。浓度为20%处理与对照、5%、10%处理的脯氨酸含量有极显著差异(P<0.01),与15%处理无显著性差异(P>0.05)。

表4 不同浓度PEG-6000干旱胁迫后复水时间对鹰嘴豆芽苗脯氨酸含量的多重比较Tab.4 Multiple comparison of proline content in Cicer arietinum L.sprout with different concentrations of PEG-6000 and rehydration time
不同浓度 PEG-6000胁迫后复水不同时间对鹰嘴豆芽苗丙二醛、可溶性糖和蛋白质含量的影响如表5所示。同一复水时间不同浓度处理的鹰嘴豆芽苗的丙二醛含量、可溶性糖含量、蛋白质含量,经方差分析得到P=0.063>0.05;P=0.849 9>0.05;P=0.692>0.05,即不同处理浓度间没有显著性差异。相同浓度处理不同复水天数,方差分析结果显示P=0.165 4>0.05;P=0.096 5>0.05;P=0.088 3>0.05,即不同复水天数间丙二醛含量、可溶性糖含量、蛋白质含量无显著性差异。随着复水天数的增加,丙二醛含量、可溶性糖含量逐渐恢复平稳,蛋白质含量随着复水天数的增加,没有明显变化。
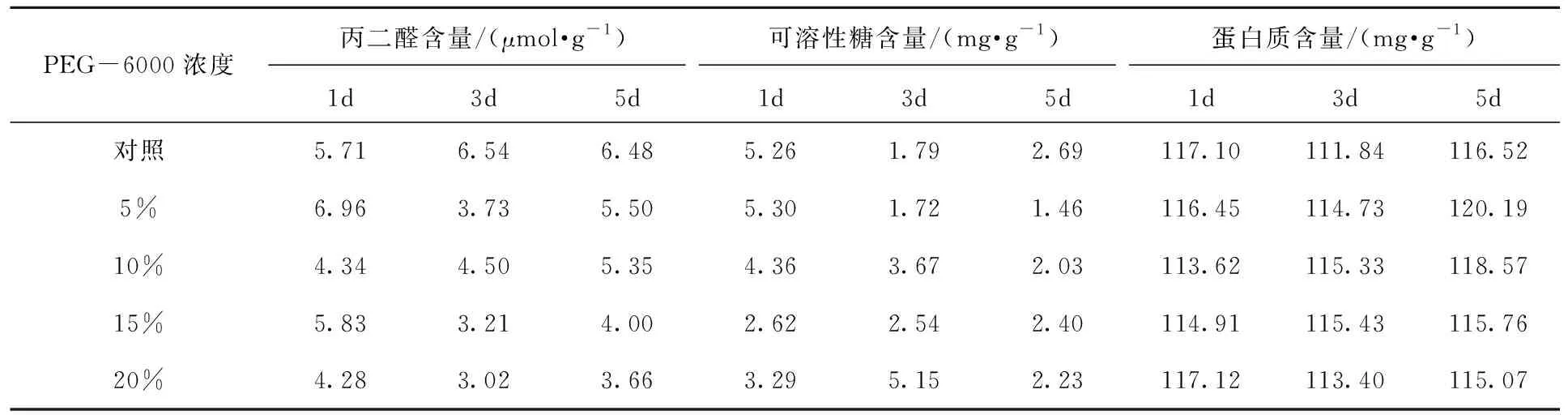
表5 不同浓度 PEG-6000胁迫后复水不同时间鹰嘴豆芽苗丙二醛、可溶性糖和蛋白质含量Tab.5 Malondialdehyde,soluble sugar and protein content of Cicer arietinum L.sprout with different concentrations of PEG-6000 stress and rehydration at different times
2.3.3 复水前后鹰嘴豆芽苗生理指标的比较
PEG-6000处理后复水前后鹰嘴豆生理指标比较如图2所示。脯氨酸含量变化如图2a,在不同浓度PEG-6000胁迫下,浓度越高,脯氨酸含量升高的越明显,表明干旱胁迫使鹰嘴豆种子内脯氨酸含量显著增加;复水后,对于不同浓度的处理,脯氨酸含量会随着复水天数的增加明显下降,之后趋于平稳;对照的脯氨酸含量变化相对较平稳,变幅较小;由于PEG-6000浓度为20%干旱胁迫严重,复水后脯氨酸的下降速率会相对较缓。丙二醛含量变化如图2b,复水前,随着PEG-6000浓度的增加,丙二醛的含量逐渐增加,复水1 d后,10%、15%、20%处理下丙二醛的含量明显下降,并在继续复水后的几天仍有下降趋势。其中,重度干旱胁迫下,鹰嘴豆的丙二醛(MDA)含量下降明显。可溶性糖含量变化如图2c,干旱胁迫处理后,鹰嘴豆中的可溶性糖含量和胁迫前相比呈明显的上升趋势,但在复水1 d后迅速回降。可溶性糖可认为是植物遭受逆境伤害后重要的渗透调节物质之一。蛋白质含量变化如图2d,不同PEG-6000浓度处理后的鹰嘴豆种子在复水前后,蛋白质没有明显的波动变化规律性。
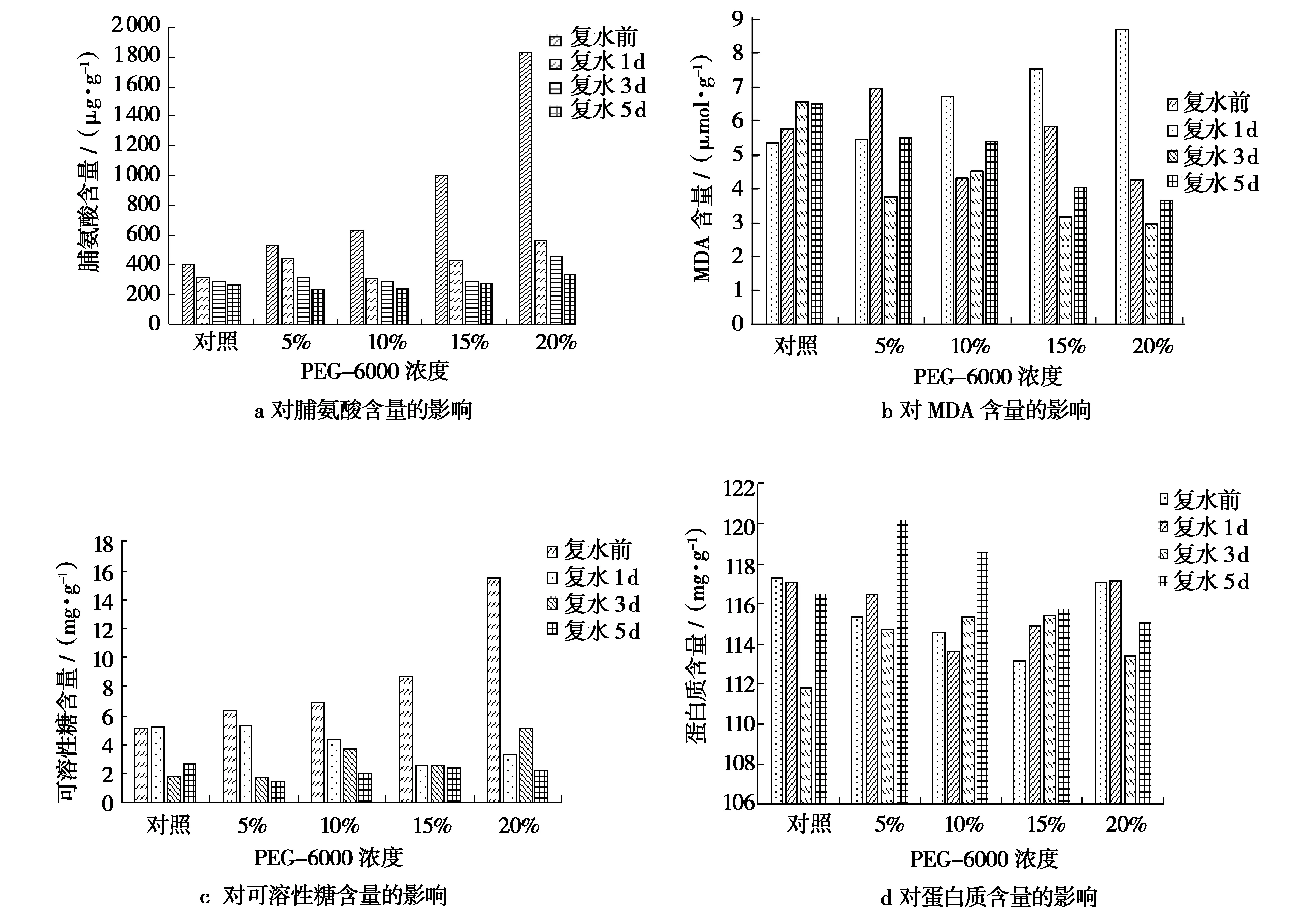
图2 不同浓度PEG-6000处理复水前后鹰嘴豆生理指标比较Fig.2 Comparison of physiological indexes of Cicer arietinum L.before and after the rehydration with different concentrations of PEG-6000 treatment
3 讨论与结论
干旱作为影响植物生长的重要非生物因子之一,常会引起植物的内源物质响应,如膜透性、糖含量的变化,并且不同植物对于干旱的抵抗能力以及自身的补偿效应等都有所差异。本研究通过对鹰嘴豆种子萌发时抵制和忍耐渗透胁迫的生理生态机制研究结果表明,5%的轻度干旱胁迫对于鹰嘴豆的萌发时滞、发芽率近乎无影响,而15%、20%重度干旱胁迫下,鹰嘴豆种子的发芽期明显滞后,发芽率、发芽指数、活力指数等都明显降低,根长、芽长、鲜重等生长指标明显受抑,严重影响种子的活力、萌发幼苗的健壮程度。随着胁迫程度的增加,脯氨酸、丙二醛和可溶性糖的含量均逐渐增加,20%的高浓度处理极显著地高于低浓度处理。但是随着胁迫程度的增加,鹰嘴豆芽苗中蛋白质的含量值基本保持恒定。
复水后不同PEG-6000处理的鹰嘴豆芽苗生长指标都有了恢复,芽长、鲜重根长曲线都恢复的较为平缓,其中浓度为5%的轻度干旱胁迫经过复水,鹰嘴豆芽苗生长状态较为突出。复水后脯氨酸、丙二醛和可溶性糖含量较复水前大幅度下降,但丙二醛和可溶性糖含量各处理间及不同复水时间之间均无显著差异。脯氨酸不同处理浓度间及复水不同时间均存在显著差异。
鹰嘴豆具有极强的耐旱能力,不需施肥和特殊管理,是干旱半干旱地区理想的蛋白质来源[12]。本试验结果显示,鹰嘴豆芽苗中蛋白质含量明显较高,干旱胁迫对于鹰嘴豆蛋白质含量没有太大影响。而徐银萍等[14]研究表明胁迫时间越长,大麦籽粒中蛋白质的含量会显著增加,这可能是因为鹰嘴豆的抗旱性比较强,PEG-6000浓度为20%的干旱胁迫下,并不会造成鹰嘴豆芽苗中蛋白质含量的显著增加。或者由于鹰嘴豆种子萌发,种子中可溶性蛋白质含量随着种子的萌发被消耗,同时干旱胁迫蛋白质含量又会相应增加,从而造成蛋白质含量变化没有较大规律性。但是具体原因还有待通过进一步研究来确定。
干旱胁迫后对其复水能够使植物的各项生理功能逐渐得到恢复,可以在一定程度或范围内弥补干旱胁迫对于植物所造成的伤害[13]。复水后的植株会产生相应的补偿修复机制,使植物细胞内含物质的合成、分解代谢的比例等发生变化,合成的酶的活性得到提高,各值均可以恢复到或者接近对照处理水平,使细胞内物质代谢逐渐趋于正常水平。本研究结果显示,芽苗中可溶性糖含量、脯氨酸、丙二醛等生理指标随着复水时间的延长逐渐向对照水平恢复。本研究明晰了鹰嘴豆种子萌发和芽苗生长时抵制和耐渗透肋迫的生理生态机制,为鹰嘴豆的抗性研究、灌溉栽培等提供研究基础,同时为其在干旱地区育种、引种等提供理论依据。

