雪豹源水貂肠炎病毒分子鉴定及NS1基因进化分析
简莹娜,张学勇,李秀萍,赵海龙,王光华,王戈平,马利青*
(1.青海大学畜牧兽医科学院,青海 西宁 810016; 2.青海省西宁市野生动物园,青海 西宁 810001)
水貂病毒性肠炎是由水貂肠炎病毒(Mink Enteritis Virus,MEV)感染引起的急性、烈性、高度接触性传染病,具有高发病率和高死亡率的特点[1]。其病原MEV是细小病毒科(Parvoviridae)细小病毒属(Parvovirus)的无囊膜单股负链DNA病毒,基因组全长约5 kb,基因组包括2个开放阅读框,其中一个编码调控病毒复制的非结构蛋白NS1和NS2,另一个编码组成衣壳结构蛋白VP1和VP2[2-3]。非结构蛋白NS1在MEV的复制和转录过程中发挥作用,NS2在MEV的DNA扩增调控和结构蛋白的转录和组装中发挥作用[2];结构蛋白VP1在MEV的复制和组装过程中起重要作用,VP2是MEV主要的衣壳蛋白,诱导感染动物产生MEV的特异性中和抗体,同时在致病性和遗传进化方面发挥重要作用[3-5]。1949年Schofield[6]在加拿大报道了水貂病毒性肠炎的暴发,1952年Wills[7]成功分离到了该病的病原MEV,之后水貂病毒性肠炎相继在美国,丹麦、挪威、芬兰、瑞典、英国、中国和日本等国发生[2,3,8]。目前,水貂病毒性肠炎已成为危害我国养貂业的重要疫病之一,在我国的辽宁省(大连)、山东省(潍坊、威海、烟台、青岛)、吉林省、河北省都有病原的鉴定分析[2],我国学者在水貂感染MEV方面做了大量研究[8-10],但对雪豹感染MEV的检测鉴定分析尚无报道。
根据雪豹临床症状、疾病的发生发展规律、治疗用抗生素无效等特征,本研究对雪豹源疑似感染MEV的雪豹粪便样本进行特异性诊断、鉴定,并对MEV的NS1基因进行测序分析,为雪豹源MEV的生物学特性、疫苗防控等提供科学依据。
1 材料与方法
1.1 病料采集
两份雪豹腹泻粪便样本取自青海省西宁市野生动物园,置于采样箱中送至实验室进行检测分析。
1.2 主要试剂与仪器
主要试剂:2×TransStart FastPfu Fly PCR SuperMix、Trans 2K DNA Marker购自北京全式金生物技术有限公司;大肠杆菌DH5α感受态细胞和pMD18-T载体购自宝生物工程(大连)有限公司;TIANamp Virus DNA/RNA Kit、琼脂糖凝胶DNA回收试剂盒、质粒小提试剂盒均购自天根生化科技(北京)有限公司;引物合成及阳性质粒测序均由苏州金唯智生物科技有限公司完成,其他均为国产常规试剂。
主要仪器:PCR仪、电泳仪、凝胶成像分析系统、离心机、微量移液器等。
1.3 病毒基因组的提取
取1 g左右新鲜粪便加入0.5 mL灭菌PBS溶液中,反复冻融2次,12 000 g/min离心10 min,取上清液进行病毒基因组提取,提取过程按照TIANamp Virus DNA/RNA Kit说明书进行。
1.4 PCR分子鉴定
依据参考文献[9]中的引物对MEV进行PCR分子生物学鉴定(表1)。扩增反应体系:Premix Taq 25.0 μL,上、下游引物(浓度10 μmol/L)各2.0 μL,模板DNA 3.0 μL,补充水18.0 μL 至PCR反应体系为50.0 μL。反应条件:94 ℃预变性5 min,94 ℃变性30 s、 55 ℃退火40 s(短片段)和56 ℃退火40 s(长片段)、72 ℃延伸20 s(短片段)和2 min(长片段),各35个循环,最后72 ℃延伸10 min。扩增后将PCR产物在1.2%的琼脂糖凝胶中进行电泳检测(电压为恒压120 V, 时间为35 min),检测完成后在凝胶成像分析系统中观察结果并拍照。

表1 MEV分子鉴定所用引物Tab.1 Primers used for molecular identification of MEV
将长片段PCR阳性产物凝胶回收后按照连接试剂盒说明连接到pMD18-T载体上,转化至DH5α感受态细胞中培养,然后挑取平板上单克隆菌落于液体培养基中,再经PCR鉴定后将阳性质粒送测序公司进行测序。
1.5 基因序列分析
PCR阳性质粒(长片段)测序委托苏州金唯智生物科技有限公司采用Sanger双脱氧链终止法进行双向测序。测序结果经峰图分析后,在GenBank上采用BLAST(https://blast.ncbi.nlm.nih.gov/Blast.cgi)方法进行同源序列搜索,应用MEGA 5.0软件和Clustal Omega (https://www.ebi.ac.uk/Tools/msa/clustalo/)在线软件进行核苷酸序列和氨基酸序列同源性的分析。
1.6 系统发育进化分析
通过NCBI提供的BLAST在线搜索服务软件获取其他MEV的NS1基因序列。使用MEGA 5.0软件的系统发育树构建功能对这些基因序列进行分析,选择邻近法(Neighbor-Joining method)构建系统发育树,并使用自展值(bootstrap)检验其可靠性,重复次数为2 000,分析不同分离株病毒间的进化关系。
2 结果与分析
2.1 PCR分子鉴定
利用病毒基因组DNA/RNA提取试剂盒提取DNA后,对基于NS1基因短片段引物进行PCR扩增鉴定,扩增出约200 bp的目的片段(图1a);对基于NS1基因长片段引物进行PCR扩增鉴定,扩增出约2 000 bp的目的片段(图1b)。基因扩增片段大小与预期相符。
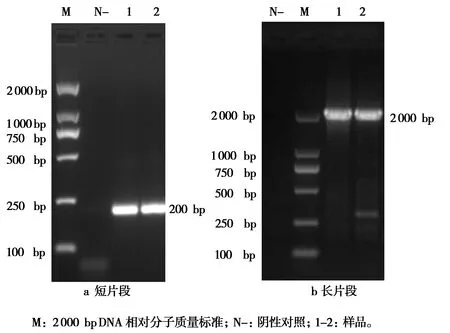
图1 NS1基因两个片段PCR扩增结果Fig.1 PCR amplification of two segments of NS1 gene
2.2NS1基因长片段PCR鉴定结果
对NS1基因长片段PCR阳性产物进行凝胶回收、连接、转化,再经菌液PCR鉴定后将阳性质粒送测序公司测序,鉴定结果如图2所示。
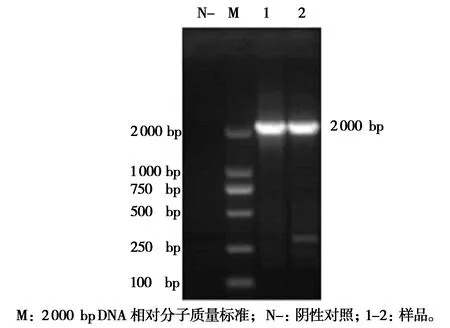
图2 质粒pMD18-T-NS1基因(长片段)PCR鉴定结果Fig.2 PCR identification of plasmid pMD18-T-NS1 geme(long fragment)
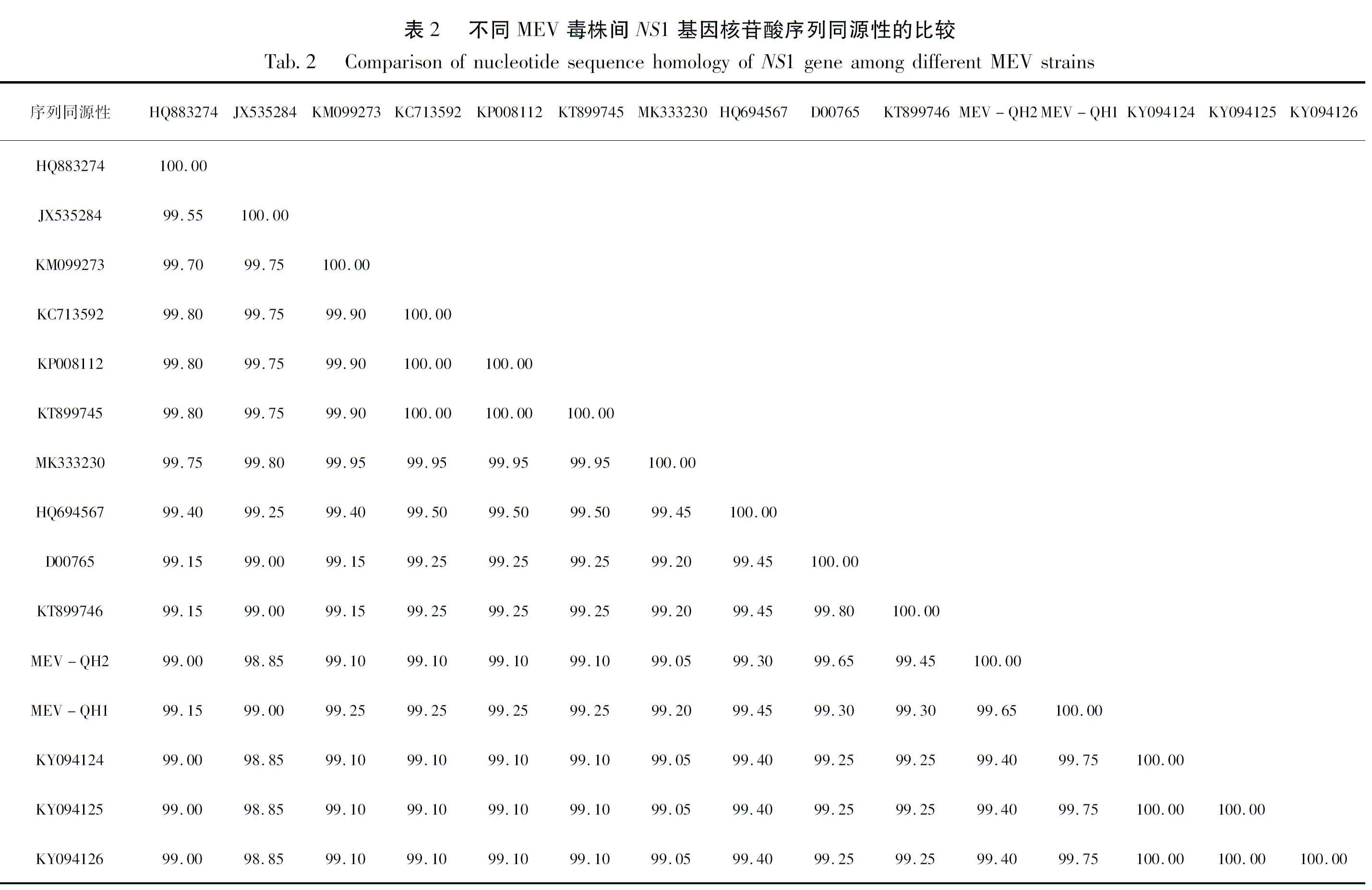
2.3 核苷酸序列同源性比较分析
由表2可知,将NS1基因长片段测序结果进行在线BLAST序列比对,MEV-QH1与Genebank 中水貂肠炎病毒(登录号:JX535284、KY094124)核苷酸序列高度同源(99.00%~99.75%),MEV-QH2与Genebank 中水貂肠炎病毒(登录号:JX535284、D00765)核苷酸序列高度同源(98.85%~99.65%),由此表明检测到的病毒为MEV。
2.4 氨基酸序列同源性比较分析
本研究克隆NS1基因长为2 007 bp,编码668个氨基酸,与不同病毒株间氨基酸序列同源性为98.80%~100.00%(表3);由表4 可知,对本研究克隆的毒株与其他株间NS1氨基酸非同义位点进行比较发现19个氨基酸位点存在变异,但不存在特异性变异位点(不存在与现有氨基酸序列完全不同的氨基酸位点,即突变位点在现有序列中均存在),而MEV-QH1与MEV-QH2在350位(D(Asp)-N(Asn))、574位(I(Ile)-V(Val))和595位(Q(Gln)-H(His))存在3个变异位点。
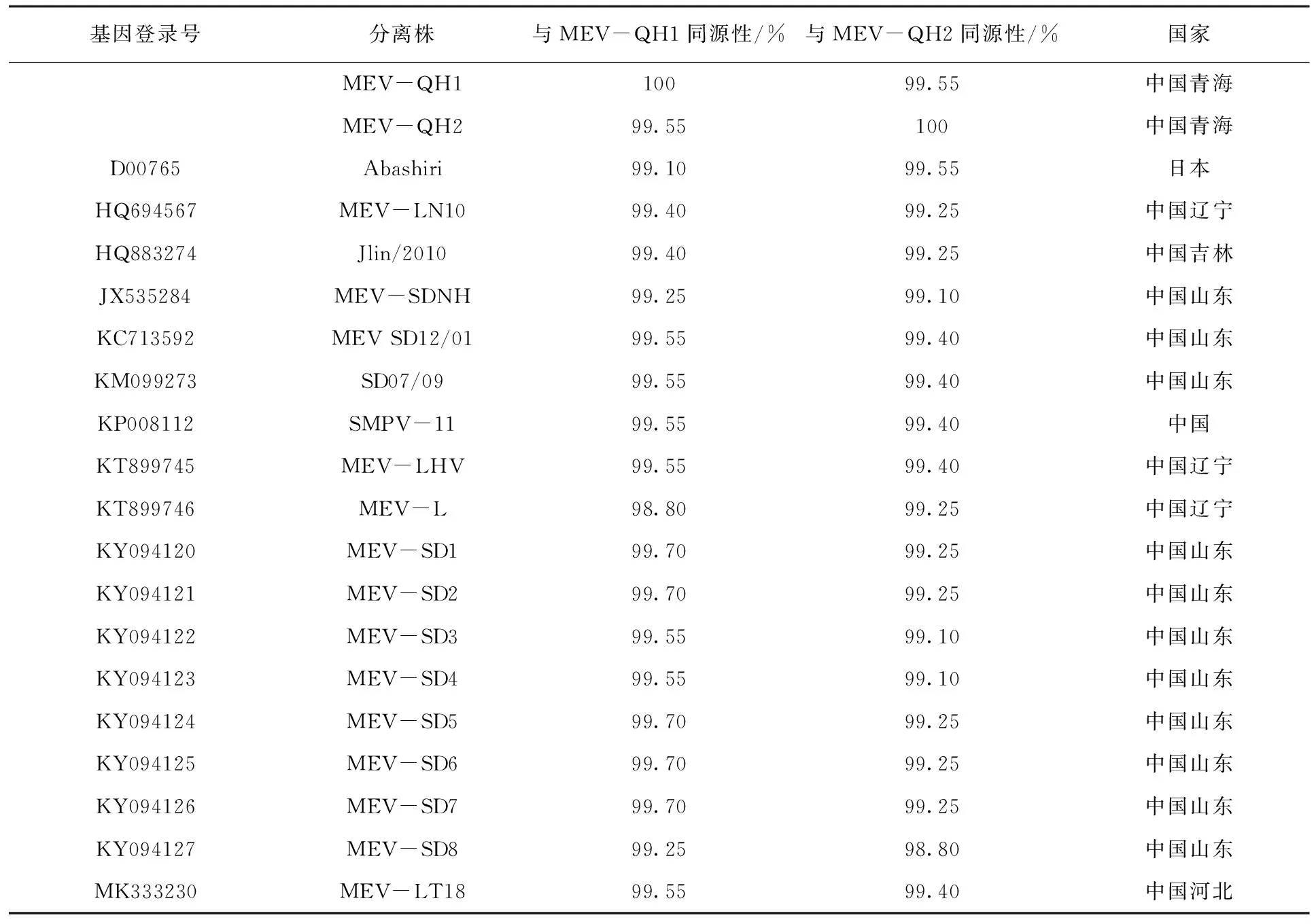
表3 不同毒株间NS1氨基酸序列同源性的比较Tab.3 Comparison of amino acid sequence homology of NS1 among different strains
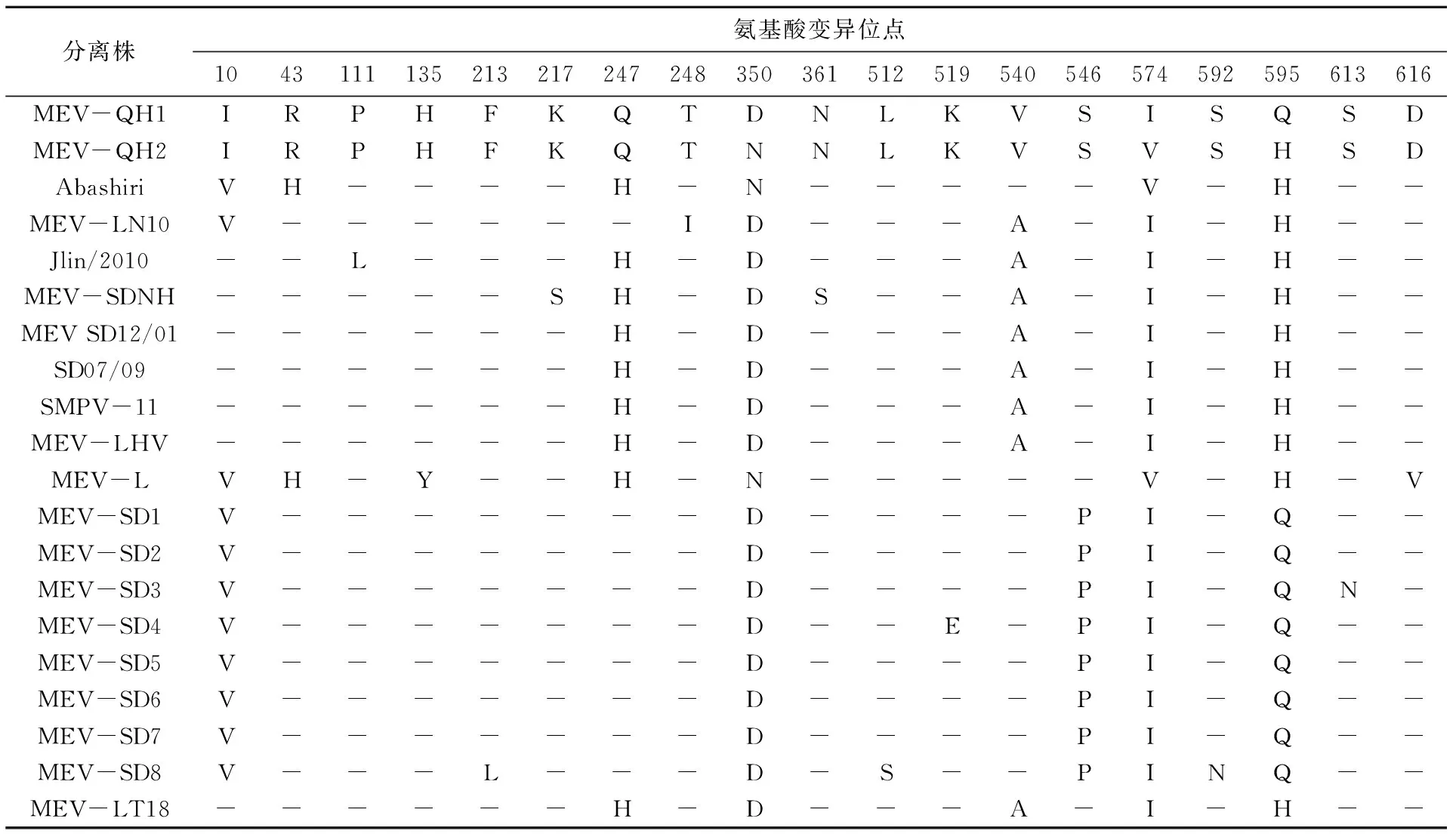
表4 不同毒株间NS1氨基酸非同义位点的比较Tab.4 Comparison of non synonymous amino acid sites of NS1
2.5 系统进化分析
运用MEGA 5.0软件,基于NS1基因构建系统发育树。由图3可知,MEV-QH1和MEV-QH2聚在一个大的分支上,但并未聚在一个微小分支上;分离株MEV-QH1与中国山东分离株聚在一个微小分支上,分离株MEV-QH2与日本Abashiri株及中国L株聚在微小分支上。

图3 基于NS1基因以邻近法所构建的系统发育树Fig.3 Phylogenetic tree based on NS1 gene by neighbour-joining method
3 讨论与结论
本研究对雪豹源MEV-QH1/2进行了分子鉴定,即对NS1基因进行了克隆和序列测定,并比对分析了核苷酸和氨基酸序列的同源性。本次克隆的NS1基因序列2 007 bp,MEV-QH1/2与Genebank 中水貂肠炎病毒(登录号:JX535284、KY094124、D00765)核苷酸序列高度同源(98.85%~99.75%),编码668个氨基酸,与不同病毒株间氨基酸序列同源性为98.80%~100.00%。据张海玲等[2]研究报道,MEV的NS1蛋白中有一个从389位氨基酸开始的长为150个氨基酸的保守区域,包含细小病毒的391-394GKRN高保守序列,其在细小病毒中的氨基酸保守性远远高于其他位点区域,由于此区域中具有解旋活性并与ATPase或GTPase相关的ATP或GTP结合位点,因此该保守区域为病毒DNA复制所必需的。本研究中所克隆的NS1基因序列推导的氨基酸序列391-394保守序列未发生变异,同时在389-539位中的150个氨基酸序列,即细小病毒的高保守序列中MEV-QH1株和MEV-QH2株序列相同,未发生变异,但MEV-QH1株与MEV-SD8株512位处存在L(Leu)到S(Ser)的突变,MEV-QH2株与MEV-SD4株519位处存在K(Lys)到E(Glu)的突变,这两处的突变是否对NS1蛋白功能产生影响有待于进一步的研究。
基于NS1基因构建的MEV系统进化树显示,雪豹源MEV-QH1/2两株并不聚在一个微小分支上,这两株病毒间有3个氨基酸位点的突变,存在一定的株间遗传变异,但MEV-QH1/2分离株并未与其他分离株形成微小分支,这可能与青藏高原地理环境或宿主相关,应对雪豹源动物不同个体分离株之间的差异进行分析,后续需采集更多的样品进行研究。
目前,水貂病毒性肠炎尚无特异性治疗方法,进行免疫接种是降低发病率和死亡率的有效手段。卢悦[11]研究报道, MEV变异株的发现和流行,导致水貂病毒性肠炎的防控依旧面临严峻考验。因此,动物居住的屋舍一点要定期打扫通风,用烧碱(氢氧化钠)、福尔马林、过氧乙酸等进行消毒,从而有效减少疾病的传播[12]。

