马基诺矿的氧化过程及在有机污染物治理中研究进展*
陈 晨 陈金毅,2,3 王小凤,2,33
(1.武汉工程大学化学与环境工程学院;2.绿色化工过程教育部重点实验室;3.湖北省环境工程化学工程污染控制技术研究中心)
由于工业生产中废水的不规范处理和排放,会造成高毒性有机污染物持续释放到环境[1-4],这些有机污染物即使在含量较低的情况下也会显示出对生物的致癌性和致突变性[5]。马基诺矿(FeS)在自然界中储量丰富[6],是一种强还原性材料。目前,马基诺矿通过电子传递和还原作用,对环境中的有毒有机物(例如卤代有机物)表现出降解作用[7-10]。另外,Fe和S元素也使马基诺矿在高级氧化技术中具有很好的催化性能。
本文通过介绍FeS的结构、性质以及氧化过程,反映FeS对自然环境中有机污染物的降解机理,以及对芬顿(Fenton)高级氧化技术和过硫酸盐高级氧化技术(SR-AOPs)的催化机理,为研究FeS降解有机污染物提供依据。
1 马基诺矿的结构与性质
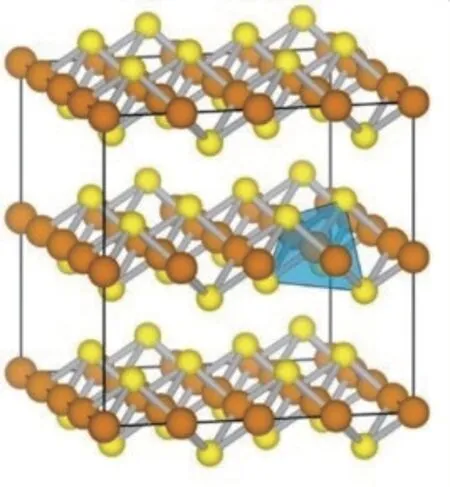
马基诺矿是一种四方体层状结构,其中Fe原子配位连接4个等距的硫原子组成四面体[11],四面体共用体边形成层状结构,层与层间晶体沿c轴堆叠,并通过弱的范德华力连接在一起[12],如图1所示(深色代表Fe原子,浅色代表S原子)[13]。表面的S位点能很好地吸附有机污染物,Fe—Fe键具有高电子传递能力,可促进电子从铁原子传导到有机物实现还原降解。Morse等[14]提出FeS是一种具有膨胀晶格的矿物,在四面体间插入水分子,也可以插入阳离子等,为氧化还原反应提供更多的反应活性位点。此外,结构中的二价铁(Fe(Ⅱ))和负二价硫(S(-Ⅱ))以及溶出的Fe2+和S2-使FeS具有较强的还原性[6]。
2 马基诺矿的氧化过程
FeS中Fe的转化过程分为3个途径[15]:①结构中的铁被氧化生成Fe2+(式(1));②Fe2+又会氧化生成Fe3+;③Fe3+也会与FeS反应生成Fe2(+式(2)),形成铁循环。

FeS氧化后的S并未完全氧化为SO42-,也会产生多硫化物(Sn2-)或零价硫(S0),形成富硫层抑制FeS的继续氧化[16-17]。
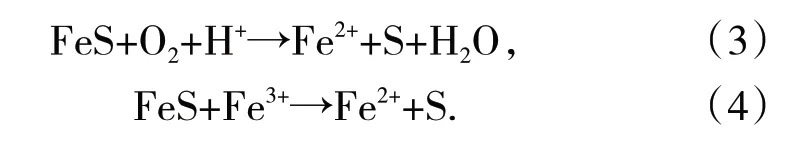
在FeS的氧化过程中,Fe2+会优先溶出,S逐渐富集形成多硫化物(Sn2-)或零价硫(S0)[18]。Pratt等[18]认为,FeS中的S在最初的15 min内迅速溶解为SO42-,然后SO42-浓度保持恒定。随后的FeS氧化主要是由S2-氧化成Sn2-和S0,而不是生成SO42-。Janzen等[19]认为,在酸性条件下FeS中的S仅部分转化为SO42-,颗粒表面的富硫层可能是不完全氧化的结果。
FeS氧化过程中水和氧气中的O原子可能会转化为活性自由基。FeS吸附水分子过程中,Fe位点与氧原子结合,导致H—O键活化能降低,H—O键断裂生成O2·-[20]。Fe(Ⅱ)还能直接还原O2生成·OH;O2被还原也可能产生O2·-或H2O2,然后进一步生成·OH[21]。此外,FeS氧化过程中能产生H2S和HS-,也能与·OH反应生成HS·,经过O2和Fe(Ⅲ)的氧化作用可能产生亚砜基自由基[22]。
3 马基诺矿在有机污染物处理中的应用
3.1 马基诺矿直接降解有机污染物
FeS通过3种途径直接降解有机污染物:①吸附作用;②厌氧条件下通过自身的电子转移和亲核反应降解有机物;③好氧条件下产生活性氧,例如H2O2、O·2-、·OH等,对有机污染物进行去除。
Butler等[10]提出厌氧条件下,FeS能通过还原脱氢作用去除六氯乙烷(HCA),反应在矿物表面进行。HCA反应途径分为2个过程:①由Fe(Ⅱ)络合物的电子转移过程发生氢解反应,HCA经过单电子转移生成五氯乙烷自由基,自由基继续得电子使C-Cl键断裂,生成PCE;②FeS作为亲核试剂,发生消除反应,除去HCA中的Cl-生成四氯乙烯(PCE)。在FeS存在的情况下,2种反应协同发生,最终生成三氯乙烯(TCE)、二氯乙烯(cis-DCE)和乙炔。也有研究指出,FeS也能发生氢解反应,使三氯乙烷(1,1,1-TCA)转化为二氯乙烷(1,1-DCA)[23]。
厌氧条件下FeS使TCE转化也有2个途径[12]:主要途径是β-消除反应,失去2个邻位氯原子,生成1个额外的C—C键,使TCE还原成乙炔;次要途径是TCE通过电子转移发生氢解反应,经连续取代反应生成cis-DCE、氯乙烯(CV)和乙烯。李群等[24-25]也研究了FeS对TCE的降解机理,认为初始阶段,由于FeS比表面积大,自身具有疏水性特点,能吸附TCE,再经过还原消除反应和去氯加氢反应降解TCE。此外,表面活化剂能减弱FeS团聚作用,促进了FeS的脱氯作用。
溴代有机物也表现出类似于脱氯反应的脱溴反应。Li等[26]发现,在厌氧条件下,FeS对阻燃剂六溴环十二烷(HBCD)也能表现出较好的脱溴反应。反应过程中,FeS表面Fe(Ⅱ)和S(-Ⅱ)的氧化过程促进了脱溴反应的发生。
Cheng等[27]指出,在好氧条件下,FeS能通过还原氧气产生HO·降解苯酚。120 min内,1 g/L的FeS能降解35%的苯酚;随着FeS逐渐被氧化,表面的Fe(Ⅱ)和S(-Ⅱ)增加,HO·的含量逐渐增加,苯酚降解率升高。持续投加低剂量的FeS是提高苯酚去除率的有效方法。低剂量的FeS减少了瞬时FeS的浓度,避免了FeS与苯酚竞争HO·。
此外,FeS也能作为一种环境功能材料与其他材料形成复合材料,提高其他材料的还原性[28]和渗透性[29]。Kim等[30]利用FeS包覆在铁纳米颗粒(nFe)上,形成铁/硫化铁核壳纳米粒子。FeS的疏水性能吸附TCE,促进nFe和FeS对TCE的还原。Demiya等[31]研究发现,ZVI复合FeS比单独的ZVI或FeS降解TCE效果更好。TCE在FeS的反应位点上发生脱氯反应,ZVI传递电子给FeS,提高了TCE的反应效率。此外,也有研究使用纤维素[32]、壳聚糖[33]、氧化铝[34]等物质对FeS改性,增强对重金属的吸附能力,但并未对有机物去除方面进行讨论。
3.2 马基诺矿在高级氧化工艺中的应用
3.2.1 芬顿高级氧化技术
FeS的结构和化学性质使它能与H2O2发生Fenton反应[35]。FeS表面存在的Fe(Ⅱ)·H2O会和H2O2发生反应形成Fe(Ⅱ)·H2O2络合物,在络合物中会发生电子转移,产生HO·。表面的Fe(Ⅲ)以及溶解的Fe3+可通过H2O2还原为Fe(Ⅱ)和Fe2+(式(5)~式(8))。另外,反应过程中产生的H+能维持酸性条件,减少铁泥的产生。

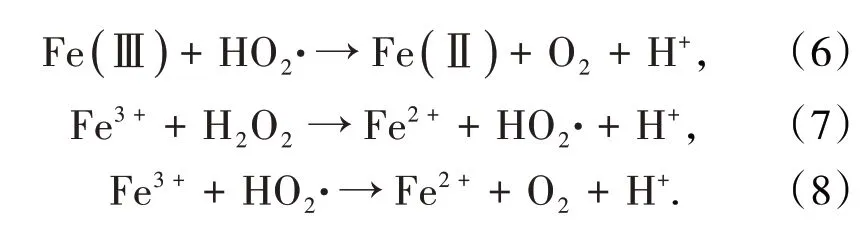
FeS/Fenton工艺氧化性强,成本低廉,适用于去除有机污染物。丁耀彬等[36]的研究表明,天然矿物FeS能活化H2O2产生HO·,15 min内基本能完全降解罗丹明B染料废水。Chen等[35]研究了FeS/Fenton工艺对2,4-二氯苯氧基乙酸(2,4-D)的降解,片状结构的FeS能为污染物和自由基的附着和反应提供更多的位置;FeS/Fenton工艺生成的HO·通过与2,4-D的C—O键反应,生成乙醇酸和二氯酚,二氯酚中羟基对位的氯被取代为羟基,经过连续的羟基化和脱氯反应,最终生成乙酸、甲酸和草酸。
通过改性FeS能提高材料的反应活性。例如碳掺杂在FeS材料中,C原子取代了FeS中的S原子,减小了H+脱附需要的活化能[37]。Ma等[38]通过使用碳纳米管合成了一种碳基催化剂(CNTs/FeS),对环丙沙星(CIP)有较好的去除效果,该材料具有较好的重复性。最佳条件下对环丙沙星有较好的去除效果(91.3%),经过4次重复依旧对环丙沙星(CIP)有较高的催化效果(大于75%)。催化剂无需纯化即可充分利用碳纳米管中的铁纳米颗粒,促进H2O2生成HO·,碳纳米管能增加FeS的稳定性,将Fe(Ⅲ)还原为Fe(Ⅱ),增加HO·的生成效率。另外,碳纳米管也能吸附抗生素,促进HO·的氧化降解效率。
3.2.2 硫酸盐自由基高级氧化技术
过渡金属活化过硫酸盐(PS)产生的硫酸盐自由基以它高活性、强氧化性的特点,被运用在有机污染物的去除过程中。FeS活化PS工艺中,PS首先与表面的Fe(Ⅱ)或游离Fe2+反应生成SO4·-(如式(9)、式(10)),SO4·-也能与水或OH-反应生成HO·或H2O2(如式(11)、式(12)),产出的H2O2能与游离Fe2+或Fe(Ⅱ)引发芬顿效应,促进HO·的产生(如式(13))。矿物中的S(-Ⅱ)都能促进Fe(Ⅱ)的再生[39-40]。活化过程中也会生成H+,即使初始pH值为中性,也能使溶液的pH值转化为更有利于生成Fe(Ⅱ)的酸性条件,提高活化效率。
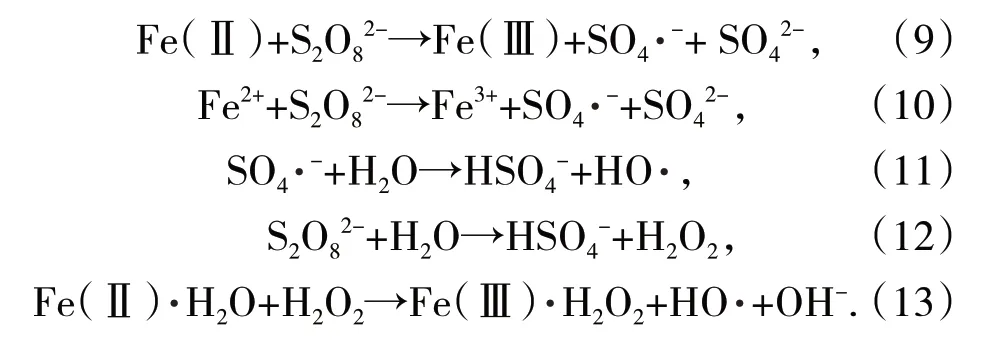
FeS的晶体结构也能促进PS分解。研究提出,FeS中的Fe原子之间的键距远大于PS中的O-O键距[41]。PS上的O原子与Fe上的3d空轨道相连,形成Fe—O,降低了PS在分解时的活化能。此外,FeS层状结构上的Fe(Ⅱ)会与水中的氧形成羟基氧化亚铁(如Fe(OH)2、Fe(OH)+)[41]。羟基氧化亚铁更容易还原氧气生成O2·-[40]。O2·-能促进过硫酸盐分解,生成硫酸根自由基(如式(14)、式(15))。通过适当升高温度、减小粒径的方式能进一步提高反应效率。
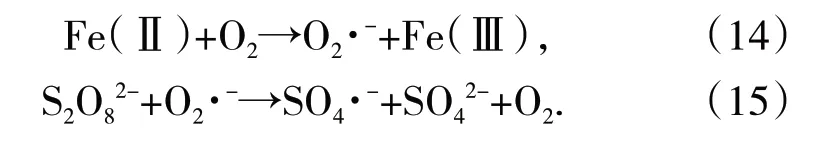
FeS活化PS产生的HO·和SO4·-能联合去除含氯有机污染物,其中主要为HO·发生取代反应,脱去有机物中的氯原子[42]。脱氯反应在有机物降解过程中优先发生,例如HO·和SO4·-能使2,4-二氯苯酚先发生脱氯反应,生成芳香烃中间产物[42];对氯苯胺降解的过程中,氯离子也会被优先脱除;磷酸三氯乙酯经过氧化后产生的氯代中间产物也先经过HO·的取代反应,最后生成氯离子、磷酸根和其他小分子有机物[43]。
对于含苯环和萘环类有机物,FeS/PS工艺也显现出降解性能。马国峰等[44]认为,FeS/PS工艺对酸性橙Ⅱ有明显的降解效果,使苯环和萘环的吸收峰强度明显降低,其中FeS的投加量是影响去除效率的主要因素。
对于含氧基团有机污染物,FeS活化PS产生的HO·和SO4·-也能促进含氧基团发生取代或氧化反应,生成小分子有机物或无机物。Chen等[45]研究发现,FeS活化PS能很好地降解2,4-二氯苯氧基乙酸(2,4-D),并具有较好的可重复性。在较低的pH值(pH=3~4)下,可通过从FeS中释放出更多的Fe2+来增强PS的活化。在pH值>4时,会生成氢氧化铁复合物(如Fe(OH)2、Fe(OH)24+、Fe(OH)2+、Fe(OH)3以及Fe(OH)4-)吸附在FeS表面上,从而阻碍PS的活化过程。HO·和SO4·-是与2,4-D反应的主要自由基,HO·反应效率更强,活化产生的HO·和SO4·-优先与2,4-D的侧链C—O键反应,经过氧化反应和电子转移过程,最终使2,4-D矿化为CO2、H2O。
对于含氮基团有机物的去除,FeS活化PS产生的SO4·-极易与胺基发生电子转移降解污染物。Yuan等[46]的研究表明,FeS/PS工艺能有效降解对氯苯胺,FeS中的S(-Ⅱ)能促进铁循环,持续产生的Fe(Ⅱ)能有效地分解PS,比ZVI活化PS效果更好。对氯苯胺的降解途径:①与FeS直接发生脱氯反应;②氨基与SO4·-发生电子转移;③HO·与对氯苯胺发生取代反应[47]。
另外,FeS也能作为亚硫酸盐的活化剂,例如FeS/亚硫酸盐对药物普萘洛尔(苯乙醇胺类)具有较好的去除效果[48]。在pH=6时,FeS/亚硫酸盐降解普萘洛尔的效果远超过FeS/PS。在pH=6时,20 min的去除率达95%。与活化PS不同的是,从FeS中浸出的Fe2+诱导了亚硫酸盐的活化,而不是Fe(Ⅱ/Ⅲ)的活化作用。Fe2+与亚硫酸盐发生质子化反应产生FeSO3+,FeSO3+分解产生SO3·-,再经过O2氧化生成SO5·-,SO5·-与HSO3-反应生成SO4·-[49]。所得的SO4·-能还原HSO3-生成SO3·-,也能与H2O或OH-反应生成HO·。反应过程中SO4·-为主要的反应自由基,SO3·-和HO·反应较弱。
4 结论与展望
(1)自然界中储量丰富的FeS是一种极好的还原性材料,也是高级氧化技术的催化材料,能应用在有机污染物治理中。
(2)FeS的层状结构使其具有更好的电子转移能力。在氧化过程中还会产生强还原性的Fe(Ⅱ)和S(-Ⅱ),此外产生Fe(Ⅲ)也能与FeS反应生成Fe(Ⅱ),形成铁循环,S(-Ⅱ)促进了铁循环。
(3)FeS的结构和性质使其比其他还原性材料(例如零价铁)具有更强的还原性能和催化性能。有机物降解中,FeS通过吸附作用和还原作用直接降解卤代有机污染物;FeS/高级氧化技术能降解大多数有机污染物,对含卤素、烯烃、苯环类有机污染物降解效果最为显著。
(4)目前大部分的研究都是对单一污染物,需要进一步探讨FeS高级氧化技术对复杂废水的降解效果。

