腹腔镜直肠癌根治术对患者炎症反应、免疫功能及并发症的影响
蔡楚东,周俊怿,柯斌杰
(1.汕头市中心医院普外二科,广东 汕头 515031;2.南澳县人民医院普外科,广东 汕头 515900)
直肠癌属于全球范围内常见的恶性消化道肿瘤,随着社会发展、人们生活水平及饮食结构的改变,直肠癌发病率逐年上升,严重危及生命安全[1-2]。现阶段直肠癌根治术是临床治疗直肠癌的主要手段,如传统开腹术、腹腔镜手术,其中传统开腹术清灶彻底,且术式简易方便,但由于手术创伤大、术后并发症多,易引发术后炎症反应和免疫机制损伤,不利于患者术后恢复[3]。近年来,腹腔镜直肠癌根治术已广泛应用于临床实践中[4],具有创伤小、术后并发症较少等优势。然而,关于其减轻炎症、调节免疫及胃肠道功能的影响尚未见相关报道。本研究拟分析腹腔镜直肠癌根治术对患者炎症反应、免疫功能及并发症的影响,旨在为临床深入开展并推广腹腔镜直肠癌根治术提供一定的参考。
1 资料与方法
1.1 一般资料
回顾性分析2017年7月1日至2019年12月30日在汕头市中心医院实施直肠癌根治术的110例患者临床资料。55例采用腹腔镜直肠癌根治术 (腹腔镜组),55例接受开腹直肠癌根治术(开腹组)。开腹组中,男性33例,女性22例;年龄39~73岁,平均(45.62±7.20)岁;肿瘤淋巴结转移(tumor lymph node metastasis,TNM)分期:Ⅰ期17例,Ⅱ期27例,Ⅲ期11例;肿瘤直径1.6~7.2 cm,平均肿瘤直径(4.15±1.20)cm;病理分化程度:低中分化46例,高分化9例。腹腔镜组中,男性35例,女性20例;年龄43~76岁,平均(45.83±9.15)岁;肿瘤TNM分期:Ⅰ期19例,Ⅱ期24例,Ⅲ期12例;肿瘤直径1.6~7.2 cm,平均肿瘤直径(4.15±1.20)cm;病理分化程度:低中分化48例,高分化7例。两组患者的性别、年龄、肿瘤临床分期、肿瘤直径及肿瘤分化程度比较,差异无统计学意义(P>0.05)。研究通过医院伦理委员会审批。纳入标准:术前经电子肠镜及病理检查确诊为直肠癌,并符合直肠癌诊断标准[5];符合试验手术治疗指征[5]:(1)全身状态及脏器功能能够耐受手术;(2)肿瘤局限于肠壁,能够整块切除,且区域淋巴结可彻底清扫;(3)存在远处转移,可彻底切除;(4)临床资料完整;(5)全部患者于术前1个月内未接受过影响机体炎症及免疫功能的相关治疗手段;(6)术前无放疗、化疗或内分泌治疗;(7)知情同意。排除标准:(1)出现远处转移及侵犯周围器官;(2)存在严重肠粘连;(3)合并其他恶性疾病;(4)自身免疫疾病;(5)依从性较低者;(6)凝血功能异常或急性肠梗阻。
1.2 治疗方法
两组患者术前均予以常规胃肠道准备,手术过程严格遵循肿瘤根治的原则实施,行气管插管全麻。开腹组实施开腹术:取截石位,于腹部正中绕脐位置做切口,逐层开腹,对腹腔进行常规探查,观察肿瘤情况,将直肠游离出,切除病变肠段,端端吻合或端侧吻合。冲洗腹盆腔手术区,将引流管放置后逐层关腹。腹腔镜组行腹腔镜直肠癌根治术:取截石位,在患者脐下缘1 cm位置做手术切口,之后插入Trocar管作观察孔,建人工气腹(压力13 mmHg),在两髂前上棘连线和右锁骨中线交叉位置插入Trocar管作主操作孔,在两锁骨中线和肚脐水平位置插入Trocar 管作辅助操作孔。在腹腔镜的引导下,探查肿瘤情况,对患者肠段及肠系膜下血管进行游离,彻底清除周围淋巴结,实施端端吻合或端侧吻合,冲洗腹盆腔手术区,将引流管放置后逐层关腹。
1.3 观察指标
(1)两组患者手术时间、术中出血量、术后排气时间、住院天数、肠鸣音恢复时间、肛门排气时间等手术情况;(2)两组患者手术前后肿瘤坏死因子-α( tumor necrosis factor-α,TNF-α)、白介素6(interleukin-6,IL-6)、T淋巴细胞亚群(CD4+、CD8+、CD4+/CD8+)的水平;(3)统计患者术后腹痛腹胀、肠梗阻、吻合口瘘、感染等并发症。
1.4 实验方法
采集患者术前、术后静脉血6 mL,以3 000 rpm转速离心,收集上清液,通过酶标仪(赛默飞世尔科技有限公司,型号Varioskan LUX)参照酶联免疫吸附法(试剂盒购自上海谷研生物科技有限公司,货号48T/96T)检测TNF-α、IL-6的水平;免疫比浊法(试剂盒购自南京建成生物工程研究所有限公司,货号E023-1-1)检测C反应蛋白(C-reactive protein,CRP)水平;通过流式细胞仪(仪器购自赛雷纳医疗科技有限公司,型号Celula)检测血清中T淋巴细胞亚群(CD4+、CD8+、CD4+/CD8+)水平。
1.5 统计学分析
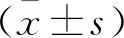
2 结果
2.1 两组手术情况的比较
腹腔镜组手术时间长于开腹组,其术中出血量、住院天数、肠鸣音恢复时间及肛门排气时间也较开腹组显著缩短(P<0.05)。见表1。
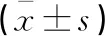
表1 两组手术情况的比较
2.2 两组炎症因子的比较
术前,两组TNF-α、IL-6、CRP水平比较,差异无统计学意义(t=0.241、0.075、0.158,P>0.05);术后,两组TNF-α、IL-6、CRP水平均高于术前(t开腹组=12.777、16.959、12.561,P<0.05;t腹腔镜组=7.673、9.661、4.876,P<0.05),且腹腔镜组TNF-α、IL-6、CRP水平低于开腹组(P<0.05)。见表2。
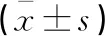
表2 两组炎症因子的比较
2.3 两组T淋巴细胞亚群的比较
术前,两组CD4+、CD8+、CD4+/CD8+比较,差异无统计学意义(t=0.267、0.613、0.105,P>0.05);术后,两组CD4+、CD4+/CD8+均低于术前,CD8+高于术前(t开腹组=4.336、4.127、5.527,P<0.05;t腹腔镜组=2.036、2.344、2.763,P<0.05);且腹腔镜组CD4+、CD4+/CD8+高于开腹组,CD8+低于开腹组(P<0.05)。见表3。
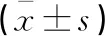
表3 两组T淋巴细胞亚群的比较
2.4 两组并发症的比较
术后,腹腔镜组吻合口瘘2例,并发症总发生率为3.64%;开腹组术后腹痛腹胀3例、肠梗阻3例、吻合口瘘5例、感染2例,并发症总发生率为23.64%,差异有统计学意义(P<0.05)。见表4。
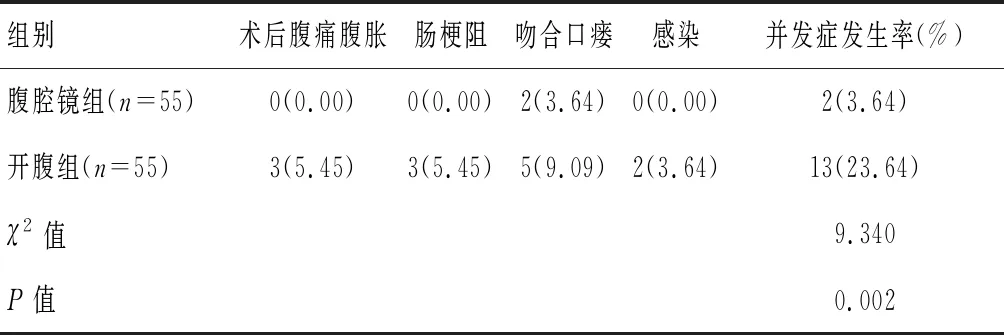
表4 两组术后并发症发生情况[n(%)]
3 讨论
直肠癌在临床肿瘤科较为常见,发病率及致死率均较高,且早期症状易被忽略,若耽误其最佳治疗时间,随着肿瘤的发生发展,患者可表现为腹痛、腹泻、便血等症状,晚期可累及全身,严重威胁生命健康[6]。传统开腹术的创伤、术后引起的炎症反应及免疫损伤均可影响预后[7-8]。随着微创术的不断发展,腹腔镜直肠癌根治术的微创性、疗效已被证实,并于临床广泛应用[9]。腹腔镜直肠癌根治术能否较开腹手术减轻炎症反应、减少对机体免疫损伤及胃肠道功能的影响,促进病情好转,改善预后,仍待进一步研究。
本研究发现腹腔镜组患者手术时间长于开腹组(P<0.05),术中出血量、住院天数、肠鸣音恢复时间及肛门排气时间较开腹组缩短(P<0.05),提示腹腔镜直肠癌根治术虽然手术时间长于开腹术,但其对患者机体创伤影响较小,更利于患者术后肠道功能恢复,术后恢复较快。并且其手术时间较长可能与医师手术操作经验及对人体解剖结构的了解程度有关,随着医师操作技术的不断纯熟、医疗器械的改进,手术时间有望于进一步缩短至接近或短于开腹手术时间。此外,腹腔镜组术中出血量、肠道功能恢复时间及住院时间较开腹术短,分析原因可能是腹腔镜手术切口小,出血量少,进而减轻手术对机体产生的创伤应激反应,促进患者恢复。这与苏德望等[10]报道结果较为一致。
外科手术一般会对机体产生一定创伤,诱发机体炎症应激反应,且随着炎性应激反应的加剧,体内相关炎性因子TNF-α、IL-6、CRP水平也随之升高,会进一步增加术后并发症风险,对患者术后康复极为不利[11]。本研究发现,术后两组TNF-α、IL-6、CRP水平均高于术前(P<0.05),且腹腔镜组TNF-α、IL-6、CRP水平低于开腹组(P<0.05),提示腹腔镜胃癌根治术对机体炎症应激反应的影响较小,这可能是由于腹腔镜手术对机体产生的创伤较小,引起炎性应激反应不如开腹手术剧烈,与Liu等[12]报道较为一致。
免疫抑制常引发外科感染,其机制主要为免疫抑制后,机体难以清除切口处外源致病菌,以及难以抑制因肠粘膜屏障功能异常造成的肠道细菌转移等[13-14]。细胞免疫在机体中发挥抗肿瘤、抗感染的作用,其中T淋巴细胞亚群是反应机体细胞免疫功能的重要指标,主要分为CD4+T细胞及CD8+T细胞[15]。术后感染风险增加、肿瘤恶化主要在于机体手术创伤后出现不同程度的免疫抑制现象,表现为CD4+T细胞降低、CD8+T细胞增加及CD4+/CD8+细胞比例失调,与创伤程度及预后密切相关[16]。本研究发现,术后两组CD4+、CD4+/CD8+均低于术前(P<0.05),CD8+高于术前,且腹腔镜组CD4+、CD4+/CD8+高于开腹组,CD8+低于开腹组(P<0.05),提示腹腔镜手术对直肠癌患者的免疫抑制作用较小,有助于患者术后的恢复。分析原因可能与腹腔镜手术创伤小,对机体产生的应激反应影响小有关,与赵晓智等[17]研究报道一致。
直肠癌术后出现的暂时性肠麻痹会引发类似急性肠梗阻的病理反应,使消化道的分泌物于胃肠腔内大量堆积,进一步刺激胃肠黏膜,造成胃肠腔内压升高,吻合口张力升高,影响胃肠道功能的恢复,甚至可能提高吻合口瘘的发生风险[18]。同时由于根治术的创伤应激,激活机体炎症反应,释放大量炎症因子而损伤肠屏障功能,加之削弱患者的免疫功能,进一步增加机体感染风险[19]。本研究术后并发症结果发现腹腔镜组并发症发生率显著低于开腹组(P<0.05),提示腹腔镜手术较开腹术可降低患者术后并发症发生风险。这可能是由于:(1)腹腔镜手术可在直视下进行手术操作,有效保护盆腔周围神经,减轻对盆腔脏器的干扰,避免对肠管机械牵拉,进而降低术后肠梗阻、腹痛的发生;(2)腹腔镜下视野更加清晰,有助于医师识别异常血管,手术创伤小,减轻炎症应激及免疫抑制,降低患者感染风险,与王征新[20]报道结果一致。
综上所述,腹腔镜直肠癌根治术对患者机体炎症反应及免疫功能影响较小,具有微创、促进患者肠道功能恢复及降低并发症风险的优势。然而本研究仍存一定不足之处,如受试者数量较少,后续试验研究可进一步增加受试样本量,明确腹腔镜直肠癌根治术对患者机体的影响。

