SLE患儿外周血自噬基因的表达与疾病发生及活动水平的关系
刘志明,郜苗苗,邵丽丽,朱翠敏,刘秀芬
(沧州市中心医院儿科,河北 沧州 061000)
系统性红斑狼疮(systemiclupuserythematosus,SLE)是常见的自身免疫性疾病之一,临床表现为皮肤、关节、肾脏、心血管等多组织器官受累,重症者若不及时有效治疗,可危及生命[1]。既往研究[2-3]表明,过度自噬可导致细胞的长期存活,造成自体成分被作为抗原递呈,并在自身免疫性疾病的发生与进展中扮演重要角色。SLE患者及小鼠模型中均存在明显的自噬异常[4],而自噬活动改变的机制目前尚未完全明了,自噬基因Beclin-1、ATG-5、ATG-7及p62等在SLE中表达水平及其意义亦不完全清楚[5]。本研究拟通过检测SLE患儿外周血单核细胞(peripheral blood monocytes,PBMC)中Beclin-1、ATG-5、ATG-7、p62 表达水平及蛋白表达量的变化,探讨其在SLE发生发展中的作用,以期寻找新的治疗靶点。
1 资料与方法
1.1 一般资料
选取2019年1月至2019年8月沧州市中心医院确诊的50例SLE患儿为研究对象,根据系统性红斑狼疮疾病活动性指数(systemic lupus erythematosus disease activity index,SLEDAI)评分标准[6]分为SLE-1组(初诊、未经治疗且SLEDAI≥10分)和SLE-2组(经治疗且SLEDAI<10分),每组各25例;另选15名健康儿童为正常对照组(NC组)。本研究本研究经院伦理委员会批准,患儿家长知情同意。三组儿童性别、年龄比较,差异无统计学意义(P>0.05)。见表1。
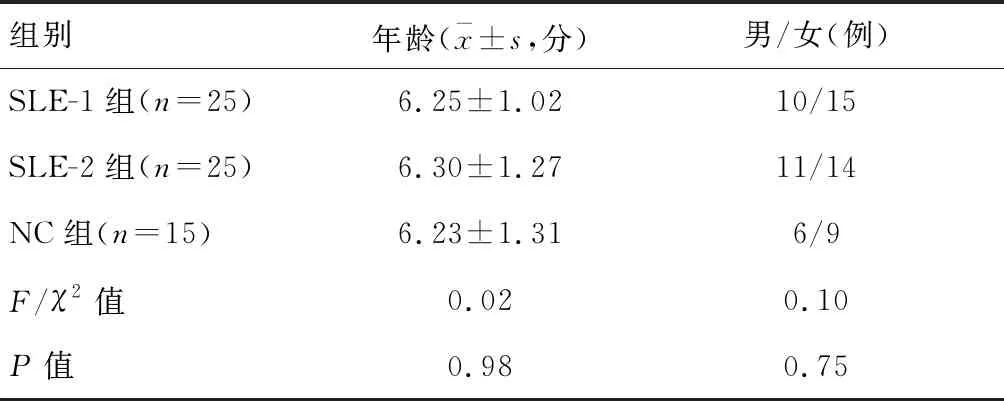
表1 基线资料比较
1.2 方法
1.2.1 自身抗体水平检测 真空管采集患者静脉血,离心取上清液。间接免疫荧光法检测血清抗核抗体(anti-nuclear antibody,ANA),试剂购于美国Inova公司;酶联免疫吸附试验检测抗ds-DNA抗体,试剂购于爱尔兰TrinityBiotech Plc公司;免疫印迹法检测抗可提取性核抗原抗体,包括抗RNP抗体、抗Sm抗体、抗SS-A抗体、抗SS-B抗体、抗Scl-70抗体、抗Jo-1抗体,试剂购于德国欧蒙公司。操作及结果判定按试剂说明书进行。
1.2.2 血液相关指标检测 采用血细胞分析仪及全自动生化分析仪(国罗氏诊断有限公司)检测血小板(PLT)、血红蛋白(Hb)、甘油三酯(TG)、总胆固醇(TC)、肌酐(Sre)、血沉(ESR)等;免疫比浊法检测补体C3、C4水平,试剂盒购自北京中生公司;采用罗氏 Cobas c701型全自动生化分析仪及其配套试剂检测免疫球蛋白IgG、IgA、IgM水平。
1.2.3 Beclin-1、ATG-5、ATG-7、p62表达水平检测 采用荧光定量PCR实验,步骤如下:(1)密度梯度离心法提取PBMC。采集晨起空腹外周静脉血5 mL,以Hanks液(TIANDZ公司)等体积稀释,室温吹打混匀,备用。取2 mL圆底试管,先加入淋巴细胞分离液于底部,再沿管壁加入稀释血液,保持分层不混匀。20 ℃,2 000 rpm离心20 min,此时圆底试管中分为4层,白色细胞层即为PBMC,吸取细胞并悬浮于Hanks液,-80 ℃保存备用。(2)总RNA的提取与鉴定。采用Trizol型RNA试剂盒(美国Invitrogen 公司)提取,操作严格按试剂盒说明进行;Alpha1506型分光光度计(上海谱元仪器有限公司)检验RNA纯度:变性凝胶电泳后,溴化乙锭染色,观察28S及18S rRNA条带的清晰度及强度比值,强度比值≈2∶1代表RNA完整性良好。(3)RT-qPCR实验。配置常规逆转录体系(Catalog公司RT0411-01),逆转录获取模板cDNA,条件为55 ℃孵育30 min,85 ℃加热5 s;配置PCR体系进行扩增(引物序列见表2),反应条件为:94 ℃预变性5 min,94 ℃变性30 s,50~60℃退火30 s,72 ℃延伸90 s,扩增40个循环,每个样本检测3次。以GAPDH为内参,采用2-ΔΔCt法计算各个基因的mRNA表达水平。
1.2.4 Beclin-1、ATG-5、ATG-7、p62蛋白表达量测定 采用 Western blotting 法,步骤如下:(1)蛋白提取与定量。全蛋白提取试剂盒(美国Gene Copoeia公司)提取PBMC的总蛋白,BCA法定量后,buffer缓冲液配制成1 μg/μL的蛋白溶液。(2)十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)电泳与电转印。配置电泳体系,以每孔10 μg蛋白用量进行SDS-PAGE电泳,电泳条件:60 V预电泳30 min除去凝胶杂质,调整至90 V电泳 70 min,电泳后蛋白按分子量大小分开,形成条带,将电泳后的蛋白条带转印至NC膜。(3)封闭与孵育。5%脱脂牛奶封闭90 min,PBST清洗3次,5 min/次。一抗孵育,兔抗人BECN1单克隆抗体(美国Abcam公司)、兔抗人ATG5单克隆抗体(美国Abcam公司)、兔抗人ATG7 单克隆抗体(美国Abcam公司)、兔抗人P62单克隆抗体(美国Abcam公司)的浓度分别为1∶2 000、1∶2 500、1∶1 800、1∶2 000,4 ℃ 过夜,PBST清洗3次,5 min/次;二抗(上海碧云天公司)37 ℃孵育90 min,浓度1∶2 500。(4)显影与定量。ECL荧光显色,暗室显影,采用影像分析软件Image J分析目的条带和内参条带的灰度值,目的蛋白表达量=目的条带灰度值/内参条带灰度值。见表2。

表2 Beclin-1、ATG-5、ATG-7、p62及内参基因GAPDH引物序列表
1.3 统计学分析
2 结果
2.1 三组儿童血液相关指标比较
SLE-1及SLE-2组C3、C4、PLT、Hb水平低于NC组(P<0.05),且SLE-1组低于SLE-2组(P<0.05);IgG、IgM、IgA、Sre、TG、ESR高于NC组(P<0.05),且SLE-1组高于SLE-2组(P<0.05);抗ANA抗体、抗ds-DNA抗体阳性率高于NC组(P<0.05),且SLE-1组高于SLE-2组(P<0.05)。见表3。
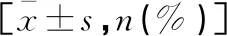
表3 三组儿童血液相关指标比较
2.2 三组儿童Beclin-1、ATG-5、ATG-7及p62 mRNA表达水平比较
SLE-1组及SLE-2组Beclin-1、ATG-7及p62 mRNA表达水平高于NC组(P<0.05),且SLE-1组高于SLE-2组(P<0.05)。见表4。

表4 三组儿童Beclin-1、ATG-5、ATG-7及p62 mRNA表达水平比较
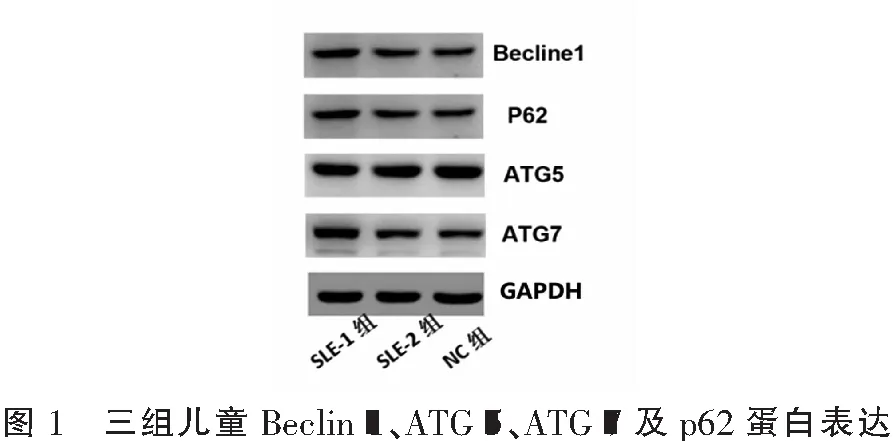
2.3 三组儿童Beclin-1、ATG-5、ATG-7及p62蛋白表达水平对比
SLE-1组及SLE-2组Beclin-1、ATG-7及p62蛋白表达量高于NC组(P<0.05),且SLE-1组高于SLE-2组(P<0.05)。见表5、图1。
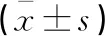
表5 三组儿童Beclin-1、ATG-5、ATG-7及p62蛋白表达水平比较
3 讨论
细胞及体液免疫反应的异常、B细胞过度激活产生自身抗体、免疫复合物的沉积是SLE主要的病理特点。本研究中,SLE组C3、C4水平低于NC组(P<0.05),且SLE-1组低于SLE-2组(P<0.05);IgG、IgA水平高于NC组(P<0.05),且SLE-1组高于SLE-2组(P<0.05),与既往研究[7]报道一致,提示抗体形成及补体参与了SLE的发生与发展。
自噬是广泛存在于真核细胞内的一种溶酶体依赖性细胞降解途径,在从酵母细胞到哺乳动物不同生物间高度保守。自噬在细胞分化、氧化应激、细胞内环境稳态、免疫系统的成熟中扮演重要角色。过度自噬可导致细胞的长期存活,引起内含DNA/RNA聚合体的凋亡小体通过与TLR-7等结合激活免疫,将自体成分作为抗原递呈,是SLE、类风湿性关节炎等自身免疫性疾病的重要病理机制之一[2]。ATG-5是自噬执行的重要分子,主要参与自噬小体成熟[8-9]。Beclin-1与酵母细胞ATG-6同源,是启动自噬的重要基因[10]和测定自噬水平的常用标志物之一[11]。ATG-7位于自噬囊泡扩张中LC3和Atg12两个泛素样系统的中心。p62与酵母细胞ATG-8同源,在蛋白聚集、泛素化底物的运送及降解清除中发挥重要作用[9]。近年来,自噬影响SLE等自身免疫性疾病的机制是临床研究的热点之一[12-13]。
本研究结果显示,SLE患儿PBMC中Beclin-1、ATG-7及p62基因及蛋白表达水平均高于健康儿童(P<0.05),与既往研究[8,11]结论一致,说明SLE患儿存在自噬活跃度增加,自噬失衡;SLE-1组患儿Beclin-1、ATG-7及p62基因表达水平及蛋白表达量高于SLE-2组(P<0.05),提示Beclin-1、ATG-7及p62mRNA的表达不仅与SLE的发生有关,还与其活动水平存在关联,据此推断,药物治疗可能是通过改变自噬水平而实现的;不同活动度的SLE患儿ATG-5基因mRNA及其蛋白表达水平与健康童无明显差异(P>0.05)。既往研究[8]发现,ATG-5基因rs6937876等至少5个单核普酸多态性(Single nucleic acid polymorphism,SNP)与SLE的易感性有关,对发展成SLE具有重要影响,但ATG-5基因与SLE发病及病情的相关性有待进一步研究。本研究尚未对目的基因进行细胞或动物实验以明确其在SLE自噬功能改变中的机制。而自噬合成的增加及分解受阻均可导致自噬动态平衡打破、细胞自噬功能障碍,其具体机制有待进一步研究。
综上所述,SLE自噬水平增强,Beclin-1、ATG-7、P62 水平及蛋白量在治疗后降低,自噬可能参与了SLE的发生与发展,可能是治疗的新靶点。

