HMGB1-TLR4和Müller细胞在视网膜血管生成中的作用*
孙玉莹 肖 欧 黄春雨
1.中山大学肿瘤防治中心防癌体检中心,华南肿瘤学国家重点实验室,广东 广州 510060;2.中山大学中山眼科中心,广东 广州 510060;3.中山大学肿瘤防治中心内镜中心,华南肿瘤学国家重点实验室,广东 广州 510060
许多视网膜新生血管相关病变如视网膜静脉阻塞、增殖型糖尿病性视网膜病变、早产儿视网膜病变等疾病都会对视力产生不可逆的损害[1]。高迁移率族蛋白1 (high mobility group box-1 protein, HMGB1)是一种核蛋白,在多种组织中均有表达,Toll样受体通过与HMGB1结合激活其信号转导通路,产生和分泌一系列细胞因子及抗微生物多肽等,参与多种生物学过程,其中包括血管生长过程[2]。HMGB1-TLR4信号通路也被证明在中枢神经系统的细胞凋亡和坏死中起重要作用[3]。视网膜是一种特殊的神经组织,由精确的神经元、胶质细胞网络和微血管网络排列而成。研究发现胶质细胞可能通过释放促血管生成介质(包括细胞因子、生长因子和蛋白酶)来诱导新生血管形成[4]。Müller细胞是视网膜中最主要的胶质细胞,它被活化的机制尚不明确。本研究主要通过视网膜荧光铺片、免疫荧光和PCR等实验方法,研究HMGB1-TLR4信号通路和Müller细胞在视网膜新生血管生成中的作用及其作用机制。
1 材料与方法
1.1 实验动物及OIR模型的建立
2019年1月至2019年12月期间,购买新生SPF级C57BL/6J小鼠90只和新生SPF级TLR4基因敲除C57BL/6J小鼠50只。按照Smith等[5]报道的方法进行小鼠OIR模型的制备,将母鼠和出生后7天(P7)的C57BL/ 6J幼鼠及TLR4基因敲除幼鼠放置于氧浓度为(75±2)%的氧箱中饲养,5天后放回正常的氧环境中。将所有小鼠分为3组,分别是常氧组小鼠40只(一直饲养在正常氧环境中),正常OIR组小鼠50只和TLR4基因敲除OIR(TLR4-/-OIR)组小鼠50只。
1.2 小鼠硫氰酸荧光素-葡聚糖(FITC-Dextran)视网膜荧光灌注铺片
将每组10只小鼠于出生后17天(P17)取材,用4.3%的水合氯醛0.3 mL/100 g腹腔注射麻醉小鼠,固定小鼠四肢。剪开小鼠胸腹壁,暴露心脏,夹住腹主动脉,剪开右心耳,同时将1 mL PBS稀释为50 mg/mL的硫氰酸荧光素-葡聚糖(FITC-Dxtran)(Sigma-Aldrich,美国),用25 G针头和1 mL注射器缓慢注入左心室。灌注完毕后等待2~3 min,取出小鼠眼球,用4%多聚甲醛固定45 min,然后PBS溶液清洗,在解剖显微镜下沿角膜巩膜缘剪开眼球,用无齿镊自锯齿缘分离巩膜,有齿镊分离出眼晶状体等组织,完整剥离出视网膜,再轻轻去除视网膜内面的残留物和玻璃体等,将视网膜放在载玻片上,从锯齿缘到赤道部做4个放射状切开,使其均匀地分成像花瓣一样的4个象限,然后将视网膜内侧向上平铺在载玻片上,抗荧光淬灭封片剂封片,在荧光显微镜下观察视网膜无灌注区大小、新生血管形态和分布。
1.3 小鼠视网膜GS-isolectin B4血管染色
每组10只小鼠于P17时取材,麻醉过量致死小鼠、取出眼球及视网膜平铺片的方法同1.2,将分离好的视网膜放在Triton X-100溶液中,4℃孵育过夜;用PBS轻轻洗涤3次,每次5 min,然后放在浓度为1%的谷氨酰胺合成酶 (glutamine synthetase,GS)-isolectin B4(美国Vector公司)中,避光振荡过夜孵育,PBS洗涤后,将视网膜均匀地分成4个象限,平铺在载玻片上,抗荧光淬灭封片剂封片,在荧光显微镜下观察视网膜无灌注区和新生血管情况。
1.4 小鼠视网膜组织冰冻切片进行免疫荧光染色
在P17时取每组20只小鼠的眼球,麻醉过量处死小鼠后,取出眼球放入OCT包埋剂中包埋,-20℃冷冻固定后,平行于眼球角膜至视乳头的矢状位方向进行均匀连续切片,切片厚度为5~8 μm。将冰冻切片丙酮固定,封闭液封闭后,用50 μL的HMGB1一抗(1%BSA稀释为1∶100)孵育过夜。滴加荧光素标记的二抗,避光孵育1 h后漂洗3次,然后使用0.1 μg/mL DAPI 50 μL进行细胞核染色。封片后在激光共聚焦显微镜下选择合适波长观察。TLR4和GFAP免疫荧光共染色的步骤同上,加入1∶100稀释的TLR4一抗和1∶500稀释的GFAP一抗,4°C共同孵育过夜,PBS漂洗后分别添加1∶500稀释后A594标记和Alexa Flour488标记的二抗,室温下孵育各2 h,PBS洗涤后, DAPI染色后固定,封片。TLR4和HMGB1免疫荧光共染色的步骤同上。
1.5 实时定量PCR(real-time PCR)检测视网膜组织中HMGB1 mRNA的表达水平
在P12、P17时分别取两组OIR小鼠各10只,麻醉过量处死小鼠后,用Trizol按照标准步骤抽提RNA,逆转录合成cDNA,按PCR试剂盒说明书进行扩增,融解曲线分析。以GAPDH作为对照,用比较CT值的方法,计算HMGB1相对表达的变化情况。
1.6 统计学方法
采用SPSS 19.0软件进行统计分析。两组OIR小鼠PCR检测结果的变化差异比较采用独立样本t检验。检验水准α=0.05。
2 结 果
2.1 视网膜FITC荧光灌注平铺片和GS isolectin B4染色平铺片,观察视网膜新生血管形态和分布的改变
小鼠视网膜FITC荧光灌注铺片结果显示P17时,正常OIR组和TLR4-/-OIR组的视网膜中周部出现大片无血管区,在视网膜中周部及无血管区附近出现大量的新生血管簇,新生的血管明显扩张、走形迂曲、分布紊乱、成团簇状。P17时对比正常OIR组,TLR4-/-OIR组小鼠团簇状新生血管出现明显减少,无血管区面积也相对较小,见图1。图2结果显示P17时,与正常OIR小鼠相比,TLR4-/-OIR小鼠的新生血管簇明显减少,结果和FITC灌注铺片图(图1)基本相同。
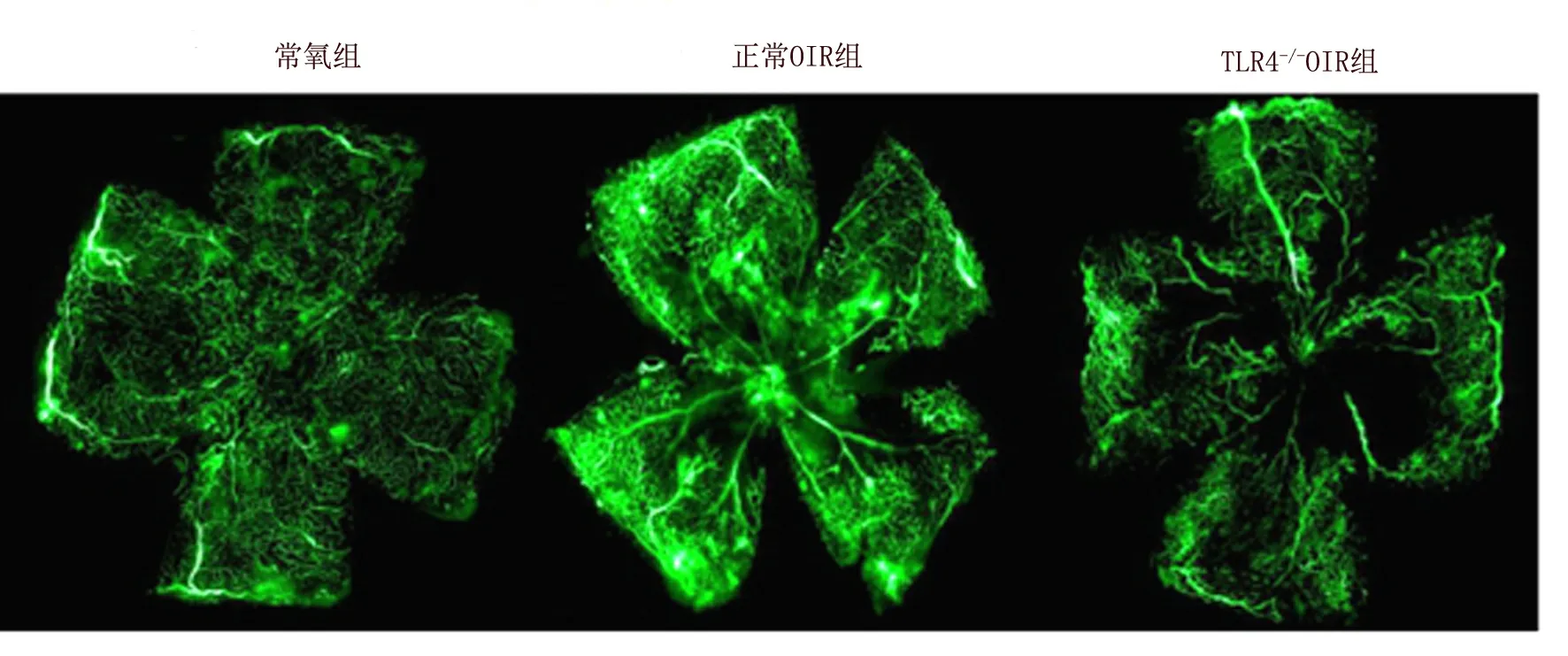
图1 小鼠视网膜FITC荧光灌注铺片图(×40)

图2 小鼠视网膜GS isolectin B4染色铺片图(×40)(视网膜新生血管簇呈绿色的点片状)
2.2 缺氧损伤视网膜中,TLR4逆向调控HMGB1的表达
P17时,通过免疫荧光方法检测HMGB1在3组小鼠视网膜组织的表达情况,发现在正常OIR小鼠视网膜中HMGB1的表达最强,TLR4-/-OIR小鼠中表达相对弱,常氧组小鼠的表达最弱,如图3所示。大量的HMGB1阳性细胞在视网膜多层组织中均有分布。

图3 P17时各组小鼠视网膜HMGB1的免疫荧光染色(×400)(红色表示HMGB1染色,蓝色表示细胞核染色)
P17时,通过免疫荧光方法检测两组OIR小鼠视网膜HMGB1和TLR4的共表达情况,结果发现正常OIR小鼠视网膜的HMGB1和TLR4表达一致性增强,而TLR4-/-OIR小鼠HMGB1的表达水平较低,TLR4无明显表达(图4)。

图4 P17时两组OIR小鼠视网膜HMGB1和TLR4的免疫荧光双标记染色(×400)(红色表示HMGB1染色,绿色表示TLR4染色,蓝色表示细胞核染色)
通过实时荧光定量PCR检测,在P12和P17时,TLR4-/-OIR小鼠视网膜组织中HMGB1 mRNA表达水平比正常OIR组明显降低(图5)。

注:每个样品参考值均以GAPDH为标准。与正常OIR小鼠相比,TLR4-/-OIR小鼠视网膜HMGB1 mRNA的表达水平明显降低(倍数变化:P12:1.428±0.036 vs. 0.952±0.023,P=0.013;P17:2.702±0.068 vs. 1.737±0.038,P= 0.015。n=10,*P<0.0 5)。
2.3 TLR4与视网膜Müller细胞的活化存在密切联系
与常氧组小鼠相比,正常OIR小鼠视网膜Müller细胞的阳性反应非常明显,GFAP标记显示其轴性几乎表达在视网膜全层(包括内皮层、神经节细胞层和内核层等),视网膜神经纤维层的GFAP免疫反应较强,呈膨大状,双标记染色显示活化的GFAP标记的Müller细胞与TLR4的表达均明显增强(图6)。常氧组小鼠视网膜释放的TLR4较少,GFAP的表达较弱。

图6 P17时常氧组和正常OIR组小鼠视网膜TLR4和GFAP的免疫荧光双标记染色(×400)(红色表示GFAP染色,绿色表示TLR4染色,蓝色表示细胞核染色)
3 讨 论
视网膜血管疾病是慢性、难治性疾病,需要寻求有效的治疗方法。许多研究发现免疫炎症反应、胶质细胞活化等与新生血管形成存在密切联系[6]。HMGB1普遍存在于哺乳动物组织细胞中,它的主要配体有糖基化终产物受体(receptor for advanced glycation end-products, RAGE)[7]和Toll样受体家族(Toll-like family of receptors, TLRs)中的部分成员[8]。其中TLR2和TLR4可与巨噬细胞、中性粒细胞分泌的HMGB1结合,促使NF-κB的活化,诱导炎症反应的发生,这说明TLR2和TLR4是HMGB1的受体[9]。研究发现HMGB1参与病理性新生血管的生成和神经退行性变的过程中,尤其与糖尿病视网膜病变存在密切联系[10]。TLRs是促进免疫炎症反应的重要因子,在免疫炎症反应介导的血管生成中发挥重要作用。TLR4在损伤组织被HMGB1活化后,可增强NF-kB、VEGF及多种炎症因子的表达,参与新生血管生成[11-13]。
目前许多研究关注小胶质细胞的作用,Müller细胞作为视网膜中最重要的胶质细胞,参与多种生理过程。研究发现,在大鼠糖尿病视网膜病变模型中,小胶质细胞被活化、细胞因子释放增加和血管通透性增加[14-15]。抑制小胶质细胞能明显减少视网膜新生血管面积,提示活化的小胶质细胞与视网膜新生血管的生成密切相关[16-17]。在糖尿病视网膜病变中,Müller细胞会出现反应性胶质增生,最终会打破视网膜稳态,引起神经细胞损伤[18-19]。因此,减少Müller细胞增殖,对防治视网膜神经血管相关疾病有重要意义。
本研究采用的OIR模型是典型的缺血缺氧致血管生成的模型,能较好地反映视网膜组织的血管生成情况,可广泛应用于多种缺血性病理性新生血管相关疾病的综合研究。本研究结果发现,在缺氧缺血条件下,TLR4-/-OIR小鼠视网膜仅有少量新生血管出现,而正常OIR组视网膜新生血管在P17时达到最大水平,同时免疫荧光染色发现HMGB1在正常OIR组中表达最强,TLR4-/-OIR组和常氧组中表达相对较弱,这些结果表明缺氧诱导视网膜损伤可促进HMGB1和TLR4的表达,在缺血缺氧的视网膜组织中启动了HMGB1-TLR4信号通路,并参与新生血管生成的过程。此外,PCR及免疫荧光染色结果发现在P12和P17时,与正常OIR小鼠相比,TLR4-/-OIR小鼠视网膜HMGB1 mRNA的表达水平明显降低,这表明HMGB1的释放与TLR4的表达有关,TLR4基因的缺失抑制了HMGB1的释放,提示它们之间的相互作用可能通过自分泌或旁分泌机制参与视网膜新生血管的生成。免疫荧光结果发现与常氧组相比,正常OIR组中视网膜Müller细胞GFAP的表达明显增强,几乎分布在全层视网膜组织中,这表明在OIR组中,视网膜Müller细胞被显著激活。GFAP和TLR4免疫荧光双标记染色结果发现在OIR组中TLR4和GFAP的表达同步显著增强,表明TLR4参与了Müller细胞的活化。
本研究结果提示,HMGB1-TLR4信号通路可引起视网膜Müller细胞的活化,参与新生血管的生成,因此靶向抑制HMGB1-TLR4信号通路,可以降低Müller细胞的活性,抑制视网膜新生的血管生成,这有望成为一种新的治疗视网膜血管相关疾病的途径。
利益冲突所有作者均声明不存在利益冲突

