ENO1基因过表达对籽鹅卵泡颗粒细胞糖酵解、凋亡及细胞周期的影响
计 红,邵子益,薛琳琳 ,詹雪龙,邵百卉,郭景茹,李士泽,杨焕民,甄 莉*
(1.黑龙江八一农垦大学 动物科技学院, 黑龙江 大庆 163319,2.黑龙江职业学院,黑龙江 双城 150111)
α-烯醇化酶(α-enolase,ENO1)是烯醇化酶的一种,同时也是一种糖酵解酶,广泛存在于动物机体各个组织、器官之中。ENO1是一种多功能蛋白,除了参与糖酵解功能以外,还参与多种生物学过程。近年研究发现,ENO1与癌症存在密不可分的关系。乔慧[1]发现ENO1在胃癌组织中的表达水平显著高于癌旁组织,且通过敲低ENO1基因可以显著抑制胃癌细胞的增殖和克隆形成能力,并诱导胃癌细胞发生凋亡。资料显示,ENO1也参与机体的免疫调节。孙溶励[2]研究发现,针对ENO1介导的自身免疫反应可引起小鼠流产增加。SAXENA等[3]研究发现了HIV-1通过Nef介导的ENO1调节的CAWLEAQ基序侵入宿主的可能机制,并确定其可为HIV-1进入黏膜屏障的潜在治疗靶点。除此之外,ENO1与多种疾病的发病机制有着密不可分的关系,如BERRY等[4]研究发其为致糖尿病胰岛特异性CD4+T细胞的候选基因,并提示其可能在Ⅰ型糖尿病发病机制中存在作用。
籽鹅是东北地区常见的产蛋家禽,具有较高的产蛋能力。卵泡生长发育是家禽产蛋涉及的最主要过程之一,通过调节卵泡发育提高籽鹅产蛋率对畜牧生产意义重大。计红等[5]对籽鹅产蛋期前后卵巢差异表达基因进行研究时发现,ENO1在产蛋期和非产蛋期表达量差异显著。本实验室近期的研究结果也显示,ENO1可能对禽类卵泡颗粒细胞的增殖和凋亡具有重要影响,因此,本试验应用ENO1基因过表达载体转染入原代培养的籽鹅卵泡颗粒细胞进行过表达,探索ENO1过表达对籽鹅卵泡颗粒细胞糖酵解、增殖、凋亡和细胞周期的影响,为后续禽类生殖生理的研究提供理论依据。
1 材料与方法
1.1 实验动物8月龄产蛋期健康雌性东北籽鹅6只,均购自大庆市北方种鹅场。
1.2 颗粒细胞的原代培养及转染取籽鹅6只,处死后分别取F1级卵泡,进行卵泡颗粒细胞分离,并将分离出的细胞进行复合培养[6]。本试验分为3组:对照组、空载体组和ENO1过表达组。每组设置3个重复。细胞培养96 h时,将实验室前期构建好的ENO1基因过表达载体感染复数(Multiplicity of infection,MOI)= 350转染[7]。
1.3 ENO1基因过表达效果验证转染试验完成后,Trizol(美国Invitrogen公司)法提取总RNA。采用反转录试剂盒(大连宝生物)合成cDNA,并设计合成(上海生工)引物序列。ENO1 mRNA引物序列为:F:5′-GGTGCGGGGTGTTCAGATGTC-3′;R:5′-TCCACCAGCAGCCATCAA-3′。内参(β-actin):F:5′-CTGTCAAGGCTGAGAATG-3′ R:5′-CAAGAGGCATTGCTGACA-3′。腺病毒转染48 h后,分别收集培养液组、空载体组和ENO1过表达组的颗粒细胞,通过荧光定量PCR(试剂购自大连宝生物)检测ENO1 mRNA的表达情况,扩增条件:94℃预变性10 s,94℃ 5 s,56℃ 30 s,72℃ 20 s,45个循环。
1.4 ENO1基因过表达对颗粒细胞糖酵解的影响分别收集各组颗粒细胞和培养液,采用葡萄糖测试盒(上海荣盛生物药业有限公司)按说明书要求检测细胞培养液葡萄糖浓度;采用丙酮酸测试盒、乳酸测试盒和ATP含量测试盒(南京建成生物工程研究所)说明书检测培养液丙酮酸、乳酸含量及细胞ATP含量;采用实时荧光定量PCR(试剂购自大连宝生物)对丙酮酸激酶(pyruvate kinase,PK)mRNA表达量进行检测。PK基因引物序列:F:5′-GAACTGCGATGAGAATGTGC-3′;R:5′-ACCAGCAAGGAAATGAGACC-3′,引物由上海生工合成;条件同ENO1 mRNA定量。
1.5 细胞增殖、凋亡及细胞周期检测方法本试验采用WST-1(水溶性四唑盐试剂)法(碧云天生物技术研究所)测定细胞生长曲线;AnnexinV-PE细胞凋亡检测试剂盒(Elabscience)(碧云天生物技术研究所)检测细胞凋亡率;PI单染法(美国BD Biosciences公司)检测细胞周期。
1.6 统计学分析本试验采用Graphpad 7.0软件进行数据处理,用ANOVA进行单因素方差分析显著性,P<0.05为差异显著;P<0.01为差异极显著。
2 结果
2.1 ENO1 mRNA表达量检测ENO1过表达组基因表达量极显著高于空载体组和对照组(P<0.01),空载体组与对照组表达量无显著差异(P>0.05),结果见图1。
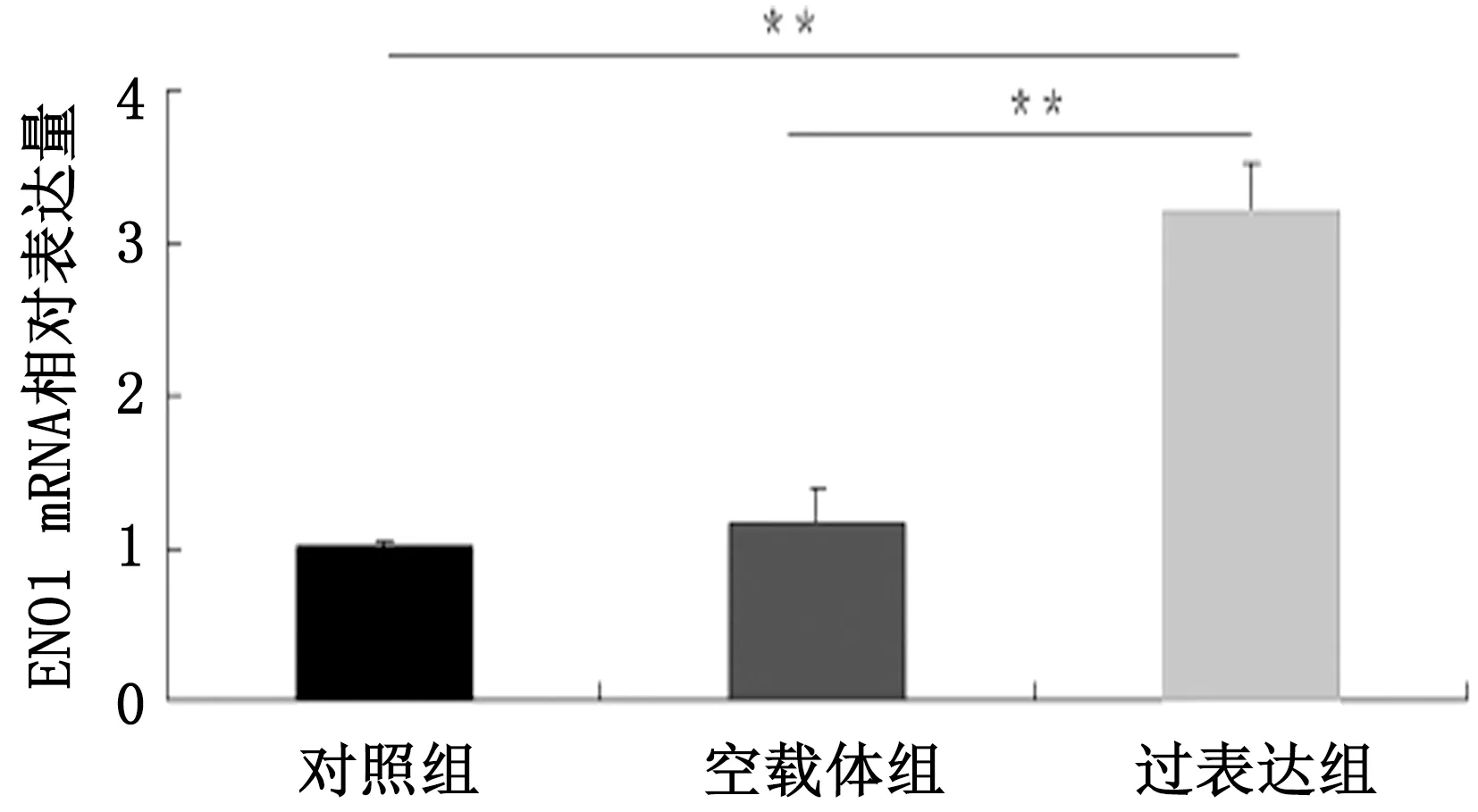
*P<0.05;**P<0.01。下同
2.2 颗粒细胞生长曲线细胞培养96 h前各组细胞数量无显著性差异。从120 h开始,各组细胞均呈对数生长,但过表达组细胞数量明显高于空载体组与对照组(P<0.05),具有更快的生长速度,结果见图2。
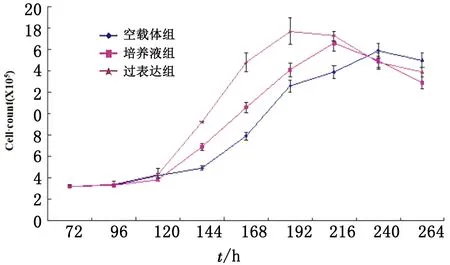
图2 各组细胞生长曲线
2.3 颗粒细胞糖酵解相关指标检测ENO1过表达组细胞培养液葡萄糖(glucose)含量显著低于其他2组(P<0.05),丙酮酸(pyruvic acid)(P<0.05)和乳酸(lactic acid)(P<0.05)含量显著高于其他2组;细胞ATP含量极显著高于空载体组(P<0.05);PK mRNA ( PKM ) 表达量极显著高于其他2组(P<0.01),结果见图3。
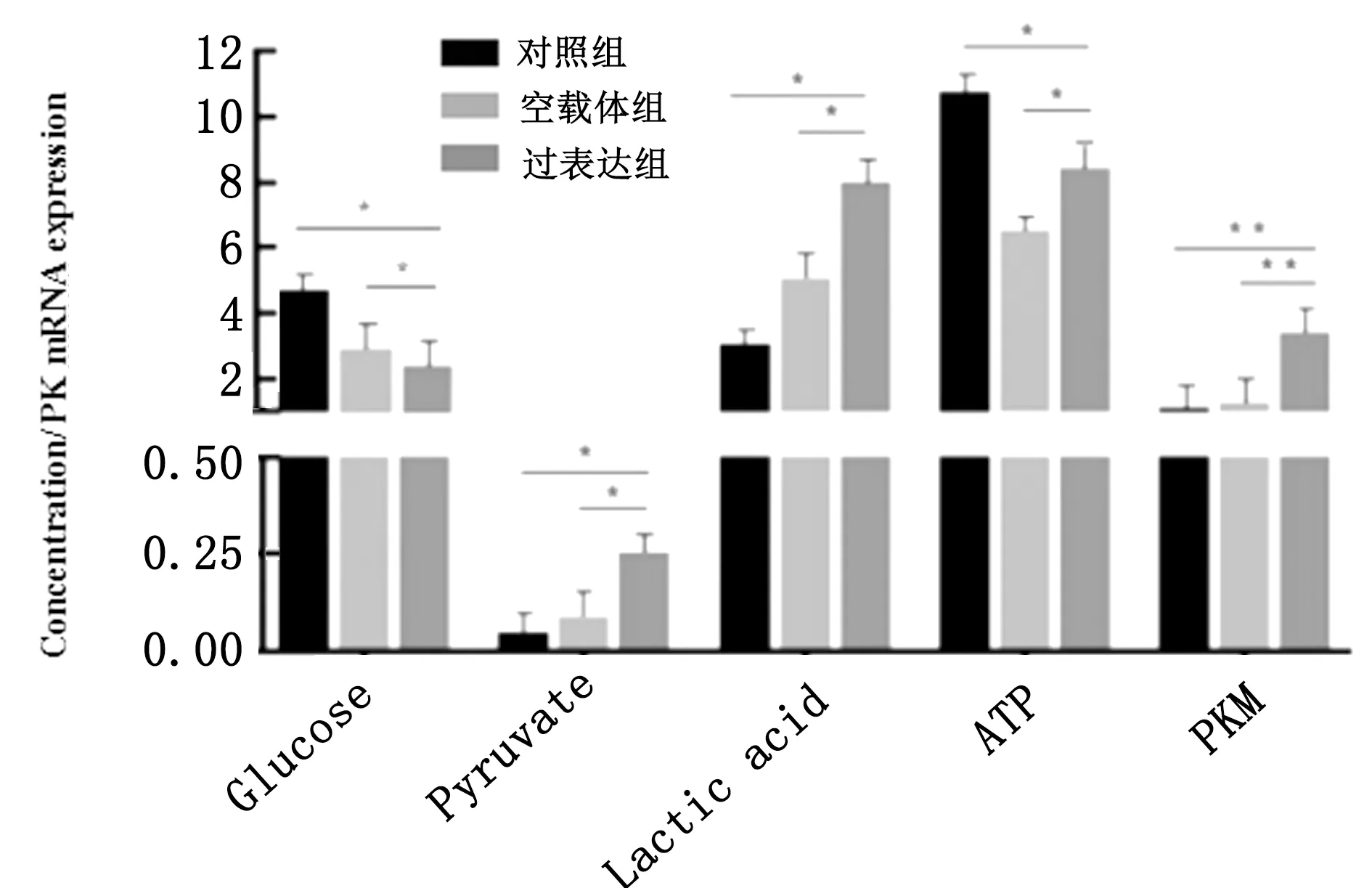
Glucose、 Lactic acid浓度单位:mmol/L;Pyruvic acid、ATP浓度单位:μmol/L;PKM为丙酮酸激酶mRNA相对表达量
2.4 颗粒细胞凋亡检测结果流式细胞检测结果显示,ENO1过表达组G-mean值低于空载体组(P<0.01),但高于对照组(P<0.05),结果见图4,5。
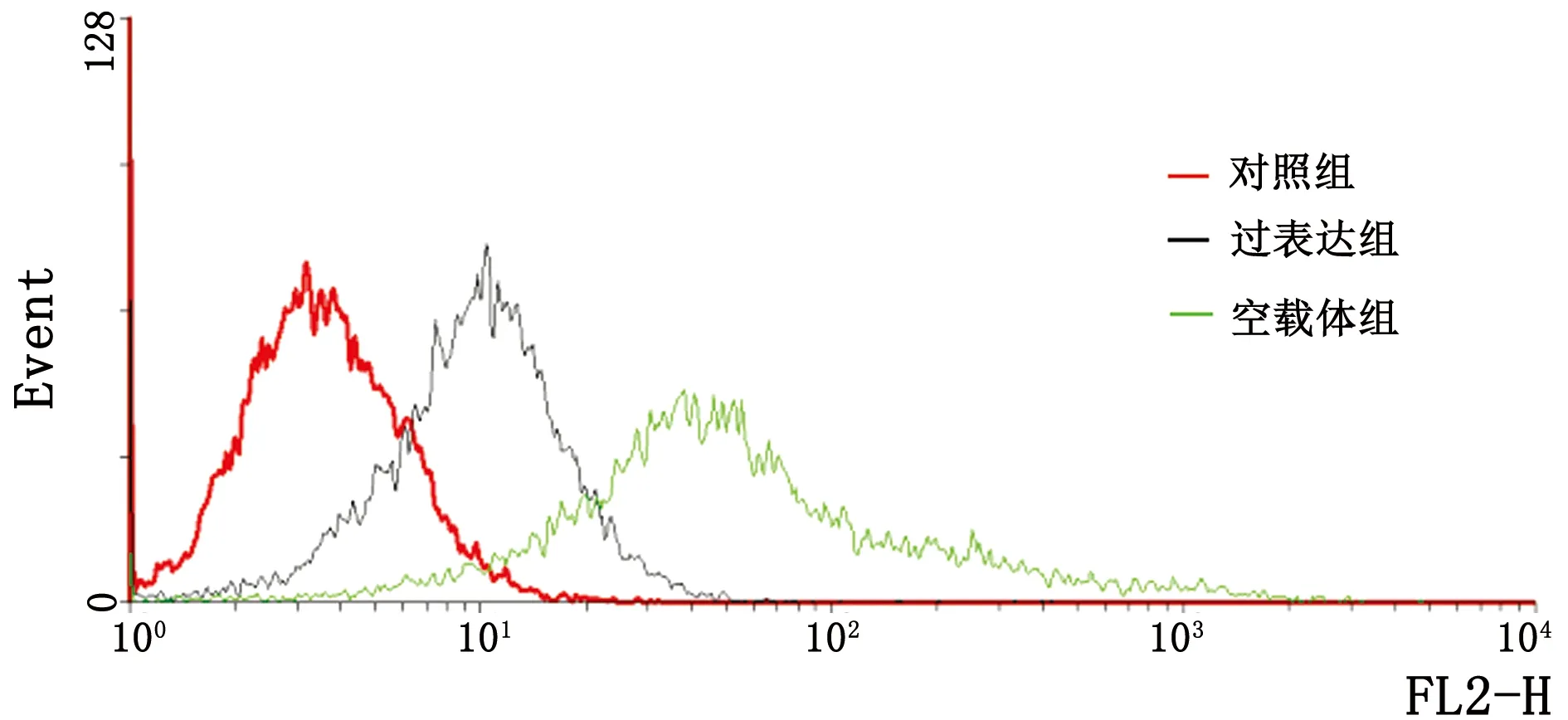
图4 各组颗粒细胞凋亡检测
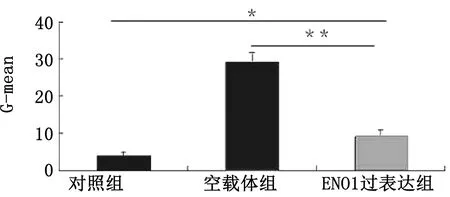
图5 各组颗粒细胞凋亡分析
2.5 颗粒细胞细胞周期检测结果细胞周期分析结果显示,ENO1过表达组G0/G1时期细胞百分比极显著低于其他2组(P<0.01),但S期、G2/M期细胞百分比显著高于其他2组(P<0.05),结果见图6。
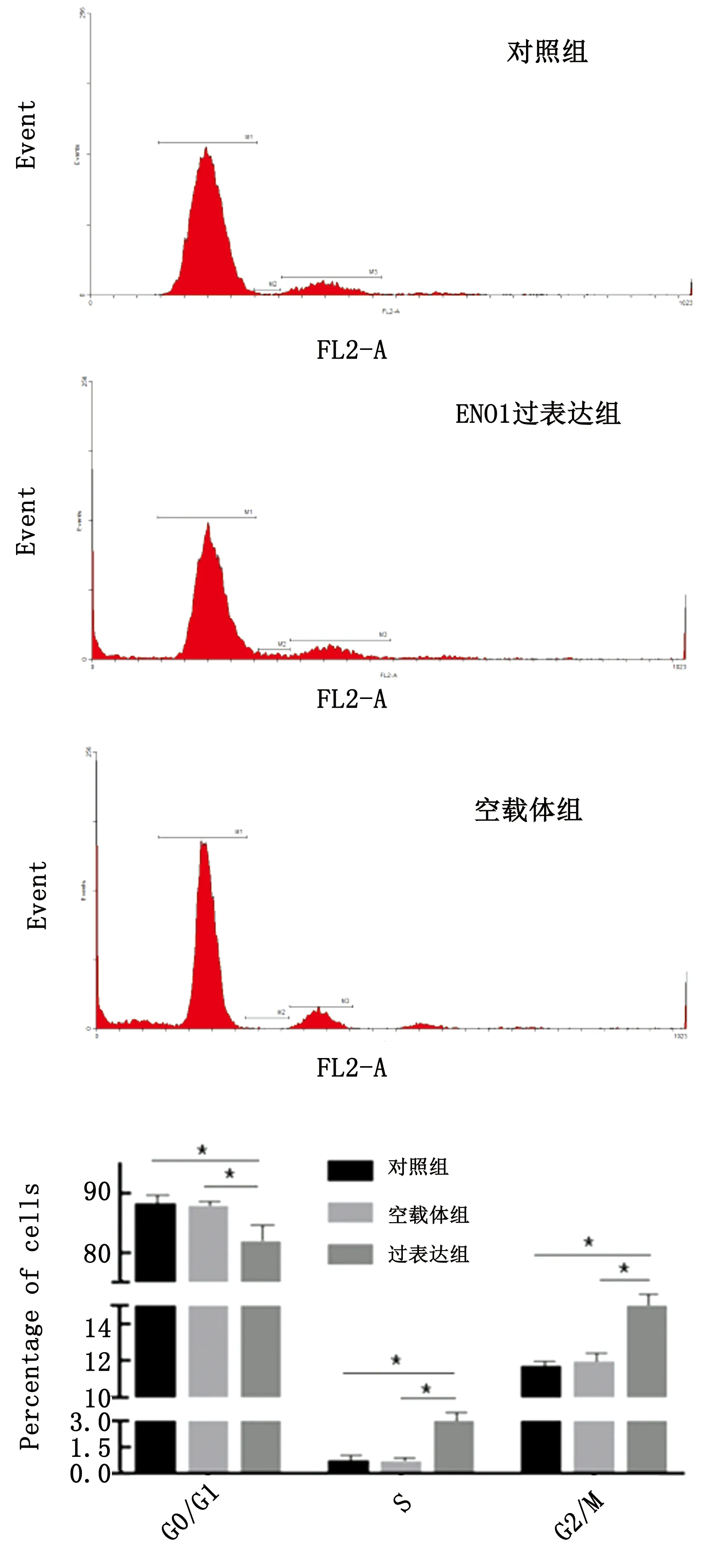
图6 各组颗粒细胞周期结果分析
3 讨论
ENO1是糖类代谢中的关键酶之一,在细胞新陈代谢中具有重要作用。多个研究发现,ENO1的表达与癌症有着密切关系。有研究发现ENO1在胃癌干细胞中高表达,提示其在调控胃癌侵袭转移能力中发挥重要作用[7]。王磊等[8]研究发现,ENO1在胰腺导管腺癌的表达显著增高,提示其在胰腺上皮的癌变过程中可能发挥重要作用。而通过蛋白质组学确定的8种肺癌生物标志物候选物中,ENO1在癌症患者中的表达水平高于无癌症个体[9],这也进一步证实了ENO1的表达与癌症发生息息相关。肿瘤细胞最主要的特征之一是细胞增殖迅速,凋亡率极低,这与禽类卵泡的生长速度相近。作为生长最快的正常组织,卵泡发育需要消耗大量的能量和反应底物。本实验室前期研究发现,禽类产蛋期卵泡ENO1基因表达量明显升高[10],提示ENO1可能在禽类卵泡生长过程中发挥重要作用。
本试验显示,ENO1基因的过表达使细胞培养液中葡萄糖浓度降低,丙酮酸、乳酸含量升高(P<0.05);细胞ATP含量和PK mRNA表达量显著升高(P<0.05),细胞增殖速度加快,凋亡率降低,提示ENO1基因过表达可能通过增强对颗粒细胞糖酵解能力调控其生长发育与凋亡。陈晓亮[11]研究表明,ENO1基因过表达可以促进肿瘤细胞的迁移与侵袭,并能拮抗人颗粒体蛋白A对肿瘤细胞凋亡、迁移与侵袭及葡萄糖摄取功能的影响。SUN等[12]发现ENO1的敲减减弱了胃癌细胞的增殖和转移,而ENO1过表达则相反,且ENO1通过AKT信号通路增强胃癌细胞增殖和转移。也有研究表明,ENO1的过表达使Hela细胞免受Mycoepoxydiene诱导的生长抑制[13]。罗起胜等[14]发现,ENO1在胶质瘤中通过正向调控糖代谢相关基因因HK2和LDHA表达,从而促进了胶质瘤细胞的生长。上述结果与本试验结果一致,提示ENO1通过控制糖酵解来调控细胞凋亡,使细胞凋亡率显著降低。但KANG等[15]研究显示,ENO1可能在卵泡发育介导细胞凋亡,其研究结果与本试验有所不同,其具体机制仍有待研究。
本试验发现,ENO1过表达可使G0/G1期颗粒细胞比例下降,提示其可通过作用于细胞的DNA合成来调控细胞的增殖和凋亡。有研究证实ENO1表达上调可显著抑制肿瘤细胞的体外侵袭和黏附能力,其抑制作用可能与调节细胞周期和侵袭相关基因表达有关[15]。资料显示,稳定上调的ENO1激活了FAK/ PI3K/ AKT及其下游信号,以调节糖酵解,细胞周期和EMT相关基因表达,显著提高体外非小细胞肺癌细胞糖酵解、增殖、克隆形成、迁移和侵袭、以及体内肿瘤发生和转移[16]。这与本试验结果也一致,提示ENO1对颗粒细胞周期进程的稳定具有重要作用,但其具体调节机制还有待进一步研究。
综上所述,ENO1基因过表达可能通过提高卵泡颗粒细胞糖酵解水平促进细胞增殖,抑制凋亡,改变细胞周期时相性。

