朝藿定A对原代骨髓间充质干细胞向成骨细胞分化的作用
刘 颖,柴丽娟,黄菊阳,王 琴,宋 蕾,周 昆*,李云章*
(1.内蒙古农业大学 兽医学院,内蒙古 呼和浩特 010018;2.天津中医药大学 中医药研究院 天津市中药药理重点实验室,天津 300193)
淫羊藿是中国传统中药,《本草纲目》中记载其功效为益精气,坚筋骨,补腰膝等,研究显示淫羊藿可显著改善骨代谢[1],淫羊藿提取物可以减少卵巢切除或老化大鼠模型的骨质流失,但其作用机制仍不清楚[2]。淫羊藿中朝藿定A、淫羊藿苷、宝藿苷Ⅰ、朝藿定B、朝藿定C等黄酮类成分含量较高并具有较强生理活性[3]。BMSCs是一种源自中胚层的干细胞,能够在骨髓和各种器官的血管周围进行自我更新和多向分化,并在骨骼、皮肤、肝脏和肌肉等组织的再生中发挥重要作用。它可以在体外分化为成骨细胞、软骨细胞和脂肪细胞。BMSCs由于其自我更新和多向分化以及易于获取而广泛用于细胞治疗和组织工程中。BMSCs的数量保持在较高水平可以减缓骨质疏松的病程,将BMSCs移植到受损部位,分化为成骨细胞可以直接逆转骨质流失。因此,BMSCs细胞移植是治疗骨质疏松的重要手段,但其疗效的确定性和稳定性引起极大争议,因此药物干预BMSCs治疗骨质疏松已成为一个热门的研究课题。本研究旨在研究淫羊藿提取物朝藿定A对原代BMSCs向成骨细胞的分化能力,以探讨淫羊藿对改善骨质代谢的机制。
1 材料与方法
1.1 实验动物6~8周雌性 C57BL/6J 小鼠,SPF级,购自北京华阜康生物科技股份有限公司。许可证编号:SCXK(京)2016-0004。动物饲养于天津中医药大学实验动物房。
1.2 主要试剂α-MEM培养基、胎牛血清 (fetal bovine serum,FBS)、青链霉素混合液、trypsin-0.25%EDTA(Gibco);碱性磷酸酶(alkaline phosphatase,ALP)&抗酒石酸酸性磷酸酶(tartrateresistantacidphosphatase,TRACP)检测试剂盒(Takara);MSCgoTM间质干细胞成脂诱导分化培养基(BI);朝藿定A(成都普菲德);磷酸缓冲盐溶液(phosphate buffer saline,PBS)、10%氯化十六烷基吡啶、0.1%茜素红-Tris-Hcl(PH 8.3)(索莱宝);二甲基亚砜(Amresco);ALP染色试剂盒(南京建成);β甘油磷酸钠、维生素C(Vc)、雌二醇(E2)和地塞米松(Sigma)。
1.3 主要仪器多功能读板机(Felex station 3,MD,美国);超声破碎仪(VCX 130,Sonics,美国);倒置荧光显微镜(TE300,Nikon,日本);超净工作台(苏净安泰,中国);CO2培养箱(Thermo,美国);小型台式离心机(Beckman,美国);台式冷冻离心机(Beckman,美国);气浴摇床(Stuart,S1500,英国);天平(Sartorius,德国)。
1.4 BMSCs的分离与培养拉颈法处死小鼠,于75%酒精中浸泡消毒5 min,在超净台分离小鼠后肢长骨,去除骨表面软组织和骨骺,置入盛有PBS(1%双抗)的玻璃皿中。用针筒吸取完全培养基(90%α-MEM,10%FBS,1%青链霉素,简称全培),反复冲洗骨髓腔和骨内表面,直至骨壁变白。骨髓悬液用70 μm细胞筛过滤,将过滤后的细胞悬液均匀接种至25 cm2培养瓶中,CO2培养箱37℃,5%CO2培养。72 h后弃去未贴壁细胞和培养基,换成新鲜全培,此后每周换液2~3次,至细胞铺满90%后传代。
传代方法:弃上清,用PBS清洗细胞,加入1 mL trypsin-0.25% EDTA,室温放置1 min,显微镜下观察细胞出现皱缩脱落时,加入全培终止消化,用1 mL 移液器吹打细胞,至细胞脱壁,收集细胞悬液至50 mL离心管,1 000 r/min,4℃离心5 min。弃上清用适量全培重悬细胞,以1∶2或1∶3进行传代。BMSCs传至第3代,调节细胞浓度至5×105个/mL,将细胞悬液接种到96孔板,待细胞长满。
1.5 成骨细胞的诱导分化及检测空白对照Con1继续用全培培养,其他组换成成骨诱导培养基(含β-甘油磷酸钠10 mmol/L,Vc 0.05 mmol/L和地塞米松100 nmol/L的全培)继续培养。设朝藿定A给药浓度分别为0.01,0.1和1 μmol/L(记为AL、AM、AH);阳性对照给予雌二醇(Estradiol,E2),浓度为1 μmol/L;对照Con2给予0.1%DMSO。培养3 d后,对细胞进行ALP染色;上述方法培养7 d后吸取50 μL细胞上清液,检测OPG、RANKL 水平;上述方法培养10 d后,对细胞进行矿化染色,拍照后,溶解矿化结节,测D562 nm值。以上3组检测所用细胞来自不同批次分离的BMSCs。
1.6 成脂细胞的诱导分化BMSCs传至第3代,细胞长满后将培养基吸除,每孔加入0.5mL含药成脂诱导分化培养基,朝藿定A给药浓度分别为0.01,0.1和1 μmol/L (记为AL、AM、AH);阳性对照给予E2,浓度为1 μmol/L;对照Con2给予0.1%DMSO,置于37℃、5%CO2培养箱中培养,每3~4 d换液,直至观测到成熟脂肪细胞(即脂滴的形成),约10 d。将脂肪细胞用油红O染色,溶解后测D500 nm值。
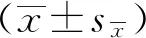
2 结果
2.1 朝藿定A对BMSCs诱导分化形成成骨细胞的影响
2.1.1朝藿定A对BMSCs ALP表达的影响 结果见图1。细胞中的ALP被染成褐色。与Con1相比,成骨诱导后的Con2分泌了更多ALP;与Con2组相比,各给药组ALP表达均有增多。

A.Con1;B.Con2;C.E2;D.AL;E.AM;F.AH
2.1.2朝藿定A对BMSCs 分化形成矿化结节的影响 结果见图2。细胞培养板中的矿化结节被染成红色。与Con1相比,成骨诱导后的Con2没有形成更多矿化结节;与Con2组相比,各给药组矿化结节均显著增多(P<0.05,P<0.01)。

图2 朝藿定A对BMSCs 分化形成的成骨细胞矿化结节的影响
2.1.3朝藿定A对BMSCs分化成骨细胞上清中OPG/RANKL的影响 结果见图3。给予E2和0.01 μmol/L 朝藿定A时,上清中OPG水平显著升高(P<0.05),其他给药组也有上升趋势;给予E2和0.1 nmol/L朝藿定A时,RANKL水平呈上升趋势;而给予1,100 μmol/L朝藿定A时,RANKL水平呈下降趋势。从OPG/RANKL的结果来看,给予E2和0.1 nmol/L朝藿定A时OPG/RANKL值较对照组显著升高,而其他剂量组也有上升趋势。

图3 朝藿定A对BMSCs细胞上清中OPG/RANKL的影响
2.2 朝藿定A对BMSCs诱导分化形成成脂细胞的影响结果见图4。细胞培养板中的脂肪滴被染成红色。与Con相比,朝藿定A低剂量(0.01 μmol/L)组成脂分化的程度没有明显变化;朝藿定A高剂量(1 μmol/L)组成脂分化较对照组显著降低(P<0.05)。
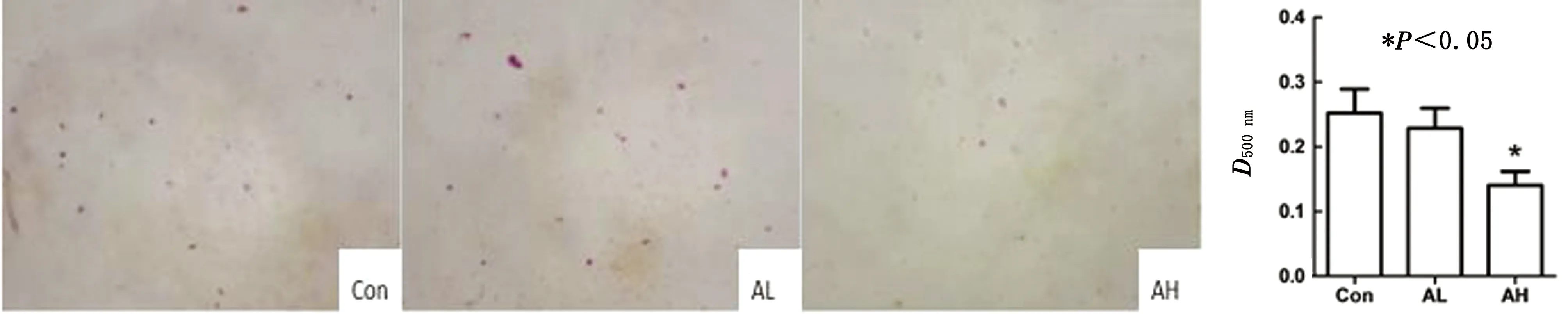
图4 朝藿定A对BMSCs 分化形成脂肪细胞的影响
3 讨论
成骨细胞和骨细胞源于间充质干细胞,间充质干细胞是一种多能细胞,最先从骨髓中发现,有分化为成骨细胞、脂肪细胞、肌细胞、神经细胞和软骨细胞的潜能。成骨细胞被钙化的骨胶原基质包围。这些细胞呈树突状伸展,可以与破骨细胞和骨细胞更灵活地联系起来。体外培养的BMSCs经过诱导可分化为成骨细胞,采用BMSCs定向成骨分化是愈合困难的骨折修复的主要方法,BMSCs作为骨组织工程重要的种子细胞来源[4-5],在临床上应用广泛。
訾慧等[6]采用淫羊藿苷对BMSCs成骨性分化的影响研究发现,淫羊藿苷可以提高骨组织中的骨钙素,增加ALP的含量,促进 BMSCs的增殖和分化。本研究中,朝藿定A给药3 d后,发现成骨诱导后的Con2分泌了更多ALP,证实朝藿定A对BMSCs的成骨分化有促进作用。在朝藿定A给药14 d 后,用茜素红染色法检测成骨细胞矿化结节的形成,发现各给药组矿化结节均显著增多,表明朝藿定A对BMSCs分化成的成骨细胞钙沉积有促进作用。朝藿定A给药10 d后,用油红O染色法检测BMSCs成脂分化程度。结果显示,朝藿定A低剂量组成脂分化的程度没有明显变化,而高剂量组成脂分化较对照组显著降低,可见朝藿定A对BMSCs成脂分化在1 μmol/L剂量下有一定的抑制作用。
RANKL可以与其受体,在破骨细胞和其前体上的成骨细胞表达核转录因子κB的受体活化剂相连[7]。骨细胞的凋亡促进成骨细胞表达RANKL,它与破骨细胞上的同源受体相连[8]。破骨细胞的主要作用是骨吸收,这些多核细胞来源于造血细胞系,通过单核祖细胞的融合形成,如单核细胞和骨髓巨噬细胞。RANKL与其受体的结合导致单核祖细胞分化融合成多核破骨细胞。破骨细胞的活力在常态和大部分病理情况下与骨吸收的增加有关。OPG是一种诱导肽,由成骨细胞和成骨基质干细胞分泌,通过清除RANKL来减少与核因子κB受体活化因子(receptor activator for nuclear factor-κ B,RANK)的结合,从而抑制过多的骨吸收[9]。因此,无论正常或疾病状态下,骨髓中的RANKL/OPG率是骨质量的重要决定因素[10]。
骨吸收的各种刺激因子可作用于成骨细胞或骨髓基质细胞,诱导成骨细胞上的RANKL表达,旁分泌OPG。RANKL和OPG与位于破骨细胞前体细胞膜上的RANK受体竞争性相互作用[11]。结合后,将相应的信号引入破骨细胞前体细胞中以促进破骨细胞分化,增强成熟破骨细胞的活力,并防止破骨细胞凋亡。骨组织微环境中OPG和RANKL表达的相对水平(OPG/RANKL)是决定破骨细胞形成和活性的关键[12]。如果OPG的表达水平高于RANKL,则破骨细胞受到抑制并且骨量增加;反之,破骨细胞形成活跃,导致骨量减少。OPG/ RANKL/RANK调节破骨细胞的分化和成熟,促进或抑制破骨细胞的凋亡,并调节骨代谢的稳态。该系统对于骨质疏松症等骨丢失相关疾病具有重要意义。
何丹丹等[13]发现,淫羊藿苷脱糖物淫羊藿素可以与RANKL靶点结合,从而抑制破骨细胞增殖。另外一项对淫羊藿苷的研究发现,淫羊藿苷可抑制RANKL与RANK的结合,上调OPG/RANKL比值,从而降低破骨细胞的增殖和分化,达到降低骨吸收的作用[14]。本研究中,通过细胞上清OPG和RANKL检测,发现给予E2和0.01 μmol/L朝藿定A时,上清中OPG水平显著升高,其他给药组也有上升趋势;给予E2和0.1 nmol/L朝藿定A时,RANKL水平呈上升趋势;而给予1,100 μmol/L朝藿定A时,RANKL水平呈下降趋势。从OPG/RANKL的结果来看,给予E2和0.1 nmol/L朝藿定A时OPG/RANKL值较对照组显著升高,而其他剂量组也有上升趋势。证明朝藿定A促进BMSCs向成骨细胞分化可能也是通过OPG/RANKL通路实现的。
综上所述,朝藿定A可以促进BMSCs细胞向成骨细胞分化并抑制其成脂分化,可以促进成骨细胞矿化并提高成骨细胞OPG/RANKL水平从而发挥骨保护作用。

