鸭源沙门菌三价油乳剂灭活疫苗的制备及免疫效果
张林吉,迟 兰,李心海,王玉燕,房 超,任士飞*
(1.徐州生物工程职业技术学院,江苏 徐州 221006;2.中华人民共和国徐州海关,江苏 徐州 221003)
鸭沙门菌病(duck Salmonellosis)又称为鸭副伤寒,是鸭的一种急、慢性传染病,主要由于鸭感染了一种或几种沙门菌而引起,病原菌主要包括肠炎沙门菌、鸭沙门菌和印第安纳沙门菌等[1-2]。鸭沙门菌病多发生于雏鸭,3周龄内雏鸭特别易感,感染后常呈现急性败血症,发病率和死亡率都很高[3]。成年鸭感染后不表现出明显临床症状,多呈现慢性或隐性感染,通过粪便长期排菌,但有时也会出现严重的临床疾病,并伴有高死亡率。
鸭沙门菌病的防治主要依赖于抗菌药物的使用,但随着沙门菌耐药性逐渐增强,加之大规模高密度集约化饲养管理造成机体免疫力降低,使得药物治疗的效果越来越差。沙门菌疫苗的研制已成此病防控技术研究的主要方向,研制出能够有效控制鸭沙门菌病的有效疫苗,将为今后有效控制沙门菌病提供重要的工具。
目前,我国针对沙门菌疫苗的研制主要以鸡和猪的沙门菌疫苗为主,而针对鸭的沙门菌疫苗较少。本研究根据徐州及周边地区鸭源沙门菌血清型分布情况,筛选出印第安纳沙门菌、阿贡纳沙门菌和鸭沙门菌3株不同血清型菌株,采用传统方法制备油乳灭活疫苗,评价制备疫苗的性状;对试验鸭进行免疫接种,从体液免疫和细胞免疫方面对免疫效果进行评价,为鸭源沙门菌疫苗的防控效果提供理论基础。
1 材料与方法
1.1 试验材料印第安纳沙门菌(S.indiana4∶z∶1,7)、阿贡纳沙门菌(S.agona4∶f,g,s)和鸭沙门菌(S.anatum10∶e,h∶1,6)3株鸭源沙门菌为徐州动物疫病检测中心分离鉴定并保存;胰蛋白胨和酵母浸粉购自OXOID公司;Hanks液、淋巴细胞分离液和赖氨酸等化学试剂购自南京智睿生物科技有限公司;0.5%绵羊红细胞悬液自备;沙门菌抗体ELISA检测试剂盒购自上海瓦兰生物科技有限公司;ANgni乳化机购自上海昂尼仪器仪表有限公司;1日龄樱桃谷肉鸭购自徐州佳合有限公司,隔离饲养于洁净动物舍。
1.2 疫苗制备
1.2.1菌液制备及灭活 将制备菌株接种到含有300 mL液体培养基的锥形瓶中,37℃培养18 h作为种子液,按4%比列接种到装有6 L灭菌的沙门菌合成液体培养基的发酵罐中。3种菌株的发酵条件基本一致,具体参数如下:38℃通气培养,搅拌速度为150 r/min;调节通气量使溶氧指数保持40%左右,培养过程中滴加赖氨酸溶液,保持溶液pH值为7.3~7.6;培养20 h收集菌液,进行血清学检测和杂菌检验,合格后,菌液离心浓缩,调整菌液浓度为120×106/mL,再加入终浓度为0.5%的甲醛灭活72 h,无菌检验后备用。
1.2.2疫苗乳化 灭活的混合抗原液(1∶1∶1)混合与灭菌Tween-80按照96∶4的比例混合制备成水相;白油与司本-80按照94∶6的比例混合,加入1%的硬脂酸铝,充分搅拌混匀,121℃高压灭菌30 min,为油相。水相和油相以1∶3的比例使用ANgni乳化机进行乳化,7 000 r/min高速匀浆2.5 min,间隔2 min,重复3次,即制备多价油乳剂灭活疫苗。
1.3 疫苗性状检验剂型检验:观察油乳剂灭活疫苗的外观,将疫苗滴入盛有室温蒸馏水的平皿表面,观察疫苗扩散情况。如呈规则圆形则为油包水剂型,若迅速散开则为水包油剂型。稳定性检验:取油乳剂灭活疫苗10 mL,3 000 r/min离心15 min,观察其是否出现分层、破乳等现象。黏度测定:用上口径为2.7 mm,下口径为1.2 mm的玻璃吸管,记录在室温(25℃)下吸满1 mL油乳剂灭活疫苗垂直流出0.4 mL所需的时间,重复3次取平均值。
1.4 无菌检验按照《中华人民共和国兽药典》的方法[4],将油乳剂灭活疫苗分别接种于硫乙醇酸盐培养基、酪胨琼脂培养基和葡萄糖蛋白胨培养基,分别置于25℃培养7 d和37℃培养24 h,观察有无微生物生长。同时,将疫苗接种到改良的Frey固体培养基上,37℃培养1个月,观察有无支原体生长。
1.5 安全性检验取10日龄樱桃谷雏鸭30只,每组15只,注射油乳剂灭活疫苗1 mL,一组做肌肉注射,另一组做皮下注射;另取10只不接种疫苗作为空白对照。接种之日起,观察接种雏鸭的生长情况,接种14 d时,剖检全部接种实验鸭,检查接种部位和全身脏器变化,以评价其安全性。
1.6 免疫效力检测
1.6.1抗体水平和细胞免疫检测 将65只10日龄樱桃谷肉鸭分为3组,分别为空白对照组,15只,每只肌肉注射0.5 mL生理盐水;免疫1组,25只,每只肌肉注射油乳剂灭活疫苗0.5 mL;免疫2组,25只,肌肉注射疫苗0.5 mL,7 d后,同样剂量进行二次免疫接种。抗体水平检测:首免疫后0,7,14,21,28,35,42,49 d采血分离血清,每组每批采10份样品,用沙门菌抗体ELISA检测试剂盒检测血清中免疫抗体水平[5]。细胞免疫检测:首免疫后,每间隔7 d采血分离鸭淋巴细胞,利用E玫瑰花环形成试验测定不同时间鸭T淋巴细胞数量,检测7周,具体操作参照文献[6]。
1.6.2攻毒保护试验 200只樱桃谷肉鸭随机分为空白对照组、攻毒组和免疫攻毒组,10日龄时,空白对照组和攻毒组每只肌肉注射生理盐水0.5 mL,免疫攻毒组每只肌肉注射灭活疫苗0.5 mL;7 d后,攻毒组和免疫攻毒组进行攻毒,肌肉注射攻毒菌株,具体分组及攻毒情况见表1。攻毒后观察记录各组动物发病及死亡情况,观察21 d,统计死亡率及存活率。
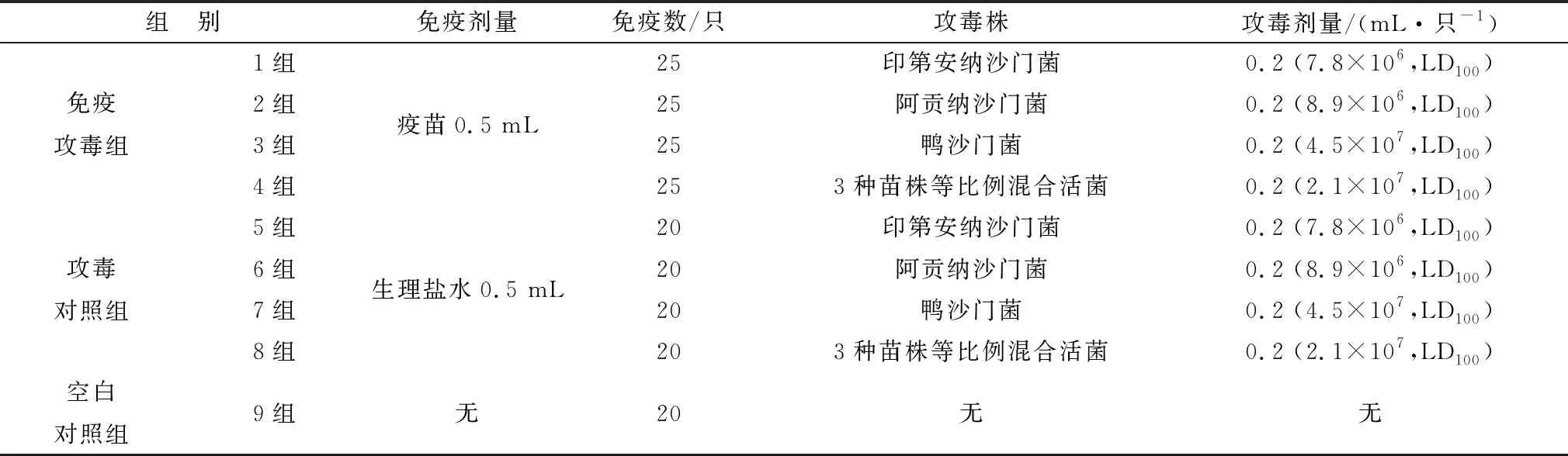
表1 分组免疫及攻毒情况

2 结果
2.1 性状检验制备的油乳剂灭活疫苗为白色乳液,镜检质地均一,无颗粒状杂质,漂浮于蒸馏水表面,呈规则圆形,边缘圆滑规整,表明该制剂为油包水剂型。疫苗经3 000 r/min离心15 min后,没有出现分层、破乳现象,疫苗稳定性良好。疫苗自然垂直流出0.4 mL的平均时间为4.83 s (4.7,5.1,4.6 s),符合油乳剂灭活疫苗的黏度要求(2~8 s)。
2.2 无菌检验将油乳剂灭活疫苗接种到各培养基,经培养后无细菌、霉菌及支原体等微生物生长,疫苗无菌检验合格。
2.3 安全性检验疫苗接种当日,接种雏鸭表现出轻微的临床症状,与对照组相比,采食量减少了30%左右,饮水减少了10%~15%,运动量明显减少,喜卧,至接种后2 d,皮下和肌肉接种组的实验鸭精神饮食逐渐恢复正常。第14天剖杀,皮下注射组实验鸭注射部位残存少量未吸收的疫苗液体,肌肉注射组疫苗吸收良好,未见残留。观察期内3组实验鸭全部健康存活,无明显临床症状。
2.4 免疫效力检测
2.4.1抗体水平检测结果 由图1可见,免疫后7 d,免疫组抗体水平逐渐升高,免疫1组和免疫2组分别于免疫后21,35 d抗体水平达到峰值,然后开始缓慢降低。免疫后1周,免疫1组与空白对照组的抗体水平存在统计学差异(P≤0.05),21 d为极显著性统计学差异(P≤0.01),35 d后2组之间的抗体水平未见统计学差异;免疫后7~14 d,免疫2组与空白对照组的抗体水平存在统计学差异(P≤0.05),至免疫后49 d时依然维持在较高水平,抗体水平存在极显著性统计学差异(P≤0.01)。
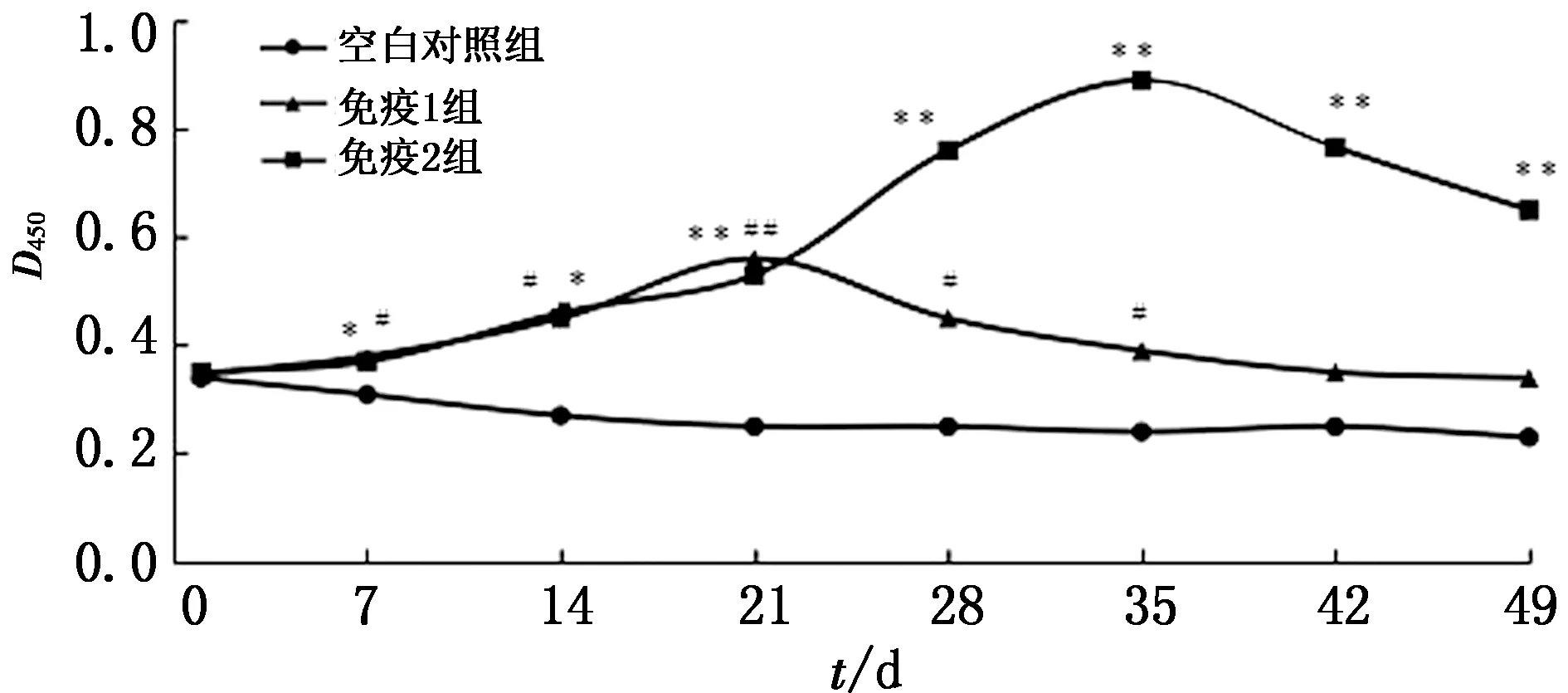
空白对照组与免疫1组比较,#P≤0.05,##P≤0.01;空白对照组与免疫2组比较,*P≤0.05,**P≤0.01。下同
2.4.2E玫瑰花环检测结果 E玫瑰花环形成试验检测T淋巴细胞结果显示,免疫后7 d,免疫1组和免疫2组的E玫瑰花环形成率开始高于空白对照组,统计学差异(P≤0.05), 14~49 d有极显著性统计学差异(P≤0.01),具体结果见表2。
表2 E玫瑰花环形成率检测结果 %
2.4.3攻毒保护试验结果 观察雏鸭临床表现,攻毒组和免疫攻毒组的雏鸭在攻毒后24 h左右出现食欲降低、惧寒扎堆和嗜睡等临床表现,36 h开始陆续出现死亡。空白对照组未见临床症状,无死亡;攻毒5,6,8组于攻毒后第1周内全部死亡,攻毒7组死亡19只,存活1只;免疫攻毒1组和4组都死亡3只,存活22只,免疫攻毒2组死亡2只,存活23只,免疫攻毒3组全部存活,具体各组的死亡率和存活率结果见表3。

表3 免疫攻毒试验结果
3 讨论
由于沙门菌血清型多达2 500多种,很难确定作为标准的沙门菌疫苗菌株,因此根据不同地区流行的沙门菌株,研制成灭活疫苗是有效预防沙门菌病的重要技术关键,通常可以收到良好的预防效果[7]。本试验结果显示,通过对鸭沙门菌多价灭活疫苗的各项检验,证明疫苗无菌检验、物理性状等指标符合要求。
疫苗的免疫效果通常包括抗体免疫水平和细胞免疫水平。本研究通过检测血清中抗体水平的变化规律来反应抗体免疫水平,检测结果显示空白对照组的雏鸭在10日龄免疫时依然保持一定的母源抗体水平,随日龄增长其母源抗体逐渐下降,这与金大春等[8]研究结果基本相符合,因此在制定免疫程序时要考虑母源抗体对免疫效果的影响。免疫1组在免疫后的21 d达到最高水平,之后开始缓慢降低,在免疫后的35 d与空白对照组没有统计学差异;免疫2组在间隔7 d后进行二次免疫,在35 d到达最高,其抗体水平远远高于免疫1组,免疫后7周,抗体水平依然高于免疫1组的最高水平,与空白对照组依然有显著性统计学差异。结果显示,疫苗免疫可以刺激雏鸭产生体液免疫反应,二次免疫抗体水平要远高于一次免疫,推测可能是由于母源抗体的作用导致一次免疫效果的降低。
外周血T淋巴细胞在疫苗抗原的刺激下,可以提高其自身的活性,免疫1组和免疫2组的E玫瑰花环形成率明显高于空白对照组,2个免疫组之间没有明显的统计学差异。结果表明,疫苗免疫可以提高鸭外周T淋巴细胞的数量,增强雏鸭的细胞免疫水平。
沙门菌灭活疫苗的免疫效果不如减毒或无毒载体等口服活疫苗,但是由于沙门菌的毒力因子很多,减毒疫苗是否会发生毒力恢复或返强,其安全性还有待进一步研究证实[9-10]。由于徐州及周边地区,近年来从病鸭分离的沙门菌主要为印第安纳沙门菌、阿贡纳沙门菌和鸭沙门菌3种鸭源沙门菌,所以本研究以3种菌株制备多价灭活疫苗,研究结果表明,多价灭活疫苗可以对强毒株攻菌获得很高的存活率,对鸭沙门菌攻毒保护率可以达到100%,对阿贡纳沙门菌攻毒保护率为90%,对印第安纳沙门菌及3种混合菌株的攻毒保护率可以达到87%,证明该疫苗具有实质性的免疫预防作用,这些研究结果与国内一些研究结果是一致的[11-13]。但是,动物保护试验结果显示存活率还有待进一步地提高,尤其是对毒性较强印第安纳沙门菌和多种联合菌株的攻毒感染,因此制定合理的免疫程序和联合免疫,以及攻毒后的联合防制是下一步研究的重点工作。
本研究以徐州地区主要流行的鸭源沙门菌制备油乳灭活疫苗,其各项指标达到要求,且安全可靠。外周血抗体检测结果显示二次免疫优于单次免疫,二免抗体水平逐渐持续上升,远高于单次免疫,并在较长时间内维持平稳的抗体水平;疫苗免疫可以刺激雏鸭产生一定程度的细胞免疫反应,多价灭活疫苗可以有效保护鸭源沙门菌单菌株或多个混合菌株对雏鸭的感染,对动物的保护率可以达到87%~100%。

