利用浊度法快速测定磷酸三钠对两种采后病原真菌的MIC及NIC值
刘瑶瑶 ,孙杨莹,陈远志,罗 锦,赵子嘉 ,周 婷
(1. 杭州师范大学生命与环境科学学院农产品质量安全控制技术研究杭州市重点实验室,浙江 杭州 311121; 2. 杭州师范大学生命与环境科学学院植物RNA信号传导中心,浙江 杭州 311121)
0 引言
水果产业包括种植、采摘、加工、贮藏、运输、销售等多个环节.我国对产前栽培管理阶段重视程度较高,但水果含水量高、容易腐烂,且成熟期相对集中,生产地多远离销售地,因此对贮藏条件和运输周期有较高要求.目前,我国水果贮存能力仅占总产量的20%,且大多为简易贮藏,70%以上鲜果几乎不经过任何加工即进入市场流通环节.由于采后管理不善、包装处理不当以及缺乏完整的冷链运输销售系统,新鲜水果的采后损失率高达20%~25%.鲜果在采后流通过程中造成经济损失的主要原因可归纳为以下几种:生理(果蔬自身生理衰败)、病理(病原微生物致腐)、物理(机械损伤、环境参数不适)以及多因素协同作用,但最终直观损失大多为病理性腐烂损失.真菌是鲜果最主要的致腐性病原菌,在100万种真菌中,大约有10%可导致采后病害.很多果实在采前就已被这些病害侵染,在贮藏或运输期间发病,并通过水、空气和土壤等媒介进行传播,进而造成更大的损失.导致水果病害发生的主要病原真菌包括引起柑橘、苹果腐烂的青霉菌(Penicilliumsp.),引起梨、苹果黑腐病的链格孢菌(Alternariasp.),引起草莓和葡萄灰霉病的葡萄孢菌(Botrytissp.),引起木瓜、芒果、香蕉炭疽病的炭疽菌(Colletotrichumsp.)以及番茄褐腐病的疫霉菌(Phytophtharasp.)等[1].
其中,Penicilliumexpansum俗称扩展青霉,是半知菌的一种,也是最重要的采后病害之一.P.expansum孢子的抗逆性强,耐低温,能够长时间保持活性,一旦环境适宜,就能够通过各种途径进行扩散,通过机械损伤、坏死组织、昆虫伤害、开放性花萼管甚至皮孔对宿主进行侵染,侵染处组织出现软化、水化,并可观察到明显的白色菌丝及大量的蓝绿色孢子,同时产生强烈的土腥味.P.expansum的宿主包括梨、苹果、枇杷、山楂、桃、葡萄、樱桃、番茄、柑橘、冬枣等多种水果[2],几乎涵盖浙江省水果主要栽培品种.此外,P.expansum还能分泌对人体具有致癌、致畸作用的真菌毒素patulin,阻碍果实衍生产品后续加工[3],严重危害我国水果产业的健康发展.链格孢霉(Alternariaalternata)在自然界中极为常见,包括分布于土壤污水中的腐生菌、动植物的内生菌、植物的病原菌以及人和动物的条件致病菌.A.alternata可侵染多种农作物,引起的病害可造成严重的经济损失[4].苹果生产过程中易受到多种病害的危害,A.alternata是其中最主要的一种,能侵染苹果叶片引起叶片黑斑病和落叶病,同时在苹果植株中定殖,在花期侵染花朵从而导致后期果实患霉心病,在田间和储藏期都可引起严重的经济损失.A.alternata还会产生寄主选择性毒素,不仅引发植物病害,对人体及动物的健康也造成一定危害,具有致畸、致癌、致突变等作用[4].
目前,上述两种采后病原菌的防治主要包括人工合成杀菌剂、天然抑菌物质、生物防治等.人工合成杀菌剂是控制上述两种采后病原菌最主要的方法,但过量使用会污染环境并导致抗性菌株产生[5-7],因此寻找低毒、高效、环保的杀菌剂替代品尤为迫切.近年来,“公认安全化合物”(GRAS)及天然植物成分因具有良好的抑制真菌作用而被广泛关注.磷酸盐就是众多成员中的一种,其中磷酸三钠(trisodium phosphate,TSP)还具有杀菌作用.磷作为人类日常需要摄入的基础营养物质,其电离产生的Na+和PO3-也是生物体的组成成分,正常情况下并不会对人体健康造成不利影响.随着对果蔬防治的日益重视,许多能够用于果蔬采后病害的化学物质慢慢被人们认知.TSP被证明对农作物具有增产抗病功效,是一种新型环保的化学制剂.在我国,西红柿、辣椒、黄瓜、大白菜等蔬菜种子浸种后,再用10%TSP溶液浸泡10~30 min,最后清水洗净后催芽播种,可杀死种子表面或内部的病原菌,减轻作物花叶病毒病.日本也采用以10%TSP溶液浸泡番茄、西瓜、葫芦等种子10~25 min的消毒方法来防治蔬菜病毒性病害.因此,在实际应用中,TSP被认为是安全的、环境友好的食品添加剂.虽然目前TSP在国内外已经广泛应用到植物病虫害防治及植物营养领域,但国内相关研究较为落后,其量化模型还有待完善,市场上也缺乏相关产品[8].
本文在明确TSP对P.expansum及A.alternata具有抑制作用的基础上,通过浊度法测定TSP处理后两种病原真菌的生长速度、孢子萌发时间,并结合Gompertz模型分别计算TSP对两种真菌的最小抑菌浓度(minimum inhibitory concentration,MIC)和非抑菌浓度(non-inhibitory concentration,NIC)值.该方法有潜力应用于快速测定不同抑菌物质对不同病原真菌的MIC及NIC值,有助于进一步评估食品保质期,从而确保食品质量安全以及消费者健康.
1 材料与方法
1.1 实验材料
实验所用病原菌Penicilliumexpansum与Alternariaalternata分离自自然发病的苹果(MalusdomesticaBorkh. cv. Red Fuji),已经过形态学观察及rDNA-ITS法鉴定,保存于杭州师范大学生命与环境科学学院食品生物化学实验室.磷酸三钠、吐温20(Tween-20)购自美国Sigma公司,无菌96微孔板购自美国康宁Corning-Costar公司,其他主要试剂购自生工生物工程(上海)股份有限公司.苹果从杭州市下沙宝龙广场永辉超市采购.
1.2 培养基及病原真菌孢子悬浮液的制备
将马铃薯去皮切成小块,称取去皮马铃薯200 g,加水1 000 mL煮沸0.5 h后用双层纱布过滤,滤渣弃去,向滤液中加入葡萄糖20 g、琼脂20 g,不断搅拌至完全溶解后加水补充至1 000 mL.将配制完成的马铃薯葡萄糖琼脂培养基(potato dextrose agar,PDA)分装入500 mL三角瓶中,置于高压灭菌锅内于121 ℃灭菌30 min后倒平板待用.
将病原菌P.expansum及A.alternata接种在PDA培养基上,于25 ℃的培养箱中恒温培养7 d,用含有0.05% Tween-20的无菌水对孢子进行收集,经过4层无菌纱布过滤后备用.将新鲜的P.expansum及A.alternata孢子悬浮液等量加入到含有100 mL马铃薯葡萄糖肉汤培养基(potato dextrose broth,PDB)的250 mL三角瓶中,取摇匀的孢子悬浮液少许置于洁净的血球计数板上,盖上盖玻片后静置3 min,在光学显微镜下统计计数区内孢子数量,每个样品重复3次,根据血球计数板使用说明计算孢子浓度,最终调节培养基中孢子浓度为1.0×106spores·mL-1.
1.3 TSP对采后病原真菌P. expansum及A. alternata菌落扩展的抑制
分别将30 μL 1.0×106spores·mL-1的P.expansum及A.alternata孢子悬浮液用涂布棒均匀涂布在PDA培养基上,培养24 h后,用打孔器获取直径为0.5 cm的菌饼,分别放置于含15 mL PDA培养基的培养皿(直径为9 cm)中央,培养基中含有1 mg·mL-1TSP,空白PDA也放置同样的菌饼作为对照.分别在恒温培养箱中于15、25 ℃培养1、2、3、4、5、6、7 d后采用十字交叉法测量菌落直径.15、25 ℃分别代表水果超市货架贮藏温度及常温.
1.4 微孔板的准备及病原菌培养
分别将200 uL 105spores·mL-1的P.expansum及A.alternata孢子悬浮液转移至含20 mL酵母提取物的蔗糖半固体琼脂(YES:酵母提取物8 g;蔗糖60 g;MgSO4·7H2O 0.2 g;琼脂0.488 g;蒸馏水)培养基中.孢子加入过程需要缓慢搅拌均匀并尽量避免气泡产生.对于每种测试的真菌,准备两个离心管,一个仅向YES中添加孢子悬浮液,另一个添加孢子悬浮液及4 000 mg·L-1TSP.在添加孢子之前将TSP先加入培养基中,避免改变琼脂质量浓度(1.22 mg·mL-1).
实验中采用无菌96微孔板.首先在第1列至第12列的每个微孔中注入150 μL YES培养基.之后,将150 μL 4 000 mg· L-1的TSP分别注入微孔板第1列的每一个孔中.接着,采用8通道移液器分别吸取150 μL前一列的培养基至后一列直至第10列中.第11列微孔板中不加TSP作为抑菌剂对照组以定期取样观察真菌生长速度,最后一列注入等量的无菌水作为培养基空白组.得到的第1~11列微孔板中TSP的质量浓度分别为4 000、2 000、1 000、500、250、125、62.5、31.25、15.62、7.81、3.90、0 mg ·L-1[9].
1.5 P. expansum及A. alternata生长速度测定,孢子萌发时间及MIC、NIC的计算
将每个平板在酶标仪中于25 ℃温育30 min,600 nm下每隔30 min记录一次吸光值,记录时长取决于测试的真菌生长速度.每种真菌在特定的微孔板中生长,其中每横排的12个孔分别代表含不同TSP浓度的P.expansum及A.alternata孢子悬浮液,每竖排的8个孔代表相同TSP浓度的8个重复,该实验重复3次.此外,通过显微镜观察进行真菌萌发研究,以评估初始OD增加时间与孢子萌发时间的相关性.培养3、6、9、12、15、20、25 h后从对照组中取出10 μL孢子,测定芽管长度.当50%以上的孢子芽管长度达到孢子最大直径一半时,发芽时间被确定[10].

1.6 统计分析
对每组实验的8次重复以及每种病原菌的3次生物学重复实验均进行单因素方差分析,以确定实验的可重复性.根据Tukey检验分析估算不同真菌的MIC和NIC值,所有数据分析均通过Statistica 7.1软件(Statsoft Inc.,Tulsa,USA)进行处理[9].
2 结果与分析
2.1 TSP对采后病原真菌P. expansum及A. alternata菌落扩展的抑制
实验结果(图1A)表明,25 ℃下1 mg·mL-1TSP处理组与对照组P.expansum菌落病斑直径均大于15 ℃下P.expansum病斑直径; 15、25 ℃下处理组P.expansum菌落病斑直径均明显小于对照组.15 ℃下培养3 d,对照组P.expansum菌落直径约为1.8 cm,而此时处理组菌落直径仅约为1.2 cm;25 ℃下培养3 d,对照组P.expansum的菌落直径约为2.1 cm,而此时处理组菌落直径仅约为1.8 cm.15 ℃与25 ℃下分别培养4、5、6、7 d后,处理组P.expansum菌落直径均小于对照组.综上可见,1 mg·mL-1TSP处理对P.expansum菌落扩展有抑制作用.
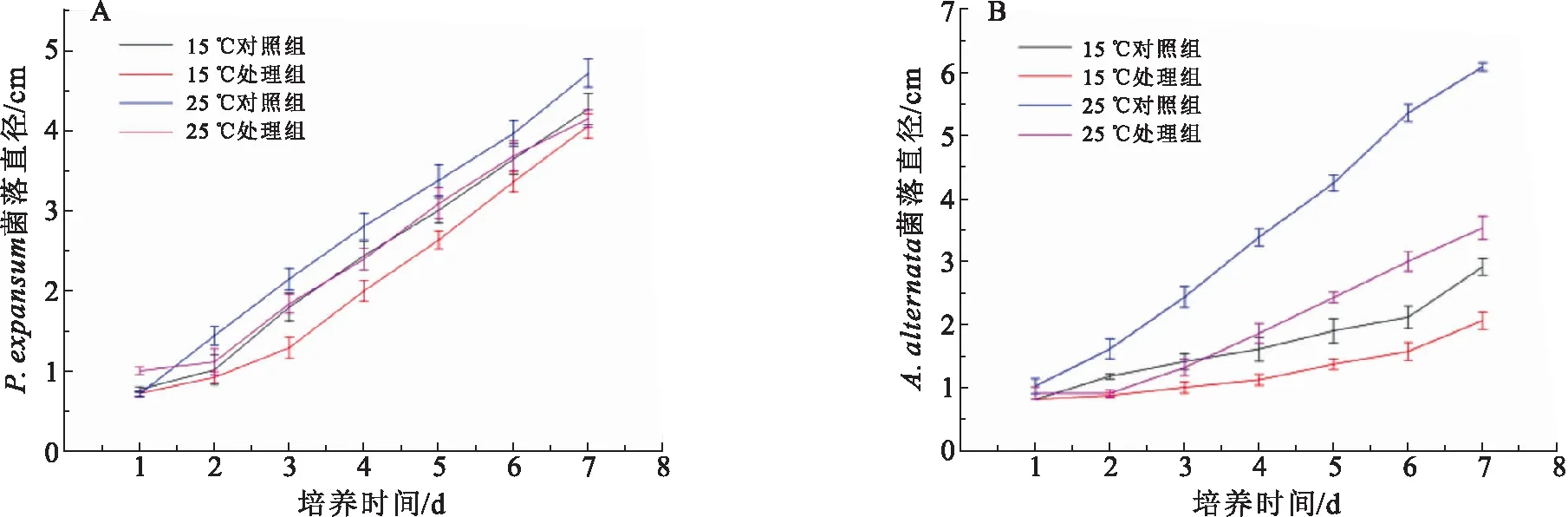
注:误差线代表3次独立生物学重复实验的平均标准偏差.
由图1B可见,25 ℃下1 mg·mL-1TSP处理组与对照组A.alternata菌落病斑直径均大于15 ℃下A.alternata病斑直径;15、25 ℃下处理组A.alternata菌落病斑直径均明显小于对照组.15 ℃下培养3 d,对照组A.alternata菌落直径约为1.4 cm,而此时处理组菌落直径仅约为0.99 cm;25 ℃下培养3 d,对照组菌落直径约为2.43 cm,而处理组菌落直径仅约为1.31 cm.15 ℃与25 ℃下分别培养4、5、6、7 d后,处理组A.alternata菌落直径均小于对照组.以上结果表明,1 mg·mL-1TSP处理对A.alternata菌落扩展有抑制作用.
2.2 P. expansum与A. alternata生长速度及孢子萌发时间
图2与图3分别表示未经TSP处理的病原菌P.expansum与A.alternata孢子随着培养时间延长,其培养基中吸光值OD600的变化(图中OD600值均已减去培养基空白组产生的影响).
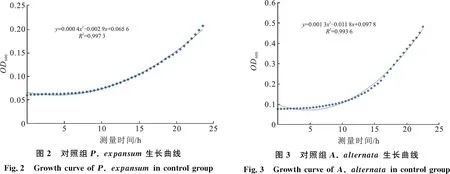
从图中P.expansum与A.alternata的生长曲线拐点处可看出,P.expansum培养基中OD600的初始增加时间点大约是10 h,A.alternata初始增加时间点大约是8 h.这与通过测量芽管长度获得的孢子萌发时间(P.expansum为10 h,A.alternata为8 h)结果一致.
2.3 TSP对P. expansum及A. alternata的MIC、NIC值
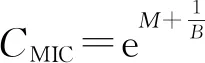
表1 两种病原真菌随ln[TSP]变化对应的积分面积
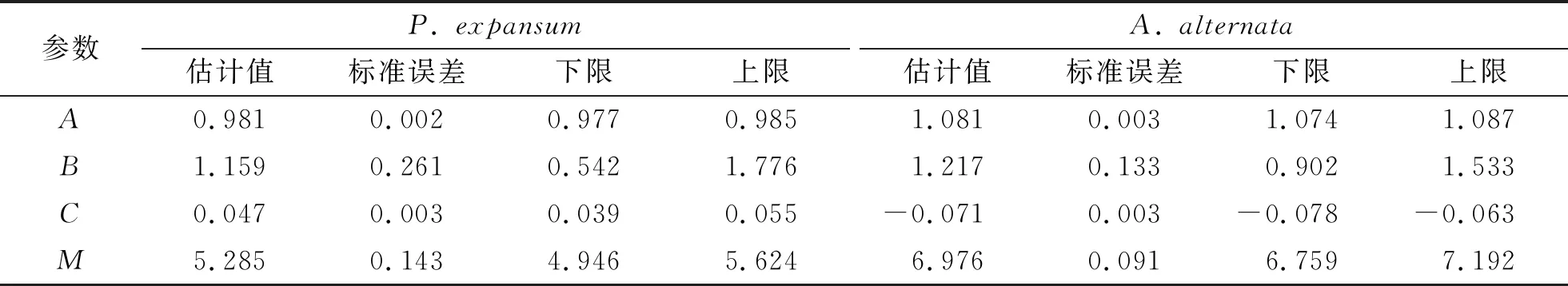
表2 模拟Gompertz方程后所得各参数值
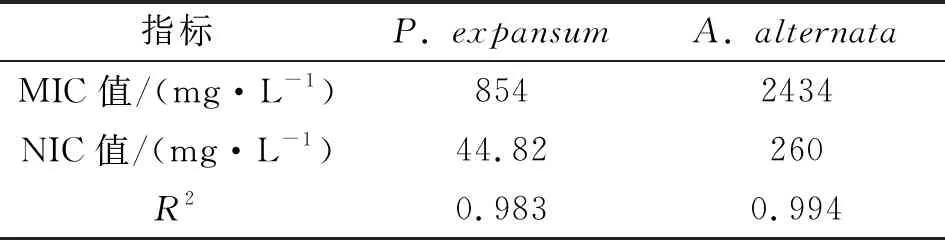
表3 拟合Gompertz方程后得到的MIC、NIC值及拟合系数
由表3可知,两种病原真菌P.expansum及A.alternata在TSP处理下的抑菌模型拟合系数R2分别为0.983和0.994,拟合线性准确度较高.由此可见,TSP对两种病原真菌的抑制模型与Gompertz方程有较好的拟合度.与P.expansum相比,A.alternata的模型准确性更高.TSP对两种病原真菌P.expansum和A.alternata的MIC值分别为854、2 434 mg· L-1,说明与A.alternata相比,P.expansum对TSP的敏感性更强.此外,食品处于实际环境中时,外界其他复杂因素和物质对病原真菌生长的影响远大于实验室环境,由此可推断该抑菌模型所推导得出的MIC、NIC值比实际食品环境中偏大.实验所得的MIC与NIC值与国外其他研究者所计算的数值[13]非常接近.综合以上实验结果,利用浊度法测定以及Gompertz 方程拟合,可以快速而较准确地计算出TSP对两种病原真菌P.expansum及A.alternata的MIC及NIC值.
3 讨论
综合以上实验结果,TSP对Penicilliumexpansum及Alternariaalternata两种病原真菌的生长有一定的抑制作用.我们通过浊度法确定了TSP处理下两种病原真菌的孢子萌发时间、生长速度,拟合了TSP对两种病原真菌的抑制模型,计算了TSP对P.expansum及A.alternata两种病原真菌的MIC、NIC值.结果表明1 mg·mL-1TSP能够在15 ℃以及25 ℃下对两种病原真菌的菌落生长起到抑制作用,培养7 d后,处理组的菌落直径明显要小于对照组,未经处理的两种真菌孢子萌发时间稳定在10 h与8 h,这与已经报道的TSP对其他果蔬采后病原真菌的研究结果非常接近.此外,两种病原真菌Gompertz方程的拟合重合度较高,线性相关性较好,计算所得的MIC与NIC值与国外研究者所报道结果接近,P.expansum对TSP的敏感性要高于A.alternata.
通过在PDA、YES培养基以及96微孔板中培养观察和使用浊度法测定评估TSP对P.expansum及A.alternata两种病原真菌的抑菌效果和敏感性的方法成本低廉且操作简便,实验效率高.此外,这种方法还可以用于同时快速筛选多种真菌及多种抗真菌物质甚至不同浓度的相同抗真菌物质,以便于建立正确的抑菌模型.但该方法若要有效应用,考虑到各个实验室之间实验设备以及实验消耗品的差异,仍然需要进一步实验来进行优化完善与标准化.同时,该方法也存在一定缺点,若实验过程中真菌开始发芽并且真菌菌丝开始分叉,尤其是在培养基表面形成团状物,生成致密的菌丝体,会在一定程度上降低该实验方法的准确性.但与传统的基于培养皿测量的方法相比,该方法不论是在可行性上还是在简便性上,都有较大的进步.
尽管研究者对TSP的抑菌机理尚不明确,但仍不可否认,TSP是一种低成本且无环境危害的抗真菌化合物,不仅可以与其他合成杀菌剂结合使用,还可以单独作用于采后果蔬,对病原真菌进行综合防治.在今后的研究中,还需要进一步探索TSP对多种病原真菌的具体抑制机制,发现并印证其作用模式,优化改善TSP作为抑菌剂的使用效果与范围.同时可利用全新的方法探索其他抗真菌化合物对采后病原真菌的抑制作用与敏感性研究,拓展采后果蔬病害防治思路,进一步保证食品质量与安全.

