冠状动脉钙化病变诊治中国专家共识(2021版)
王伟民 霍勇 葛均波
代表《冠状动脉钙化病变诊治中国专家共识》专家组
随着经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)的不断发展,介入治疗更多涉及到更为复杂的病变,而冠状动脉钙化病变经常贯穿于各种复杂病变,增加了冠状动脉介入治疗的难度,是心血管介入医师所面临的主要挑战之一,尤其是严重钙化病变,或伴有扭曲、成角、弥漫的严重钙化病变,手术即刻的并发症以及早期和晚期主要不良心血管事件的发生率明显升高。正确地识别、评估钙化病变,选择恰当的介入治疗技术,对于提高手术成功率、减少手术相关并发症、改善患者预后都非常重要。
2014年,来自国内的介入心脏病学专家共同起草了《冠状动脉钙化病变诊治中国专家共识》[1]。该共识在结合国内外研究结果及指南建议的基础上,提出了更适合中国人群的冠状动脉钙化病变诊治建议,对我国钙化病变的介入治疗起到了重要的指导作用。
2014年以来,更多的临床研究证据相继发表,腔内影像学优化介入治疗,特别是优化钙化病变介入治疗的理念逐渐被接受和推广,同时新器械、新技术开始应用于钙化病变的介入治疗中。国内外许多学术机构相继更新或制订了钙化病变介入治疗指南。2015年欧洲经皮心血管介入学会发表《欧洲冠状动脉斑块旋磨术专家共识》[2]。2017年我国介入心脏病学专家共同起草了《冠状动脉内旋磨术中国专家共识》[3]。2019年《北美专家旋磨述评》[4]发表。2020年美国心血管造影和介入学会发表钙化病变诊治流程图[5]。我国钙化病变介入治疗领域的研究也有了很大进展。基于此,国内介入心脏病学专家在2014版基础上对《冠状动脉钙化病变诊治中国专家共识》进行了更新,以更好地指导我国钙化病变的介入治疗。
1 钙化病变的流行病学及对介入治疗的影响
流行病学资料显示,冠状动脉钙化随年龄增加而增加,在40~49岁人群中的发生率约为50%,在60~69岁人群中的发生率约为80%[3]。冠状动脉狭窄程度越高,通常伴有钙化的概率也越大。高龄、脂质代谢异常、糖尿病、甲状旁腺功能亢进、慢性肾病、肾替代治疗、高钙血症及既往行冠状动脉旁路移植术是冠状动脉钙化病变的高发人群。冠状动脉钙化的检出率因应用不同影像学评估手段而有差异,冠状动脉CT血管造影显示狭窄程度>75%的冠状动脉节段中,54%存在冠状动脉钙化,冠状动脉造影显示约1/3冠状动脉病变中可见中重度钙化病变。在包括ACUITY和HORIZONS-AMI研究的6855例患者中,中重度钙化病变的发生率为32%,其中5.9%为重度钙化病变[6-8]。
钙化结节是一种特殊类型的钙化,是易损斑块的一种特殊表现形式,占易损斑块的4.2%~7.9%[9-10]。钙化结节通常成簇存在,突出于管腔,其病理基础是在钙化基质上覆盖骨性小结样物质,造成纤维帽不连续、内皮细胞缺失,从而易导致血栓形成。
冠状动脉钙化病变的存在,尤其是严重内膜钙化病变和钙化结节,明显增加了PCI的难度和风险,其难度在于如下几点:(1)钙化病变往往伴随血管成角、扭曲病变,以及对血管扩张的反应较差,所以增加了介入相关器械通过的难度,增加了PCI相关并发症(如介入器械不能到位、支架脱落、导丝断裂、支架纵向压缩等)的风险。(2)钙化病变属于高阻力病变,球囊难以充分扩张,甚至会发生球囊破裂等情况。通常需要较高的压力扩张钙化病变,发生血管夹层、穿孔、破裂、无复流等概率明显增加。(3)在未充分扩张的钙化病变段内置入支架,容易出现支架膨胀不全、贴壁不良、支架不规则变形,从而导致各期的支架内血栓形成、支架内再狭窄等风险增加[11-12]。
2 冠状动脉钙化病变的影像学诊断方法
冠状动脉钙化病变的诊断主要依靠影像学方法。目前临床常见的识别和评估冠状动脉钙化病变的影像学手段包括冠状动脉CT血管造影、冠状动脉造影、血管内超声(intravascular ultrasound,IVUS)以及光学相干断层成像(optical coherence tomography,OCT)。
2. 1 冠状动脉CT血管造影
冠状动脉CT血管造影是目前冠状动脉钙化病变的最主要无创检查手段。钙化病变在冠状动脉CT血管造影上表现为白色、高密度影像,一般认为CT值>130 HU的病变为钙化病变,具有较高的敏感性和特异性。临床常用冠状动脉钙化积分来评估冠状动脉钙化的严重程度。目前常用的方法为Agatston积分。当Agatston积分>100分时冠状动脉造影证实冠心病(狭窄>50%)的敏感性为95%,特异性为79%。当Agatston积分为0分时,除外冠心病(狭窄>50%)的阴性预测值为96%~100%。但由于钙化的存在,通常会影响冠状动脉CT血管造影对冠状动脉狭窄程度评估的准确性。
2. 2 冠状动脉造影(图1)
冠状动脉造影是诊断钙化病变最常用的工具。其诊断钙化病变的特异性高达89%,尤其是对严重钙化病变诊断的特异性可达98%;但受设备分辨率、解剖结构重叠、心脏瓣膜、椎体钙化的影响,以及非磷酸盐钙化在冠状动脉造影中并不能显影,其敏感性仅48%。冠状动脉钙化病变在X线透视下的特征性表现是沿血管走行的密度不均的高密度影像,但不能判断钙化与管腔的关系。依据冠状动脉造影结果,可以将钙化病变的严重程度分为:(1)无钙化;(2)轻度钙化,只有在心脏搏动时看到淡而模糊的高密度阴影,心脏不搏动时完全看不到钙化影的存在;(3)中度钙化,在心脏搏动时看到较清晰、较容易看到的高密度阴影;(4)重度钙化,在心脏搏动和不搏动时均可看到清晰高密度阴影。

图 1 冠状动脉造影指导的钙化病变介入治疗策略
2. 3 IVUS(图2)
IVUS中钙化病变的典型表现为病变表面的明亮、白色影像,而钙化病变后方伴有黑色声影,常伴多重反射。IVUS诊断钙化病变的敏感性为90%,特异性为100%。IVUS可较好地判断钙化病变的位置和范围,帮助制定介入治疗的策略。IVUS评价钙化病变的不足之处在于无法穿透钙化病变,导致IVUS不能够定量钙化病变的厚度,因此往往会低估钙化病变的深度和斑块的负荷。此外对于一些严重狭窄、成角等钙化病变,IVUS导管可能无法通过病变而做出评估。根据钙化在IVUS图像上血管内壁的分布位置,可分为三种类型,即内膜钙化、基底膜钙化和混合钙化。一般认为基底膜钙化不影响介入治疗。IVUS根据钙化病变累及血管腔的范围,将钙化病变分为Ⅰ~Ⅳ级:(1)Ⅰ级,钙化范围<90°;(2)Ⅱ级,钙化范围在91°~180°;(3)Ⅲ级,钙化范围在181°~270°;(4)Ⅳ级,钙化范围≥27l°。除了钙化范围,IVUS检查还可以准确地测量钙化病变的长度。
2. 4 OCT(图3)
OCT采用近红外光纤成像,根据测量红外光线的回波延迟时间和强度,来描述冠状动脉病变的特点,具有成像速度快和分辨率高的优势,其空间分辨率可高达10~20 μm,对于评价冠状动脉斑块具有重要价值,其诊断钙化病变的敏感性为96%,特异性为97%[13]。钙化斑块在OCT图像上具有低背反射和低衰减的特性,通常表现为边缘锐利的低信号或不均匀区域。根据钙化斑块的范围、深度等特征,将其分为以下四种类型:(1)环形钙化,指钙化斑块角度超过270°;(2)点状钙化,指钙化角度≤90°,长度<10 mm的钙化;(3)深层钙化,指钙化斑块距离管腔超过100 μm;(4)浅表钙化,指钙化斑块距离管腔65~100 μm。

图 2 IVUS指导的钙化病变介入治疗策略
和IVUS相比,OCT评估钙化病变的优势在于能够评估钙化病变的厚度,能够更加准确地评估钙化病变的容积,这对指导选择恰当的预处理策略有重要意义。但由于近红外光穿透能力较弱,当钙化斑块厚度较厚时(超过1.2~1.6 mm),由于OCT近红外光的衰减影响光穿透斑块的能力,有时会观测不到钙化斑块后缘的钙化轮廓。或当钙化斑块混有脂质成分时,由于脂质成分富含红细胞成分,也会影响光线对钙化斑块的穿透,从而影响OCT对钙化斑块厚度的评估能力。
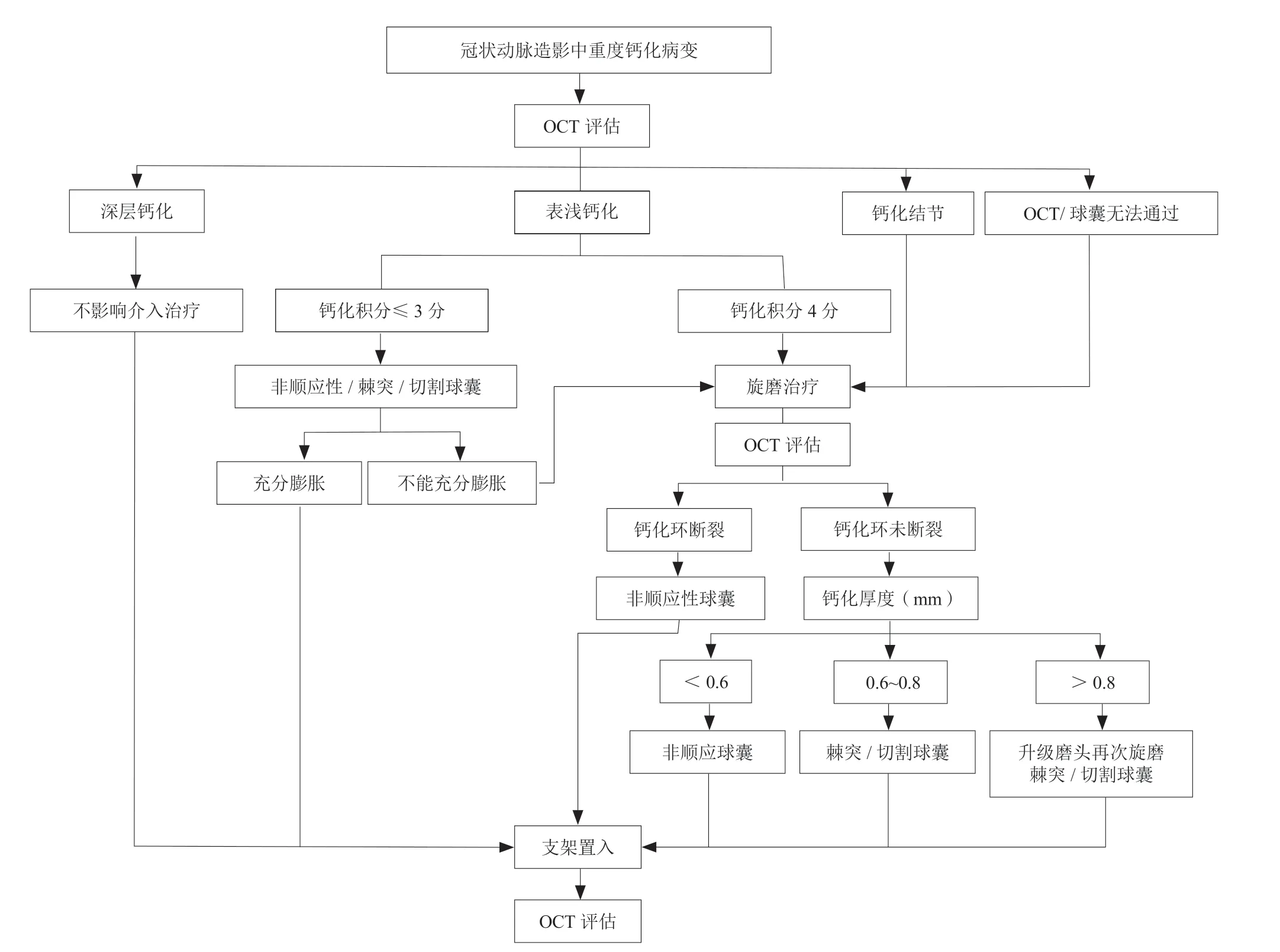
图 3 OCT指导的钙化病变介入治疗策略
OCT能够精确测量钙化病变角度、病变长度及钙化厚度等,应用OCT钙化积分系统(表1),可预测PCI术后的支架膨胀率。如果OCT提示最大钙化角度>180°、病变长度>5 mm、最大钙化厚度>0.5 mm,即钙化积分为4分时,则存在较高的支架膨胀不全风险,建议在支架置入前行冠状动脉斑块旋磨术进行充分的斑块预处理[14],同时在冠状动脉斑块旋磨术后,进行OCT检查来评估旋磨治疗的效果。

表1 OCT钙化积分系统
3 冠状动脉钙化病变的处理策略
根据钙化病变严重程度,推荐的PCI治疗策略原则如下:(1)对于钙化病变的高发人群推荐在冠状动脉造影前应用冠状动脉CT血管造影对冠状动脉钙化的范围和程度进行预评估。(2)冠状动脉造影时见冠状动脉中重度钙化病变者,推荐术中常规行IVUS或OCT检查进行评估[5],根据腔内影像学检查的结果,选择不同的预处理策略。(3)轻度表浅的钙化病变与无钙化病变者治疗大致相同。(4)钙化位于斑块基底部(深部钙化),对PCI操作影响不大,无需行冠状动脉斑块旋磨术;斑块位于内膜(浅表钙化)而且钙化较严重者会使球囊扩张困难,通常需要切割球囊或冠状动脉斑块旋磨术治疗。(5)钙化结节会导致器械通过困难、球囊破裂甚至血管破裂等严重并发症发生,为了增加操作安全性,通常需要行冠状动脉斑块旋磨术治疗。(6)多数钙化病变用球囊以<16 atm(1 atm=101.325 kPa)的压力即可展开,当球囊扩张压力达16 atm未充分扩张病变时,不宜强行扩张,推荐行IVUS或OCT检查评估,或直接行冠状动脉斑块旋磨术治疗。(7)对IVUS检查提示成角超过271°的内膜钙化,或OCT检查提示钙化积分4分者(最大钙化弧度>180°、病变长度>5 mm、最大钙化厚度>0.5 mm)[14],可直接行冠状动脉斑块旋磨术,再行球囊预扩张后置入支架。具体处理策略如下。
3. 1 冠状动脉钙化病变的常规介入治疗方法
3. 1. 1 常规工作球囊 目前常规工作球囊为半顺应性。对轻度、表浅钙化病变可使用常规工作球囊。但常规工作球囊对中、重度钙化病变扩张成功率低、并发症发生率高,当球囊压力达16 atm未能充分扩张病变时应撤出球囊,选择其他方法。对球囊不能扩张的钙化病变应避免置入支架。
3. 1. 2 非(低)顺应性球囊 轻、中度钙化病变在预扩张时可选择非(低)顺应性球囊,或用于冠状动脉斑块旋磨术后的进一步预处理。但对于弥漫、不规则、严重偏心钙化病变,高度成角及极度扭曲血管的病变和严重的钙化病变应避免使用非(低)顺应性球囊。
3. 1. 3 切割球囊 切割球囊也适用于轻、中度钙化病变[15-17],或用于冠状动脉斑块旋磨术后的进一步病变预处理。但对IVUS提示的Ⅲ~Ⅳ级严重钙化病变不建议使用切割球囊。使用切割球囊时应按照说明书标称的压力进行扩张,最大不应超过12 atm,以免过高的压力导致刀片嵌顿而难以收回。切割球囊的禁忌证如下:(1)参考血管直径小(直径<2 mm)。(2)弥漫性病变(长度>20 mm)。(3)无保护的左主干病变。因切割球囊压力回撤较慢,故用于左主干病变风险较大,仅限于技术非常熟练的术者开展。(4)严重成角及极度扭曲血管的病变。因切割球囊顺应性较差、硬度较高,常难以到达病变处。(5)严重钙化病变。因其难以被切割球囊充分扩张。(6)慢性完全闭塞病变及狭窄>95%的病变。因切割球囊的直径及外形较大,难以到达并通过此类病变,此时要先用1.5~2.0 mm直径的小球囊预扩张后再用切割球囊扩张。
3. 1. 4 棘突球囊 棘突球囊适用于轻、中度钙化病变,或用于冠状动脉斑块旋磨术后的进一步病变预处理。当棘突球囊不能通过钙化病变时,采取钙化病变内匍匐前进技术可取得良好的扩张效果。使用棘突球囊的注意事项:(1)避免在冠状动脉内旋转球囊,否则可能会导致与尼龙缠结。(2)尼龙固定在球囊的两端,而非球囊的表面。第二根导丝在经过球囊时,有发生缠结的风险。(3)尽量不在支架网眼内应用棘突球囊,以避免发生缠结。
3. 2 冠状动脉斑块旋磨术
冠状动脉斑块旋磨术装置在20世纪80年代初由Auth等进行研制及开发,1988年Fourrier等[18]完成了首例冠状动脉斑块旋磨术。1993年冠状动脉斑块旋磨术被美国食品和药品监督管理局批准。此后,旋磨技术得到广泛应用,使严重钙化病变的介入治疗成功率大大提高。
早期冠状动脉斑块旋磨术的目的是消蚀动脉粥样硬化斑块,辅助球囊扩张或支架置入。以斑块消蚀为目的旋磨策略(大旋磨头,旋磨头/参考血管直径比>0.6)血管并发症风险、靶病变再次血运重建及围术期心肌梗死风险较高,限制了冠状动脉斑块旋磨术在临床的广泛应用。随着介入治疗的发展,旋磨理念被重新定义为斑块修饰。斑块修饰强调旋磨头打磨钙化斑块之后形成新的通道。一方面旋磨开通的管腔方便后续器械通过;另一方面旋磨能有效修饰钙化病变,使管腔内壁平滑、出现钙化环断裂,有利于后续球囊扩张成功,改善支架膨胀和贴壁情况。目前以斑块修饰为目的的旋磨策略(小旋磨头,旋磨头/参考血管直径比≤0.6)并发症风险更低,且在减少血管损伤风险的同时能够获得更满意的PCI效果。
3. 2. 1 冠状动脉斑块旋磨术的基本原理 冠状动脉斑块旋磨术是采用橄榄形的带有钻石颗粒的旋磨头,根据“差异切割”的理论选择性地祛除钙化或纤维化的动脉硬化斑块,而具有弹性的血管组织在高速旋转的旋磨头通过时会自动弹开,即旋磨头不切割有弹性的组织和正常冠状动脉,对血管中膜无损伤。通过旋磨可以有效改善血管的顺应性,从而使球囊容易通过及扩张,最后完成支架的置入。与球囊扩张相比,旋磨术可获得光滑的血管内腔,提高支架的释放质量,达到理想的支架贴壁和膨胀效果,从而降低支架内血栓形成和支架内再狭窄发生率。由于单纯冠状动脉斑块旋磨术的支架内再狭窄发生率较高,推荐于旋磨术后置入药物洗脱支架,可改善钙化病变的长期疗效[19-22]。
3. 2. 2 冠状动脉斑块旋磨术的适应证 目前冠状动脉斑块旋磨术的主要适应证包括:(1)血管内膜严重钙化的病变;(2)球囊无法通过或无法充分扩张的病变;(3)冠状动脉开口病变,旋磨后减少斑块移位与边支闭塞;(4)选择性的弥漫性支架内再狭窄的病变,旋磨以减少内膜增生体积。由于旋磨术对技术要求较高,并发症的发生率也较普通介入治疗高,故推荐上述(1)和(2)为冠状动脉斑块旋磨术的的主要适应证。
根据启动旋磨治疗的时机,将冠状动脉斑块旋磨术分为计划性旋磨和非计划性旋磨。计划性旋磨指在之前未发生任何器械使用失败的情况下,主动使用旋磨术处理病变。非计划性旋磨指在器械尝试失败之后决定使用旋磨的策略。与非计划性旋磨相比,计划性旋磨可以显著减少手术时间、X线暴露时间、对比剂用量和预扩球囊用量,提高手术成功率,同时可减少住院期间主要不良心血管事件的发生[23-25]。
推荐对于冠状动脉造影中重度钙化病变、球囊无法通过或无法扩张病变常规行腔内影像学检查。如果:(1)IVUS检查提示病变成角>271°的内膜钙化,或(2)OCT检查提示最大钙化角度>180°、病变长度>5 mm、最大钙化厚度>0.5 mm(即OCT钙化积分为4分),建议直接行计划性冠状动脉斑块旋磨术。
3. 2. 3 冠状动脉斑块旋磨术的特定适应证 随着冠状动脉斑块旋磨术的推广及普及,在早期被认为是旋磨治疗禁忌证的特殊病变,逐渐成为冠状动脉斑块旋磨治疗新的特定适应证,被越来越多的介入医师重视,并在冠状动脉介入治疗领域不断实践及突破。包括:(1)无保护左主干病变;(2)开口病变;(3)严重心功能不全者;(4)弥漫病变(病变长度≥25 mm);(5)成角病变(<90°);(6)慢性完全闭塞病变;(7)有明显内膜撕裂的病变;(8)未膨胀的支架。但需要强调的是,对于特定适应证的旋磨治疗,必须由经验丰富的术者来完成,如果操作不慎,可导致严重并发症的发生。
3. 2. 4 冠状动脉斑块旋磨术的禁忌证 冠状动脉斑块旋磨术的禁忌证包括:(1)旋磨导丝无法通过的病变;(2)明显富含血栓的病变;(3)静脉桥血管病变;(4)成角>90°的病变;(5)严重螺旋性夹层。
3. 2. 5 冠状动脉斑块旋磨术终点的判断 目前冠状动脉斑块旋磨术的理念是斑块修饰[26],旋磨头/参考血管直径的比值为0.5~0.6,因此当旋磨头通过病变后,1~2次常达不到理想效果,一般需要再进行3~5次的抛光。评价是否达到旋磨终点的指标包括:(1)旋磨头无阻力通过病变;(2)旋磨头通过病变时,声音无变调,转速无下降;(3) 1 : 1球囊可充分扩张病变;(4)旋磨后IVUS检查发现钙化环断裂或90°以上的多重反射影;(5)旋磨后OCT检查发现钙化环断裂;(6)对于旋磨术后无钙化环断裂的患者:①如果OCT评估最大钙化厚度<0.6 mm,可以首先尝试非顺应性球囊扩张;②如果OCT评估最大钙化厚度0.6~0.8 mm,建议棘突球囊、切割球囊扩张,多数患者均可在球囊扩张后出现钙化环断裂;③对于OCT评估钙化厚度仍>0.8 mm的患者,首先考虑升级旋磨头再次进行旋磨。
3. 2. 6 冠状动脉斑块旋磨术的并发症及处理 (1)冠状动脉痉挛:冠状动脉痉挛是旋磨术中较常见的并发症,一般预后良好,其处理为立即停止旋磨,并给予冠状动脉内注射硝酸甘油,如不能缓解可考虑冠状动脉内给予维拉帕米或地尔硫䓬。预防冠状动脉痉挛的措施包括:钙通道阻滞剂的应用,选择旋磨头大小与血管直径的比例不宜过大,从较小的旋磨头开始[27-28],旋磨时间在15 s左右,旋磨前冠状动脉内注入硝酸甘油,选择专用旋磨液等。(2)慢血流/无复流现象:慢血流/无复流现象是冠状动脉斑块旋磨术主要并发症之一,其发生率为1.8%~9.5%。预防与处理原则为①严格掌握适应证,如左心功能受损明显及病变远端血管分支少且细小者不宜行旋磨治疗。②规范操作,旋磨头的选择从较小的旋磨头开始,逐渐增大,缓慢推进旋磨导管,避免转速明显下降;旋磨时不要一直推送旋磨头前进或将旋磨头固定在病变部位不动,而应该采取慢进快退的手法,类似于“小鸡啄米”;每次旋磨时间不宜过长(15 s左右)。③一旦发生无复流,硝酸甘油效果差,则给予其他血管扩张剂,如腺苷、钙通道阻滞剂(维拉帕米、地尔硫䓬、尼卡地平)或硝普钠等,血小板糖蛋白Ⅱ b/Ⅲ a受体拮抗剂也可以考虑应用。通过微导管或抽吸导管冠状动脉内给药可以获得更好的效果。对症处理包括药物维持血压、心率,必要时置入主动脉内球囊反搏泵或植入临时起搏器。(3)冠状动脉夹层:一旦发生,不宜再增加旋磨头直径,应置入支架进行处理。(4)冠状动脉穿孔:一旦发生,应立即将旋磨头退出,保留导丝在血管内;小穿孔可以先用球囊低压力长时间局部压迫,大穿孔可置入带膜支架。低血压往往提示发生了心脏压塞,应及时行床旁超声心动图确诊并行心包穿刺引流,必要时外科手术干预。(5)心动过缓及房室传导阻滞:多见于对优势型左回旋支或优势型右冠状动脉旋磨时,可静脉予以阿托品等药物,必要时可植入临时起搏器,但不建议术前常规预防性植入临时起搏器。(6)旋磨器械的损坏:旋磨器械的损坏主要包括旋磨导丝断裂、旋磨头的断裂、旋磨头嵌顿等,通常可引起严重并发症发生,甚至死亡。发生旋磨头嵌顿的处理方法:①尝试将旋磨头前送及后退撤出,或重新启动低速或高速旋转退出;②尝试把旋磨导丝和旋磨头一起拉出;③将旋磨头推送至病变远端,重新再送一根工作导丝至病变远端,送球囊至嵌顿处及病变近端扩张,然后尝试将旋磨头拉出;④将旋磨杆及旋磨导丝剪断,通过剪断的旋磨杆和导丝送5进6子母导管至病变处,将旋磨头、旋磨导丝及5进6导管一起退出;⑤尝试将旋磨导管尾端和推进器断开,用止血钳夹住导管尾端,逆时针旋转20圈,然后拉出旋磨头。旋磨器械的损坏主要由于术者不熟悉旋磨器械的性能、操作不当所致,因此操作旋磨技术的术者应经过专项培训和规范操作,可避免此类并发症的发生。
3. 3 准分子激光冠状动脉斑块消蚀术(excimer laser coronary atherectomy,ELCA)
ELCA采用氯化氙作为活性介质,释放308 nm波长的紫外线光脉冲(冷激光),主要作用于蛋白质和脂质,水和血液对激光能量吸收较少,通过光化学效应、光热效应和光机械效应对冠状动脉斑块或血栓组织进行消蚀(穿透深度为0~30 μm)[29]。最早在1992年ELCA被美国食品和药品监督管理局批准用于冠状动脉病变的介入治疗。其主要适应证为支架内再狭窄、静脉桥血管病变、慢性完全闭塞病变、钙化病变、支架膨胀不全、分叉病变以及血栓性病变等[30-32]。
尽管ELCA可以用于钙化病变,但其对严重钙化病变的治疗有效率偏低,主要适合于轻中度钙化病变。而对于严重钙化病变,首选的还是冠状动脉斑块旋磨术。但由于在旋磨治疗时,需通过微导管交换导丝,在遇到因严重钙化病变无法实现导丝交换时,可先行ELCA为后续的旋磨治疗创造条件(RASER技术)[33]。此外,对于因钙化病变使得支架置入术后膨胀不全的患者,旋磨支架的并发症风险较高,此时ELCA可安全有效地进一步对支架外钙化病变进行消蚀,尤其是在术中使用对比剂替代生理盐水作为冲洗/灌注介质时[34],可进一步提高支架扩张成功率。
ELCA在冠状动脉钙化病变治疗中是机械旋磨术(常规旋磨和轨道旋磨术)的重要补充,为旋磨不成功病变提供了新的选择。对于非顺应性球囊或切割/棘突球囊不能充分扩张病变,或OCT提示钙化角度>180°、钙化长度>5 mm和钙化厚度>0.5 mm病变,在机械旋磨术失败后,可选择行ELCA。
ELCA的总体安全性良好,准分子激光释放的热量更少,对血管内皮等正常组织损伤小;消蚀病变的边缘通道由于沿着导丝进行,故而相对整齐,因此激光作用空间可控,使冠状动脉穿孔的风险大大降低,并且消蚀的过程中持续的盐水冲洗进一步减少了产热和降低了并发症的风险。此外,在ELCA消蚀过程中产生水、气体和直径<10 μm的微小物质,而且激光能量可以抑制血小板聚集,因而无复流/慢血流发生率也很低。
3. 4 冠状动脉轨道旋磨术
为进一步提高严重冠状动脉钙化病变介入治疗的成功率,对外周血管疾病的轨道旋磨系统(orbital atherectomy system,OAS)进行改进并应用到冠状动脉,从而研发出治疗冠状动脉严重钙化病变的新方法。现有的临床研究资料显示,冠状动脉OAS作为一种新型的斑块修饰技术,对严重冠状动脉钙化病变具有良好的治疗效果和安全性。
冠状动脉OAS的工作原理主要是基于离心力的差异打磨,当冠状动脉OAS的旋磨头沿导丝到达病变近端(3 mm)后,启动旋磨泵按照设定的速度(低速:80 000转/分,高速:120 000转/分;最新的微立方形旋磨头可以用50 000~70 000转/分的速度)驱动旋磨头以驱动轴长轴方向为轴心开始旋转,借助旋转时产生的离心力,在血管横截面上作轨道运动,并通过手动缓慢(1~10 mm/s的速度,通常1~3 mm/s)操控其前后移动,从而实现对钙化斑块的旋磨。由于旋磨头偏心安装的特点,当旋磨头与斑块接触时,可在不同的轨道上产生旋磨作用,而无病变或弹性较好的血管壁则可弹开偏心的旋磨头,使血管损伤降至最低,最终实现差异性旋磨的目的。旋磨头以一定的速度旋转并且产生离心力,旋转速度越快,产生的离心力越大,形成的轨道越大,修饰斑块和扩大管腔的能力越强[35-37]。
冠状动脉OAS最主要适应证为适合行支架置入术或经皮冠状动脉球囊扩张术的de novo严重钙化病变;此外,由于OAS小的旋磨头设计和可通过调整转速以改变修饰血管的直径,使其操作简便、易行,也被认为可能适用于严重钙化的多支病变、开口病变、分叉病变、无保护左主干病变以及慢性完全闭塞病变[38-39]。
目前认为,冠状动脉OAS的禁忌证同传统的冠状动脉斑块旋磨术类似,主要包括:(1)旋磨导丝不能通过病变;(2)桥血管或支架内病变;(3)血栓性病变;(4)单一冠状动脉供血;(5)造影提示病变部位存在夹层。
3. 5 冠状动脉血管内碎石术(intravscular lithotripsy,IVL)
基于治疗泌尿系结石的碎石理念,人们创新性地研发了一种IVL系统,它在工作原理上区别于传统的钙化病变治疗技术,主要通过在球囊低压扩张时向病变提供未聚焦、圆周和脉冲式的机械能以高效和安全地破坏浅表与深层钙化,从而明显改善血管顺应性,为冠状动脉钙化病变的治疗提供了一种全新选择和有力“武器”,并有望成为冠状动脉钙化病变的“终结者”[40]。目前,欧洲和美国均已批准了Shockwave C2(震波球囊)冠状动脉IVL系统用于钙化病变的治疗。
在冠状动脉IVL系统工作时,首先需要选择大小同参考血管直径1 : 1匹配的球囊导管,在常规工作导丝的辅助下到达钙化病变部位,通过压力泵将球囊加压至4 atm以确保与血管壁紧密贴合;然后激活球囊导管头端的碎石发射器间歇性发放脉冲,从而形成一个短暂爆发的声压波。声压波穿过冠状动脉组织,以有效压力(约50 atm)冲击并破坏钙化病变,最终使得球囊导管上安装的多个发射器在血管内产生声波周向场效应,导致内膜和中膜钙化断裂。一旦每循环10次脉冲完成后,球囊可增大压力至6 atm(命名压力)以增加球囊顺应性,从而通过评估球囊对称膨胀情况来判断钙化病变的修饰效果。
冠状动脉IVL系统适应证为介入治疗前冠状动脉钙化病变的预处理。此外,由于目前认为IVL术较其他技术更为安全、有效和简便,其在更具挑战性钙化病变中使用的病例报告数量也在不断增加,主要包括急性冠状动脉综合征、无保护左主干、慢性完全闭塞病变和支架膨胀不全等。此外,IVL术不仅对浅表钙化有作用,而且也是唯一对深层钙化有治疗作用的技术[41-43]。
冠状动脉IVL术的禁忌证同其他钙化病变处理术有类似之处,主要包括:(1)导丝或IVL球囊不能通过病变;(2)桥血管病变;(3)血栓性病变;(4)单一冠状动脉供血;(5)造影提示病变部位存在夹层。
3. 6 冠状动脉旁路移植术
对于严重钙化病变估计常规PCI困难同时合并下列情况时,可考虑选择冠状动脉旁路移植术治疗。(1)血栓性或溃疡性病变;(2)严重的成角病变>60°,尤其是成角>90°;(3)有明显内膜撕裂的病变;(4)弥漫性病变,病变长度>25 mm;(5)严重左心功能降低者;(6)导丝不能通过的慢性完全闭塞严重钙化病变。
4 结语
冠状动脉钙化病变在冠心病患者中普遍存在,如果存在严重的钙化病变,冠状动脉介入治疗的手术难度增加,与手术相关的风险增加。对于钙化病变的诊断,冠状动脉CTA、IVUS、OCT等检查都具有较好的敏感性和特异性。冠状动脉钙化病变的治疗策略中,对于严重钙化病变使用冠状动脉斑块旋磨术联合支架置入具有较好的即刻和远期效果。建议介入心脏病学医师首先要正确识别和评估钙化病变,在有条件的医院尽量用IVUS/OCT评价钙化病变,掌握不同程度钙化病变的治疗策略,认真了解冠状动脉斑块旋磨术的适应证和禁忌证,熟练掌握旋磨术相关器械的操作流程,掌握旋磨术相关并发症的预防和治疗措施。对于轻、中度钙化病变,常规PCI仍然是主要治疗手段;切割球囊对轻、中度钙化病变具有一定价值,但目前临床研究的证据相对较少。同时,ELCA、冠状动脉OAS、冠状动脉IVL等新技术逐渐开始应用于临床,将成为钙化病变介入治疗的新选择。
写作组成员(按姓氏汉语拼音排序):曹成富(北京大学人民医院),李琪(北京大学人民医院),马玉良(北京大学人民医院)
共识专家组(按姓氏汉语拼音排序):陈方(清华大学附属北京垂杨柳医院),陈纪言(广东省人民医院),陈韵岱(解放军总医院第一医学中心),方唯一(复旦大学附属华东医院),傅国胜(浙江大学医学院附属邵逸夫医院),高炜(北京大学第三医院),葛均波(复旦大学附属中山医院),葛雷(复旦大学附属中山医院),郭丽君(北京大学第三医院),韩雅玲(解放军北部战区总医院),洪涛 (北京大学第一医院),霍勇(北京大学第一医院),贾绍斌(宁夏医科大学总医院),姜铁民(武警医学院附属医院),荆全民(解放军北部战区总医院),黎辉(大庆油田总医院),李国庆(新疆维吾尔自治区人民医院),李建平(北京大学第一医院),刘健(北京大学人民医院),吕树铮(首都医科大学附属北京安贞医院),马依彤(新疆医科大学第一附属医院),钱菊英(复旦大学附属中山医院),乔树宾(中国医学科学院阜外医院),王建安(浙江大学医学院附属第二医院),王乐丰(首都医科大学附属北京朝阳医院),王伟民(北京大学人民医院),魏盟(上海市第六人民医院),温尚煜(天津市第四中心医院),吴永健(中国医学科学院阜外医院),杨庭树(解放军总医院第一医学中心),张大东(上海远大心胸医院),张福春(北京大学第三医院),张抒扬(中国医学科学院北京协和医院),张钲(兰州大学第一医院),周玉杰(首都医科大学附属北京安贞医院)

