钠离子通道相关基因突变致儿童癫痫 17例的临床特征及致病基因谱
何娟 ,戴园园 ,2
作者单位:1 徐州医科大学研究生学院,江苏 徐州 221004;2 徐州医科大学附属医院儿科,江苏 徐州 221000
癫痫作为神经系统常见疾病之一,其发病原因多种多样,包括遗传因素、脑部疾病、全身性或系统性疾病等,随着对遗传学的认识逐渐提高,越来越多的发现表明离子通道相关基因突变与癫痫的发生密不可分。其中编码钠离子通道蛋白的基因突变是特发性癫痫最为常见的原因,常见突变基因有 SCN1A、SCN2A、SCN1B、SCN8A、SCN9A 等。本研究对 17例通过靶向捕获二代测序发现钠离子通道相关基因可疑致病性突变,并经 Sanger 测序验证基因突变来源的病儿的临床资料进行总结分析,旨在探讨钠离子通道相关基因突变所致癫痫的临床特征,并丰富其致病基因谱。
1 资料与方法
1.1 一般资料
回顾性分析 2017年 6月至 2019年10月就诊于徐州医科大学附属医院儿科,通过靶向捕获二代测序发现钠离子通道相关基因可疑致病性突变,并经 Sanger 测序验证基因突变来源的病儿。1.2 方法
对入选病儿及其亲属建立临床资料登记表,包括性别、起病年龄、发作类型、围生期情况、既往史、智力及运动发育情况、用药史、家族史等,每 3 个月进行 1 次门诊或电话随访。对所有病儿的临床表现、脑电图和头颅影像学等资料进行分析及总结。病儿监护人或其近亲属对病儿所受治疗知情同意,本研究已通过徐州医科大学附属医院伦理委员会的批准(XYFY2020-KL093-01)。1.3 诊断标准
依据2017年国际抗癫痫联盟(ILAE)癫痫的分类对病儿癫痫发作类型、癫痫类型(局灶性、全面性、全面性及局灶性两者兼有、未知)以及癫痫综合征进行分类。1.4 抗癫痫药物的疗效
分为 4 种:控制(至少 3 个月无发作)、减少(发作次数减少≥25%)、无效(发作次数减少<25%)和加重,控制或减少为有效。2 结果
2.1 钠离子通道基因突变结果
共收集到 17例钠离子通道基因突变癫痫病儿,其中男 7例、女 10例。共检测到 5 种不同类型的钠离子通道基因杂合突变,分别为 SCN1A、SCN1B、SCN2A、SCN8A、SCN9A。其中 SCN1A 8例(Genbank 序列号 :例6、8、17 NM_001202435,例1、2、5、13 NM_001165963,例4 NM_00116595),SCN1B 1例(例9 Genbank 序 列号 NM_199037.3),SCN2A 5例(Genbank 序列号:例11、12、14 NM_021007,例10、13 NM_0014040142),SCN8A 1例(例15 Genbank 序 列 号 NM_014191),SCN9A 2例(例16、17 Genbank 序列号 NM_002977)。除 3例SCN1A 基因突变位点(c.4633A>G、c.5348C>T、c.2837G>A)已报道,其余 14 种为新发现的突变。17例中 9例为遗传性突变,其余 8例为新生突变。依据美国医学遗传学与基因组学学会遗传变异分类标准与指南,17例病儿中 16例提示致病,1例(c.-18A>C∕-)提示意义不明。基因结果分析见表1。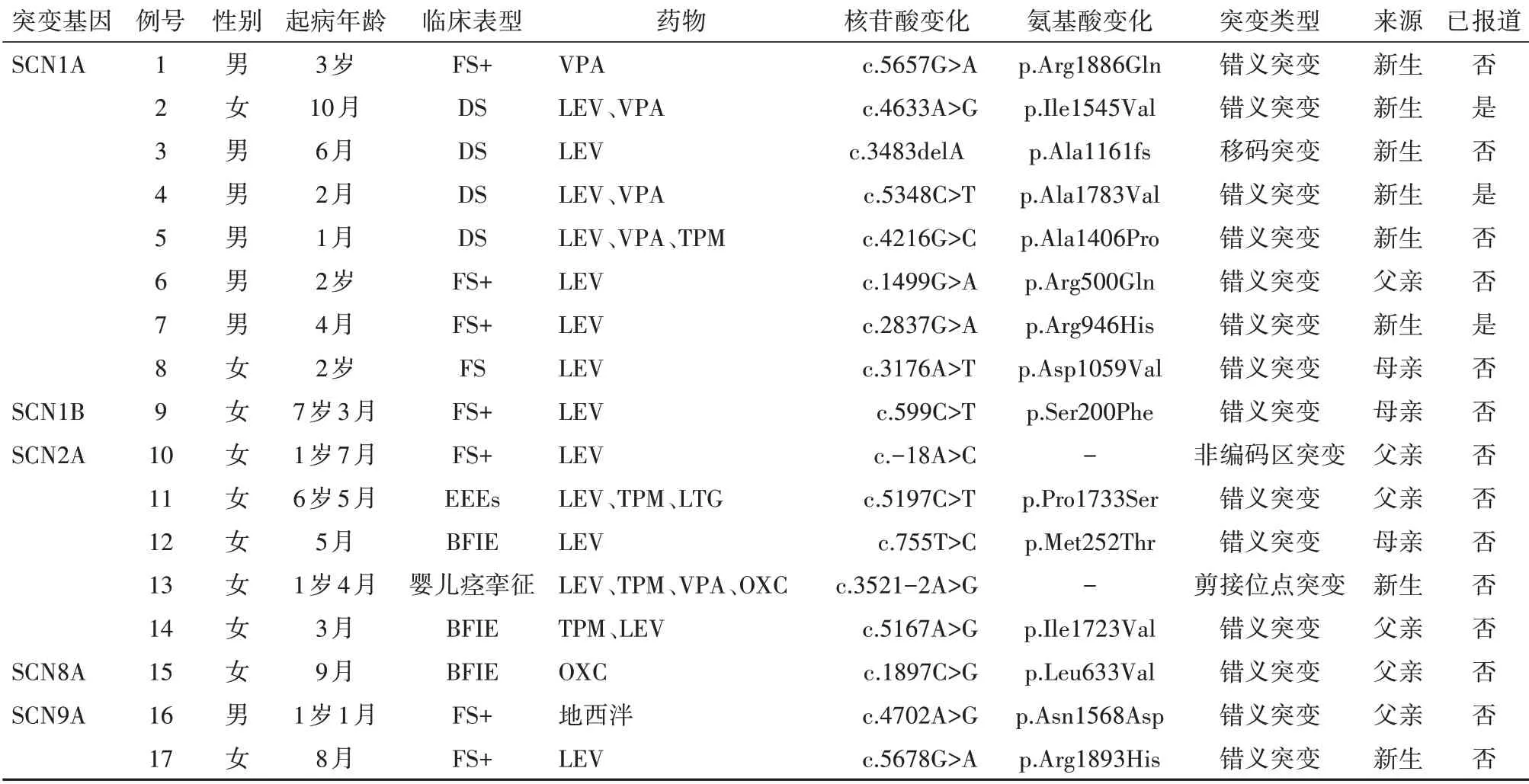
表1 钠离子通道相关基因突变病儿 17例的基因结果分析
2.2 临床表型特点
2.2.1 SCN1A 基因突变病儿临床表型特点 8例病儿起病年龄为 1月至 3岁,其中 1~6月龄起病 4例,7月龄至 1岁起病 1例,>1岁起病 3例。8例病儿中 4例诊断为 Dravet 综合征 ,3例为热性惊厥附加症(FS+),1例为热性惊厥。8例均表现为全面发作或部分继发全面性发作;例5 曾有发热时诱发的癫痫持续状态。例4、例5 病儿有智力、运动发育落后,其余病儿智力、运动发育正常。8例病儿血、尿代谢筛查均未见明显异常。8例病儿均至少进行过 1 次视频脑电图(VEEG)检查。发作间期脑电图1例为正常儿童脑电图,5例可见稍多量-多量散在棘波、棘慢波(放电可局限于一侧或双侧额、中线区或中央、顶、中线区),2例可见广泛性及多灶性痫样放电。8例病儿头颅 MRI 中 3例(例1、4、5)病儿出现双侧额叶脑沟稍增宽伴脑外间隙增宽,1例(例8)胼胝体膝部小腔隙灶,余 4例均未见明显异常。8例病儿均予抗癫痫药物治疗,经门诊或电话随访,随访时间 6~24 个月。其中 3例(例2、4、5)联合用药无效,1例(例5)因癫痫持续状态死亡;剩余 5例单药治疗可控制 。 2例为家族遗传性突变(例6 c.1499G>A ∕p.Arg500Gln- 父 源 、例8 c.3176A>T∕p.Asp1059Val- 母源),伴发作性疾病史,余 6例为新生突变。其中 7例为错义突变(c.5657G>A、c.4633A>G、c.5348C>T、c.4216G>C、c.1499G>A、c.2837G>A、c.3176A>T),1例为移码突变(c.3483delA)。3例(例2、4、7)携带变异为国际已报道变异(c.4633A>G、c.5348C>T、c.2837G>A),余 5例为未报道的新突变。见表1。
2.2.2 SCN1B 基因突变病儿临床表型特点 1例SCN1B 基因突变病儿起病年龄为 7岁 3月龄,发作表现为双眼上翻,牙关紧闭,四肢僵直、抖动,持续 1 min 左右,表型为 FS+,病儿智力、运动发育正常,血、尿代谢筛查及头颅 MRI 均未见明显异常。其母 2~3岁时有高热惊厥史,未服用抗癫痫药物,6~7岁发作自行缓解。发作间期脑电图初期为左侧 Rolandic 区大量棘波、棘慢波发放,予抗癫痫药物单药治疗,随访时间 18 个月,服药后发作可控制且脑电图放电减少 。 为 来源于母亲的未报道的错义突变(例9 c.599C>T∕p.S200F)。见表1。
2.2.3 SCN2A 基因突变病儿临床表型特点 5例病儿起病年龄 3月至 6岁 5月龄,其中 1~6月龄起病 2例,>1岁起病 3例。5例病儿中 2例诊断为良性家族性婴儿癫痫(BFIE)(例12、14),1例为 FS+(例10),1例为婴儿痉挛征(例13),1例诊断为早发癫痫性脑病(EEEs)(例11),5例均表现为全面发作或部分继发全面性发作。例11、例13 病儿有智力、运动发育落后。5例病儿血、尿代谢筛查均未见明显异常。发作间期脑电图1例(例12)为正常儿童脑电图,1例(例14)可见额、中线区稍棘波、尖波发放,1例(例10)可见枕、后颞区棘波、棘慢波发放(放电可局限于一侧或双侧),2例(例11、13)可见广泛性及多灶性痫样放电,其中例11 监测到肌阵挛发作 1 次。5例病儿头颅 MRI 中 1例(例13)可见双侧侧脑室扩大,海马体积稍小,两侧额颞部脑外间隙增宽,余未见异常。均予抗癫痫药物治疗,随访时间 6~24 个月,3例为联合用药,其中 2例(例11、13)无效,1例(例14)服药后发作可控制;剩余 2例(例10、12)单药治疗服药后发作可控制。5例SCN2A 基因突变中1例为非编码区突变(例10 c.-18A>C∕-),3例错义突变(例11 c.5197C>T∕p.Pro1733Ser、例12 c.755T>C∕p.Met252Thr、例14 c.5167A>G∕p.Ile1723Val),1例剪接位点突变(例13 c.3521-2A>G∕-),均为未报道的杂合突变,4例为家族遗传性突变(例10、11、12、14),其父母一方携带相同致病基因,伴发作性疾病史,1例(例13)为新生突变。
2.2.4 SCN8A 基因突变病儿临床表型特点 1例SCN8A 基因突变病儿起病年龄为 9月龄,发作表现为双眼上翻,口唇抖动,牙关紧闭,四肢强直、抖动,呼之不应,面色青紫,表型为 BFIE,病儿智力、运动发育正常,血、尿代谢筛查及头颅 MRI 均未见明显异常。其父亲、大伯及姑姑幼时均有抽搐史,临床表现与病儿相似,口服抗癫痫药物治疗,后未再发作。发作间期脑电图初期为睡眠期双侧额区及额中线区棘慢波发放,双侧颞区棘波、尖波、棘慢波发放,予抗癫痫药物单药治疗服药后发作可控制,随访 6 个月,半年后复查脑电图为睡眠期双侧额、中央及中线(Fz)区棘波、尖波发放。为来源于父亲的未报道的错义突变(例15 c.1897C>G ∕p.Leu633Val)。见表1。
2.2.5 SCN9A 基因突变病儿临床表型特点SCN9A 2例,起病年龄分布为 8月龄及 1岁 1月龄,表型均为 FS+,发作间期脑电图均为一侧或双侧额、中线区棘波、尖波发放。随访时间 9~12 个月,1例(例17)予抗癫痫药物单药治疗服药后发作易控制,1例(例16)仅于发热初期口服地西泮后未再发作。2例SCN9A 为未报道的错义突变(例16 c.4702A>G∕p.Asn1568Asp、例17 c.5678G>A∕p.Arg1893His),其中 1例(例16)为家族遗传性突变,其父幼年时曾有热性惊厥史抽搐史,未予治疗,3~4岁后未再发作,且携带相同致病基因 ,1例(例17)为新生突变 。见表1。
3 讨论
钠离子通道包括 9 个 α 亚基和 4β 个亚基,其中编码人的电压门控性钠离子通道亚单位 α1、α2、β 1、α6 和 α9 的 基因分别 为 SCN1A、SCN2A、SCN1B、SCN8 和 SCN9A。不同的基因突变能够导致不同程度且多种形式的癫痫发作。
SCN1A 位于染色体 2q24 上,包含 26 个外显子,并编码 Nav1.1 亚型。Nav1.1 与许多中枢神经系统疾病有关,例如癫痫,自闭症,焦虑症,情感障碍和偏头痛。2000年 Escayg 等首次报道在全面性癫痫伴热性惊厥附加症(Generalized epilepsy with febrile seizure plus,GEFS+)家系中发现 SCN1A 基因突变。随着人们对 SCN1A 基因的不断认识,越来越多的 SCN1A 突变被报道,不同的突变位置、类型等所致疾病也不尽相同,轻者如 GEFS+、部分性癫痫伴热性惊厥 附 加 征(Partial epilepsy with febrile seizures pius,PEFS+),重者如婴儿重症肌阵挛性癫痫(又 称 Dravet 综合征)均有发现 。 本研究 8例SCN1A 基因突变病儿中 4例诊断为 Dravet 综合征,3例为 FS+,1例为热性惊厥。SCN1A 基因变异分为遗传性变异或新生变异,8例病儿中 2例为遗传性变异,6例为新生变异。其中例5 病儿为 SCN1A 基因新生错义突变,表型为 Dravet 综合征,因癫痫持续状态而死亡。且越来越多的遗传学研究表明,表型较重的 Dravet 综合征以 SCN1A 错义突变和蛋白截断突 变(包括无义突变和移码突变)为主 。 田 小 娟等通过对 547例Dravet 综合征病儿 SCN1A 基因突变与遗传特点研究也证实了这一点,研究表示 Dravet 病儿 SCN1A 基因突变阳性率高,突变类型以错义突变和截断突变为主,Dravet 病儿 SCN1A 基因突变以新生突变为主。本研究除 3例携带变异为国际已报道变异(例2 c.4633A>G∕p.Ile1545Val、例4 c.5348C>T∕p.Ala1783Val、例7 c.2837G>A∕p.Arg946His),余 5例(例1 c.5657G>A∕ p.Arg1886Gln,例3 c.3483delA∕p.Ala1161fs,例5 c.4216G>C∕p.Ala1406Pro,例6 c.1499G>A∕p.Arg500Gln,例8 c.3176A>T∕p.Asp1059Val)未报道的新发突变位点,加深了我们对 SCN1A 基因相关癫痫临床表型的认识,拓展了 SCN1A 的突变位点谱。
SCN2A 基因位于染色体 2q24.3,编码钠离子通道 α2 亚基,研究发现该基因与神经系统的发育密切相关,自从 2001年首次发现并确认了 SCN2A 基因突变导致良性家族性新生儿/婴儿惊厥[B(F)NIS]以来,随着人们对 SCN2A 基因突变所致癫痫疾病谱不断认识及扩大,SCN2A 基因不仅可以导致癫痫发作,还可导致发育落后、孤独症、精神分裂症以及周期性共济失调等,以及多种癫痫综合征或癫痫性脑病。本研究例12、例14 病儿表型较轻为 BFIE,均为错义突变且为家族遗传性突变(例12 c.755T>C∕p.Met252Thr- 母 源 、例14 c.5167A>G∕p.Ile1723Val- 父源),其父母一方携带相同致病基因,伴发作性疾病史 。 另 1例表型较轻的病儿(例10)为 FS+ ,其SCN2A 基因突变虽为非编码区突变,但该突变基因来自与病儿父亲,且其父亲 6岁前曾有高热惊厥数次,与病儿表型相似,此杂合突变符合疾病显性遗传模式,非编码区虽不能编码蛋白质,但其对遗传信息的表达不可缺少,且具有调控遗传信息表达的核苷酸序列,具有遗传效应,故不排除此非编码区突变(c.-18A>C∕-)是一个功能性突变,有待进一步验证。剩余两例表型较重的病儿,例11 为来源于父亲的错义突变(c.5197C>T∕p.Pro1733Ser),病儿发病年龄较晚,抗癫痫药物控制不佳,且伴智力、运动发育落后,例13 为新生的剪接位点突变(c.3521-2A>G∕-),病儿 1岁 4月龄发病,联合多种抗癫痫药物治疗仍抽搐频繁,且伴智力、运动发育落后。而 Begemann 等研究发现由新的截短或错义突变引起的通道功能丧失是导致表型较重的癫痫的基本机制,良性癫痫通常是由于遗传性的错义突变导致,而癫痫性脑病是由于错义变异引起的深刻而持久的门控变化的结果。国内学者也证实了这一观点,表示 SCN2A 基因突变导致的癫痫表型谱广,既可表现为良性预后的癫痫,也可表现为预后较差的癫痫性脑病,SCN2A 基因突变所致癫痫多为错义突变,其他包括移码突变、无义突变较为少见。新生突变的病儿表型常较重,多伴有智力、运动发育落后,轻型癫痫大多与遗传性错义突变有关。
SCN1B 作为第一个被发现与癫痫相关的钠离子通道基因 ,在 1998年 由 Wallace 等在 一 个GEFS+ 家系中发现并将基因位点定位与染色体19q13.1。随着遗 传学的不 断 发展,在 GEFS+家系中,SCNIB 基因突变相继被发现。国内学者李建华等在 2 个 GEFS+家系中在 SCNlB 基因外显子 3 发现 2 个新的杂合多态性(G181A)、(G15A);在 SCNIB基 因外显子6发现2个新的杂合多态性(T37C)、(A81C)。本研究 1例SCN1B 基因突变病儿表型为FS+,突变为来源于母亲的杂合突变,且为未报道的错义突变(c.599C>T∕p.Ser200Phe)。此突变丰富了单核苷酸多态性(SNP)数据库,为癫痫易感多态位点的研究提供了候选位点。
编码 α 亚单位 Nav1.6 的 SCN8A 在中枢神经系统中高表达,自 2012年被鉴定为癫痫相关基因以来,研究发现 SCN8A 基因突变相关癫痫发作形式多样,可表现为全身强直-阵挛发作、痉挛发作、失神和局灶性发作等,也可表现为多种癫痫综合征如可表现为 BFIE,也可表现为多种癫痫性脑病如 Lennox-Gastaut 综合征、West 综合征等,SCN8A 基因突变除可导致癫痫发作外,还可影响病儿的语言、智力和发育水平。本研究 1例SCN8A 基因突变病儿起病年龄为 9月龄,表现为部分继发全面发作,表型为BFIE;予抗癫痫药物单药治疗服药后发作可控制,脑电图放电减少。 SCN8A 基因突变为错义突变(c.1897C>G∕p.Leu633Val)。 我院尚未发现与SCN8A 基因突变相关的癫痫性脑病,考虑与病源少、病种单一有关。
SCN9A 在染色体 2q24.3 上包含 27 个外显子,并编码电压门控钠通道 NaV1.7 的 α 亚基。SCN9A 最初被分类为周围神经系统通道基因,后来报道了NaV1.7 在大脑中的表达,特别是在胚胎海马中的表达,表明其在中枢神经系统中的作用。目前发现的 SCN9A 突变大多与热性惊厥相关。目前对于SCN9A 基因突变导致癫痫发病的报道少,本研究中2例SCN9A 基因突变病儿,表型均为 FS+,1例仅于发热初期口服地西泮后未再发作,另外 1例予抗癫痫药物单药治疗服药后发作可控制。2例SCN9A 均为错义突变(例16 c.4702A>G∕p.ASN1568Asp、例17c.5678G>A∕p.AArg1893His),其中 1例为家族遗传性突变,1例为新生突变。但是由于标本量小,标本采集地域局限,本研究仅能对 SCN9A 基因突变引发癫痫在病因学上做补充,还有待深入研究,进一步探索 SCN9A 基因突变与癫痫的关系。
本研究 17例钠离子通道基因杂合突变病儿中,共检测到 5 种基因突变,其中 SCN1A 8例(47.06%),SCN2A 5例(29.41%),SCN1B 1例(5.88%),SCN8A 1例(5.88%),SCN9A 2例(11.77%);涉及多种突变类型,其中错义突变 14例(82.36%),非编码区突变 1例(5.88%),剪接位点突变 1例(5.88%),移码突变 1例(5.88%);遗传性突变 9例,新生突变 8例。提示钠离子通道基因突变以 SCN1A 基因突变多见共 8例,突变率达 47.06%,突变类型以错义突变为主共14例(82.36%)。目前 SCN1A、SCN2A 作为钠离子通道基因多态性研究的热点基因,我们对其在特发性癫痫发病机制中认识不断加深,而 SCN1B、SCN8A、SCN9A 基因突变导致癫痫发病的报道相对较少,因此我们在临床工作中需不断的积累病例,努力探索与发现其与癫痫的关系。目前国内外对于癫痫的治疗主要以药物为主,而电压门控性钠离子通道是抗癫痫药物的常用靶点,目前研究发现钠离子通道阻滞剂是治疗 SCN2A 基因突变导致的早期癫痫性脑病的主要药物,但本研究 5例SCN2A 基因突变病儿中,2例予钠离子通道阻滞剂(拉莫三嗪或奥卡西平)联合左乙拉西坦等抗癫痫药物治疗,效果仍不满意,考虑与病儿临床表型较重,或早期病因诊断不明确未及时用药,或与突变导致电压门控性钠离子通道的结构或功能的改变而导致药物抗性的出现有关。同时研究发现,对于 SCN1A 突变的病人,尤其是 DS,拉莫三嗪、奥卡西平等钠离子通道阻滞剂可因阻滞抑制性神经元的功能,从而进一步加重癫痫的发生。而本研究 8例SCN1A 基因突变病儿中表型较轻者采用左乙拉西坦或丙戊酸钠等广谱抗癫痫药物单药治疗发作可控制,表型较重者如DS 病儿多药联合治疗仍无效,目前 VPA、托吡酯为治疗 DS 的一线用药,可联合氯巴占(CLB)、司替戊醇(STP)、左乙拉西坦 、氯硝西泮等作为添加治疗,但大多数 DS 病人并不会得到完全控制;由于目前有关 SCN1B、SCN8A、SCN9A 基因突变导致癫痫发病的报道较少,我院此类病儿表型均较轻,采用左乙拉西坦等广谱抗癫痫药物治疗服药后发作可控制,因此我们仍需不断探索,寻求更为合适的治疗方法。而钠离子通道基因突变可导致药物作用靶点发生结构或功能变化,同时基因突变还存在表型异质性,因此根据突变基因选择抗癫痫药物仍面临着巨大的挑战。
随着分子遗传学的研究进展,钠离子通道相关致病基因逐渐被认识,相关的癫痫表型谱较广,如本研究 17例病儿涉及的癫痫综合征有 FS+、热性惊厥、Dravet 综合征、BFIE、婴儿痉挛综合征等。不同基 因导致的临床表型可相同 ,如 SCN1A、SCN1B、SCN9A 均可导致 FS+;而相同基因可导致轻重不同的临床表型,如本研究中 SCN1A 基因突变轻者可导致 FS+,抗癫痫药物单药治疗服药后发作易控制,重者导致 Dravet 综合征,病儿联用 3 种抗癫痫药物治疗仍死亡。综上可知临床表型的轻重可能与变异所在的位点和类型相关,也可能与遗传方式相关。因此,对可疑病例尽早进行基因突变检测,有助于早期明确诊断,指导临床用药,可进一步实现个体化诊断及精准治疗。

