99mTc-MDP SPECT/CT融合显像联合碱性磷酸酶诊断肺癌骨转移的价值研究
鲍彩丽, 刘 艳,卢 蕾,倪仕同,李建杰,侯仁花△
1.同济大学附属杨浦医院 核医学科(上海 200090);2.同济大学附属杨浦医院 检验科(上海 200090)
肺癌是全球发病率及死亡率最高的恶性肿瘤,2018年全球癌症报告[1]显示,肺癌新发病例209.4万,占新发癌症的11.6%;死亡病例176.1万,占癌症死亡人数的18.4%。肺癌也是我国发病率及病死率最高的恶性肿瘤,临床研究[2]发现,肺癌骨转移发生率较高,约30%~40%,不同病理类型发生转移的时间也不尽相同。骨转移的临床表现早期较为隐匿,发展至晚期才出现骨痛、病理性骨折等表现[3]。早期诊断肺癌骨转移对确定肺癌分期、制定治疗方案及判断预后均有较高价值。碱性磷酸酶(alkaline phosphatase,ALP)是一种成骨细胞分泌的水解酶,研究[4]表明,其诊断肺癌骨转移的灵敏度较差,但特异度较高。99mTc-MDP SPECT/CT融合显像可发挥出SPECT与CT各自的优势,一次显像即可将功能、代谢情况与局部解剖信息同时呈现[5]。有研究[6]显示,99mTc-MDP SPECT/CT鉴别良恶性病变的效能较好,其诊断肺癌骨转移的灵敏度与特异度均可达到80%以上。目前,临床研究[7-8]报道,SPECT/CT和肿瘤标志物联合诊断能提高肺癌骨转移诊断效能,SPECT/CT断层融合显像联合血清某些肿瘤标志物诊断非小细胞肺癌骨转移的发生具有较高的灵敏度、特异度、准确率,在临床工作中具有一定的应用价值;也有研究[9]报道,SPECT和ALP联合诊断肺癌骨转移血清ALP水平与骨显像分级呈正相关,但无SPECT/CT与ALP联合诊断的研究。鉴于ALP的特异度较高,且患者检测成本低、常规纳入体检范围内,本研究将99mTc-MDP SPECT/CT融合显像和血清ALP的联合诊断效能做一回顾性分析,为临床早期诊断肺癌骨转移提供参考。
1 资料与方法
1.1 临床资料
回顾性分析同济大学附属杨浦医院2018年3月至2020年3月收治的经病理检查证实为肺癌的360例患者的临床资料。纳入标准:1)诊断符合2018年肺癌临床诊疗标准[10];2)年龄>18岁;3)患者均行99mTc-MDP SPECT/CT融合显像检查与血清ALP检测;4)患者在检查前未确诊有无骨转移情况;5)患者最终病历资料明确诊断有无骨转移情况。排除标准:1)合并其他恶性肿瘤;2)临床资料缺失患者;3)肝胆疾病者; 4)既往行化疗、放疗、内分泌治疗; 5)合并甲状腺、糖尿病、风湿等疾病;6)3个月内服用激素类药物、双磷酸盐等影响骨代谢药物者; 7)1年内出现外伤性骨折或合并代谢性骨病患者。360例肺癌患者,病理报告显示最终诊断为小细胞肺癌94例,男57例,女37例,年龄35~89(57.1±8.7)岁;非小细胞肺癌266例,男174例,女92例,年龄38~91(62.2±11.3)岁。发生骨转移的肺癌中,小细胞肺癌51例,非小细胞肺癌191例;男158例,女84例,年龄37~91(60.4±10.3)岁。肺癌骨转移患者(n=242)与肺癌无骨转移患者(n=118)在性别(2=0.142,P=0.709)、年龄(2=0.102,P=0.977)方面比较,差异无统计学意义,具有可比性。
1.2 方法
1.2.199mTc-MDP SPECT/CT融合显像方法99mTc-MDP SPECT/CT融合显像采用美国通用电气公司生产的Discovery NM/CT 670设备及其配套软件。SPECT显像[11]:患者静脉注射99mTc-MDP 740 MBq,嘱其2 h内喝水1 L,并于2~3 h排尿后进行全身静态骨显像。采用高分辨率型准直器,窗宽20%,能峰140 keV,矩阵256×1 024,扫描速度15~20 cm/min,双探头平行自动采集患者前后位全身骨显像图像。当骨显像为疑似病灶时,进行SPECT局部断层显像,矩阵128×128,20 s/帧,连续收集360°。SPECT图像采集完后,对疑似病灶行CT检查,CT采集条件:120 kV,150 mA,视野500 mm,层厚5 mm。使用其配套软件将SPECT图像与CT图像进行同机融合。
1.2.2 图像分析及诊断标准 所有图像由1名核医学医师和1名经验丰富的主任医师采用双盲法阅片。全身骨显像诊断肺癌骨转移阳性的标准[12]:1)全身多部位、非对称性放射性浓聚、减低或缺损;2)在骨关节之外的区域,如肋骨、四肢骨、骨盆等部位出现长条或团块状放射性集聚;3)随访期复查显示,疑似病灶部位的放射性浓聚增强,或放射性浓聚部位增多。诊断肺癌骨转移阴性的标准:1)未出现放射性浓聚或缺损表现;2)放射性浓聚、减低或缺损部位位于骨折部位、手术区域;3)骨关节部位的对称性浓聚。
99mTc-MDP SPECT/CT融合显像诊断肺癌骨转移阳性的标准[13]:1)SPECT显影表现为单发或多发的异常放射性浓聚或缺损,CT表现为融骨或成骨性破坏,可伴或不伴软组织影,排除手术、骨折、骨质增生等病变;2)SPECT显影表现为单发或多发的异常放射性浓聚或缺损,CT检查未发现骨质及软组织异常影像,排除手术、骨折、骨质增生等病变。诊断肺癌骨转移阴性的标准:1)SPECT显影表现为手术、骨折部位的异常放射性浓聚或缺损,CT检查未发现骨质及软组织异常影像;2)SPECT显影表现为单发或多发的异常放射性浓聚或缺损,CT检查显示该病变为外伤性骨折、骨良性肿瘤或骨退行性病变。
1.2.3 血清ALP检测 嘱患者禁食8 h以上,于第2天清晨空腹状态下抽取患者外周静脉血5 mL,离心机3 500 r/min,离心半径16 cm,离心10 min,分离得到血清,采用全自动生化分析仪及其配套试剂,按照操作规范,检测样本中ALP的浓度。正常参考值为38~126 U/L,>126 U/L表示ALP检测阳性。
1.2.4 联合检测99mTc-MDP SPECT/CT融合显像与血清ALP有1项为阳性,则联合检测结果为阳性;99mTc-MDP SPECT/CT融合显像与血清ALP均为阴性,则联合检测结果为阴性。
1.3 诊断金标准
最终诊断患者有无骨转移主要根据病灶活检或手术切除组织的病理学结果,或经随访,多种影像学检查(CT、MRI、PET/CT等)证实病灶进行性发展[14]。按照骨转移病灶的数目分为4组,M0代表无转移,M1代表1~2个,M2代表3~5个,M3代表>5个。
1.4 统计学方法

2 结果
2.1 最终诊断结果
360例肺癌患者最终诊断为肺癌骨转移242例,无骨转移118例。病理报告显示,小细胞肺癌94例,非小细胞肺癌266例;发生骨转移的肺癌中,小细胞肺癌51例,非小细胞肺癌191例。按照转移灶分组,M0组118例,M1组39例,M2组27例,M3组176例。
2.2 不同病理类型肺癌骨转移发生情况
非小细胞肺癌组骨转移发生率高于小细胞肺癌组,差异有统计学意义(P<0.05);非小细胞肺癌组与小细胞肺癌组发生骨转移数目为1~5个的患者比例差异无统计学意义(P>0.05);非小细胞肺癌组骨转移数目>5个患者比例高于小细胞肺癌组,差异有统计学意义(P<0.05)(表1)。

表1 不同病理类型肺癌骨转移发生情况比较[n(%)]
2.3 骨转移与未转移肺癌患者血清ALP水平比较
发生骨转移肺癌患者的血清ALP平均水平为298.16 U/L,无骨转移肺癌患者血清ALP平均水平为107.45 U/L,二者比较,差异有统计学意义(P<0.05)(表2)。

表2 骨转移与未转移肺癌患者血清ALP水平比较[M(P25,P75)]
2.4 血清ALP与肺癌骨转移数目的相关性分析
对血清ALP与肺癌骨转移数目行Spearman相关分析,结果显示,血清ALP与肺癌骨转移数目呈正相关(r=0.574,P<0.05)(表3)。

表3 不同骨转移灶分组患者血清ALP水平比较[M(P25,P75)]
2.5 99mTc-MDP SPECT/CT融合显像和血清ALP单独及联合检测的诊断价值比较
99mTc-MDP SPECT/CT融合显像联合血清ALP诊断肺癌骨转移的灵敏度、准确度、阴性预测值高于血清ALP,差异有统计学意义(P<0.05);99mTc-MDP SPECT/CT融合显像联合血清ALP诊断肺癌骨转移的准确率、阴性预测值高于99mTc-MDP SPECT/CT融合显像,差异有统计学意义(P<0.05)(表4~7)。进一步绘制并分析ROC曲线可知,当血清ALP截断值取215.50 U/L时,血清ALP诊断肺癌骨转移的AUC为0.784,99mTc-MDP SPECT/CT融合显像诊断肺癌骨转移的AUC为0.825,二者联合诊断肺癌骨转移的AUC为0.904,此时灵敏度为91.4%,特异度为82.5%,诊断效能最好(图1)。肺癌患者骨转移的99mTc-MDP SPECT/CT融合显像示例见下图(图2)。

表4 血清ALP诊断肺癌骨转移情况

表5 99mTc-MDP SPECT/CT融合显像诊断肺癌骨转移情况

表6 99mTc-MDP SPECT/CT融合显像联合血清ALP诊断肺癌骨转移情况
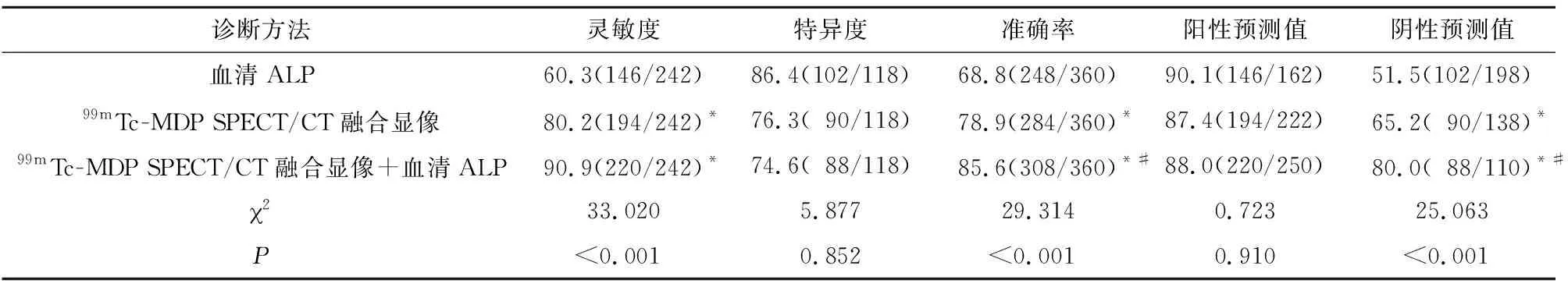
表7 99mTc-MDP SPECT/CT融合显像和血清ALP单独及联合检测的诊断价值比较(%)
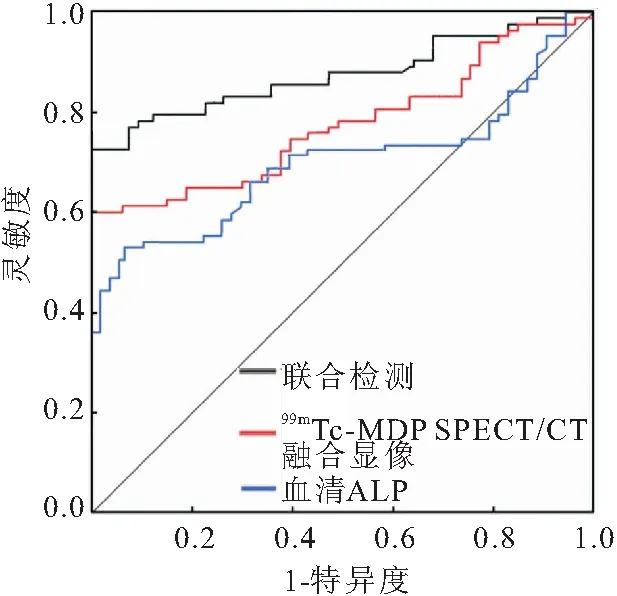
图1 99mTc-MDP SPECT/CT融合显像和血清ALP单独及联合检测诊断肺癌骨转移的ROC曲线

图2 肺癌骨转移患者99mTc-MDP SPECT/CT融合显像图例
3 讨论
肺癌是我国发病率与死亡率最高的恶性肿瘤,骨是肺癌转移发生率较高的部位之一。本研究结果显示,99mTc-MDP SPECT/CT融合显像显示非小细胞肺癌骨转移发生率高于小细胞肺癌。进一步分析发现,其差异主要集中在转移数目>5个病灶患者比例上,说明非小细胞肺癌更易发生全身多发性骨转移,提示当临床诊断为非小细胞肺癌时,需特别注意筛查骨转移可能。肺癌骨转移引发的骨相关事件如病理性骨折、高钙血症、骨痛等,可严重降低患者生存质量,缩短患者生存期,严重影响患者预后[15]。因而,早期确诊骨转移对判断临床分期以制定适宜的治疗方案十分重要,早期干预也可改善患者生存质量、延长患者生存期从而改善预后[16]。
ALP主要存在于骨骼、肝脏、肾脏中,由成骨细胞产生并释放入血。本研究发现,骨转移患者血清ALP水平高于无转移患者,且将转移灶按数目进行分组后,从M0~M3,血清ALP水平逐渐升高,进一步行相关性分析显示,转移灶分组与血清ALP呈正相关,与上述研究一致。肺癌骨转移诊疗专家共识(2019版)[17]中指出,建议使用血清ALP作为骨代谢的生物化学指标,其他指标并不推荐使用。血清ALP在多种恶性肿瘤骨转移诊断时体现出较好的效能,且其为常规检查项目,检测操作简单,费用低,患者易接受。
以上分析基于99mTc-MDP SPECT/CT融合显像和ALP水平分别诊断骨转移的临床价值,但99mTc-MDP SPECT/CT融合显像联合血清ALP诊断肺癌骨转移时,99mTc-MDP SPECT/CT融合显像灵敏度较高,血清ALP特异度较高,当血清ALP截断值取215.50 U/L,二者联合检测可使AUC最大,达到最佳诊断效能。鉴于ALP是临床常见的检查项目,开展99mTc-MDP SPECT/CT融合显像患者可进一步结合血清ALP水平协同诊断骨转移,对判定转移病灶的数目也有参考价值。本研究使用的骨显像示踪剂为99mTc-MDP,有研究[13]指出,其为非特异性反应骨代谢改变的显像,而18F-FDG示踪剂在发现融骨性转移灶上灵敏度较其高,且可避免由骨良性病变产生的假阳性,下一步可在示踪剂上作研究进一步提高诊断效能。
综上所述,血清ALP对提示肺癌骨转移有临床价值,其表达水平与骨转移数目相关,99mTc-MDP SPECT/CT融合显像和血清ALP联合检测可进一步提高肺癌骨转移的诊断效能,具有临床推广价值。

